AG3340对高糖诱导人视网膜色素上皮细胞迁移和侵袭的影响
2022-08-09张国明陈妙虹马大卉
郑 磊,张国明,陈妙虹,马大卉
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见和最严重的并发症之一,合并有黄斑水肿或进展为增殖期通常会对患者的视功能造成不可逆损害,目前DR已成为全球范围内最常见的致盲性疾病之一。纤维增生膜的产生是DR晚期的基本病理表现之一,可引起牵拉性视网膜脱离,临床处理相对棘手,因此阻止DR进展及纤维增生膜形成一直是研究的热点。视网膜色素上皮(retinal pigment epithelium,RPE)层介于视网膜神经上皮层和脉络膜之间,容易受到血糖波动的影响,大量研究已证实视网膜微环境持续高糖水平会影响RPE细胞功能而参与介导DR发病进展,如高糖环境会诱导RPE细胞凋亡,破坏视网膜外屏障而加剧水肿和渗出[1]、高糖环境会导致RPE细胞分泌大量炎症因子,包括肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β和IL-6促进DR进展[2]等。而最近的研究还发现高糖可以增强RPE细胞的迁移能力[3-4],可能参与DR纤维膜的形成,并且与RPE细胞内基质金属蛋白酶家族(matrix metalloproteinases,MMPs)的活化有关[5]。AG3340(普啉司他)是一种广谱的MMPs合成抑制剂,已被证实可用于抑制多种恶性肿瘤细胞的转移和侵袭[6]。近年研究发现,AG3340还可以拮抗部分眼底新生血管的形成[7-9],但目前尚缺乏AG3340在DR中的研究。本研究拟通过体外高糖条件下培养RPE细胞,探究AG3340对高糖状态下RPE细胞迁移和侵袭能力的影响及相关机制,以期为抑制晚期DR纤维膜的产生提供新的实验依据。
1材料和方法
1.1材料
1.1.1实验细胞人视网膜色素上皮细胞(human retinal pigment epithelial cells-19,ARPE-19)购自美国模式培养细胞物研究所(ATCC公司)。
1.1.2主要实验试剂和仪器DMEM/F12培养基、2.5g/L胰蛋白酶(美国Gibco公司),胎牛血清(FBS)(中美合资兰州民海生物),二甲基亚砜(DMSO)、AG3340(美国Sigma公司),Transwell小室(美国Corning公司),基质胶Matrigel(美国BD公司),MMP-9(ab228402)、MMP-2(ab92536)、Fibronectin(ab268021)及Collagen Ⅳ抗体(ab182744,英国Abcam公司)。微量加样器(德国Eppendorf公司),倒置荧光显微镜(日本Olympus公司),Odyssey双色红外成像系统(美国Licor公司)。
1.2方法
1.2.1细胞培养ARPE-19细胞常规培养于含10% FBS的DMEM/F12培养基(含1%青-链霉素),培养箱内温度为37℃,CO2体积分数为5%,每3d传代1次,取对数期生长的细胞进行实验。
1.2.2实验分组将ARPE-19细胞分为4组进行培养:(1)对照组(Control组):含5.6mmol/L葡萄糖的DMEM/F12培养基培养;(2)高糖(high glucose,HG)组:含30mmol/L葡萄糖的DMEM/F12培养基培养;(3)HG+AG3340组:用MMPs抑制剂AG3340预处理细胞12h后,再添加含30mmol/L葡萄糖的DMEM/F12培养基培养;(4)甘露醇(mannitol,MA)组:含5.6mmol/L葡萄糖和24.4mmol/L甘露醇的DMEM/F12培养基培养,作为渗透压对照组。
1.2.3划痕实验检测细胞迁移取对数期生长的ARPE-19细胞,制成细胞悬液,计数,以2×105个/孔铺于6孔板中,待细胞汇合度达90%以上,以200μL枪头垂直于6孔板底部划直线,人为制造细胞间距;用PBS洗细胞3次,去除划下的细胞,按照分组方案每孔加入等量培养液2mL继续培养细胞。分别在0、24、48h使用倒置显微镜随机选取3个视野拍照,用Image J软件测量划痕宽度。细胞迁移能力采用迁移率表示,细胞迁移率=(原划痕宽度-现划痕宽度)/原划痕宽度×100%。
1.2.4Transwell小室检测细胞侵袭取对数期生长的ARPE-19细胞,制成细胞悬液,计数,以2×105个/孔铺于6孔板中,待细胞贴壁后,按照分组方案每孔加入等量培养液2mL继续培养细胞48h;去除原培养基,PBS清洗1次,取少量胰蛋白酶消化并收集细胞;PBS清洗细胞3次,计数,重悬于无血清DMEM/F12培养基中;Transwell小室在加入细胞悬液前,需用Matrigel胶预先包被小室底部膜的上室内面,置于24孔板内,再于上室中加入细胞密度为1×105cell/mL的细胞悬液100μL,下室加入500μL含FBS的培养基,置于37℃、5%CO2培养箱继续培养48h;待终止培养后,取出小室,用棉签轻轻拭去上室内层未发生侵袭的细胞,4%多聚甲醛固定5min,0.2%结晶紫染色8min,清水洗去多余结晶紫,晾干后置于倒置显微镜下随机选取3个视野拍照,并计数发生侵袭的细胞数目。
1.2.5Westernblot检测相关蛋白表达水平按照分组处理ARPE-19细胞48h后收集细胞,PBS洗涤,并用RIPA裂解缓冲液溶解,4℃以13 000r/min离心10min。上清液蛋白采用SDS-PAGE凝胶电泳,转膜,并在室温下用5%脱脂奶粉封闭1h。MMP-9(1∶1 000)、MMP-2(1∶1 000)、Fibronectin(1∶500)及Collagen Ⅳ(1∶500)一抗孵育,加入相应比例的荧光二抗,避光孵育1h,并使用LICOR-Odyssey仪器扫膜分析。
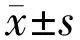
2结果
2.1AG3340抑制高糖诱导的ARPE-19细胞迁移能力细胞划痕实验发现,各组在划痕24h后的细胞迁移率总体比较差异具有统计学意义(F=72.02,P=0.001);MA组细胞迁移率(20.91%±0.92%)与Control组(21.00%±0.81%)相比差异无统计学意义(t=0.37,P=0.42);HG组细胞迁移率(46.33%±7.76%)明显高于Control组,差异具有统计学意义(t=0.29,P<0.001);采用2.5、5.0、10.0μg/mL AG3340预处理后,细胞迁移率分别为38.33%±3.51%、33.50%±2.29%、33.00%±2.01%,均较HG组降低,差异有统计学意义(t=2.74、0.59、3.18,均P<0.01)。各组在划痕48h后的细胞迁移率总体比较差异具有统计学意义(F=109.78,P<0.001);MA组细胞迁移率(31.33%±1.49%)与Control组(31.67%±1.53%)相比差异无统计学意义(t=0.62,P=0.35);HG组细胞迁移率(67.00%±1.73%)明显高于Control组,差异具有统计学意义(t=1.45,P<0.001);采用2.5、5.0、10.0μg/mL AG3340预处理后,细胞迁移率分别为54.67%±2.52%、47.00%±7.07%、47.33%±17.24%,均较HG组降低,差异有统计学意义(t=0.56、4.16、0.27,均P<0.01)。在划痕24、48h后AG3340 5.0μg/mL预处理的细胞迁移率均明显低于AG3340 2.5μg/mL预处理的细胞,差异具有统计学意义(均P<0.05),但与AG3340 10μg/mL预处理的细胞对比,差异无统计意义(均P>0.05),见图1。因此后续实验均选择5.0μg/mL作为AG3340预处理浓度。
图1 细胞划痕实验检测各组细胞的迁移能力 A:划痕实验细胞迁移图;B:各组细胞迁移率统计图。
2.2AG3340抑制高糖诱导的ARPE-19细胞侵袭能力Transwell小室实验发现,各组细胞侵袭数目总体比较差异具有统计学意义(F=104.97,P<0.001);MA组细胞侵袭数目(108.33±10.40个)与Control组(109.31±5.73个)相比差异无统计学意义(t=0.53,P=0.30);HG组细胞侵袭数目(336.00±22.55个)明显多于Control组,差异具有统计学意义(t=0.87,P<0.001);采用AG3340预处理后,细胞侵袭数目(238.67±13.89个)较HG组减少,差异具有统计学意义(t=0.29,P<0.01),见图2。
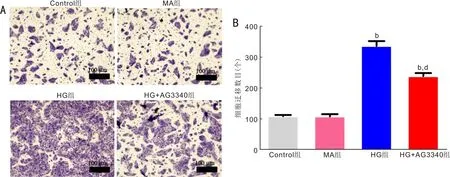
图2 Transwell小室检测各组细胞的侵袭能力 A:Transwell小室细胞侵袭图;B:各组细胞侵袭数目统计图。bP<0.01 vs Control组; dP<0.01 vs HG组。
2.3AG3340拮抗高糖诱导的ARPE-19细胞中相关蛋白表达Western blot检测结果显示,各组细胞中MMP-9、MMP-2、Fibronectin及Collagen Ⅳ蛋白相对表达量总体比较差异有统计学意义(F=89.72、49.43、50.06、76.64,均P<0.001)。MA组MMP-9、MMP-2、Fibronectin及Collagen Ⅳ蛋白相对表达量与Control组相比差异无统计学意义(t=1.43、0.29、0.48、3.33,均P>0.05);与Control组相比,HG组细胞MMP-9和MMP-2相对表达量增加,Fibronectin和Collagen Ⅳ相对表达量减少,差异均具有统计学意义(t=3.06、3.73、2.46、0.34,均P<0.001)。采用AG3340预处理后,细胞中MMP-9和MMP-2蛋白相对表达量均较HG组降低,Fibronectin和Collagen Ⅳ相对表达量均较HG组增加,差异具有统计学意义(t=1.14、6.21、0.49、3.70,均P<0.05),见图3,表1。
表1 各组细胞中相关蛋白的表达
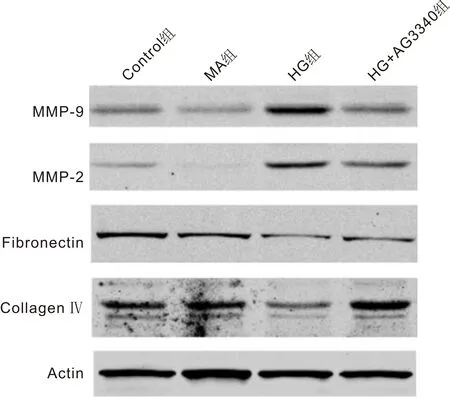
图3 Western blot 检测各组细胞内相关蛋白的表达。
3讨论
DR是目前全世界范围内工作年龄人群第一位的致盲性疾病,根据病变严重程度可分为非增殖性DR(nonproliferative diabetic retinopathy,NPDR)和增殖性DR(proliferative diabetic retinopathy,PDR),后者是DR的相对晚期阶段[10]。PDR在我国糖尿病患者人群中的比例约为3.3%~7.4%[11]。纤维增生组织、纤维增生膜的产生是PDR的基本病理表现之一,由此可产生牵拉性视网膜脱离等一系列严重并发症,损害患者的视功能[12]。如何抑制纤维增生膜的形成是挽救PDR患者视功能的关键。
目前关于PDR纤维化的形成机制尚无定论,复杂多样的病理因素交织在一起形成网络,相互影响,促进PDR纤维化的发生[13]。研究发现PDR纤维增生膜中的主要细胞成分包括RPE细胞和神经胶质细胞等[14],其中RPE细胞作为血-视网膜屏障的组成部分之一,承担着维护视网膜内环境稳态的重要作用,其功能紊乱与很多视网膜疾病存在关联[15]。由于RPE细胞紧邻脉络膜毛细血管层,其非常容易受到体内血糖浓度的影响。Farnoodian等[3]研究证实高糖会诱导体外培养的RPE细胞迁移能力明显增强,与增加氧化应激反应和色素上皮衍生因子的表达有关。Che等[4]也发现高糖会通过诱导RPE细胞的上皮-间质转化而促进细胞迁移。本研究使用30mmol/L葡萄糖刺激ARPE-19细胞,证实高糖不仅可以增加细胞的迁移能力,同时局部侵袭能力也明显增强。而RPE细胞一旦离开其自然位置后,会化生为巨噬细胞或成纤维样细胞,获得较强的分裂增生能力,并可以产生和分泌胶原或其他细胞外基质(extra-cellular matrix,ECM)成分,促进眼内纤维膜的形成[16]。因此,有效抑制高糖状态下RPE细胞迁移,对于遏制纤维增生膜的形成和阻止DR的进展至关重要。
MMPs家族是一组金属离子依赖的结构和功能同源的内肽酶家族,能降解ECM的多种蛋白成分,是促进细胞迁移和侵袭最重要的蛋白家族之一[17]。大量研究已证实,在PDR患者的玻璃体液和增生膜中MMPs表达明显增加[14,18-20]。这些MMPs来自于不同类型的细胞,包括血管内皮细胞、胶质细胞、RPE细胞等[21]。本研究发现,持续高糖环境使得ARPE-19细胞中的Fibronectin和Collagen Ⅳ降解明显,前者是ECM和基底膜中的主要非胶原性糖蛋白,在细胞黏附中起核心作用;后者则构成ECM的骨架。二者的降解势必会导致高糖环境下ARPE-19细胞迁移和侵袭能力增强。而高糖状态下ARPE-19细胞中MMP-2和MMP-9的表达明显上调,也证实了此种病理环境中ECM的降解确实与MMPs的活化有关。
AG3340是一种广谱的、有效的MMPs抑制剂,可以有效抑制MMP-1、MMP-2、MMP-3和MMP-9等[22]。AG3340已被证实对多种肿瘤细胞具有良好的抗癌效应,如黑色素瘤、人结肠癌、人胰腺癌、乳腺癌等,其作用机制与AG3340可以抑制肿瘤新生血管形成、肿瘤转移等相关[23]。此外,AG3340除了具有抗肿瘤效应,在眼科部分疾病中也被证实可能具有一定的治疗效用。既往研究报道AG3340可以降低外伤性增生性玻璃体视网膜病变(perliferative vitreoretinopathy,PVR)动物模型中牵拉性视网膜脱离发生的数量和比例,其机制可能与AG3340抑制PVR形成过程中MMPs的形成有关[5-6]。另有研究证实AG3340可以抑制动物模型中视网膜前膜(epiretinal membrane,ERM)的形成[24]。Garcia等[7]和Barnett等[8]发现无论是经腹腔注射或经玻璃体注射AG3340均可以显著抑制氧诱导视网膜病变(oxygen induced retinopathy,OIR)小鼠模型中视网膜新生血管的形成[7-8]。El Bradey等[9]报道经玻璃体腔内注射AG3340可以明显降低激光诱导的脉络膜新生血管兔模型新生血管渗漏的比例。上述研究证实,AG3340抑制MMPs在多种眼部疾病中具有应用价值,但对于AG3340是否会抑制PDR纤维增生膜的形成目前仍缺乏报道。本研究发现,用AG3340预处理ARPE-19细胞可以部分逆转高糖诱导的细胞迁移和侵袭能力增加,其潜在机制可能与AG3340抑制细胞中MMP-2和MMP-9的表达有关,部分逆转了高糖环境下细胞周围ECM组分(Fibronectin和Collagen Ⅳ)的降解,将更多的细胞稳定在其正常的生理位置。
PDR会给患者的视功能带来极大危害,早期筛查和针对性的视网膜激光光凝可以有效抑制PDR的发生。但由于血糖控制不佳或错过了早期诊治的时间窗,仍有很多NPDR患者会向PDR转变,尤其是在公共医疗体系不健全的国家。因此寻找其他能够阻止PDR形成的方法一直是研究热点。本研究利用体外细胞实验初步证实AG3340可以部分逆转高糖诱导的ARPE-19细胞迁移和侵袭,为寻找能够阻止PDR纤维膜生成及进展的有效药物提供了思路,但仍需大量动物实验和临床数据进行验证。
