家族性非综合征型先天缺牙2例
2022-08-09陈雪黎远皋
陈雪 黎远皋
北京大学第三医院口腔科,北京100191
先天缺牙是指口腔检查牙齿部分或全部缺失(不计第三磨牙),既往无牙齿脱落或拔牙史,X线检查颌骨内也未见该缺失牙的牙胚。根据是否伴发全身系统性疾病,先天缺牙常被划分为:1)非综合征型先天缺牙——仅有牙齿的先天缺失;2)综合征型先天缺牙——伴发其他器官系统的发育异常,如:少汗性外胚层发育不良、Rieger 综合征、唐氏综合征等。Schalk-van der Weide 等[1]将6颗以上恒牙的缺失归类为多数恒牙缺失(oligo‐dontia),此类缺失常与全身系统性疾病相关,但在健康的人群中也可见非综合征型牙齿缺失的病例。本文报道的2例先天多数恒牙缺失患者为同一家庭的成员,其缺牙表现与任何综合征均不相关,为临床上较为罕见的家族性非综合征型先天缺牙病例。
1 病例报告
病例1,先证者,男,17 岁,2018 年7 月因多数乳牙未替换于北京大学第三医院口腔科就诊。患者既往无遗传病、传染病、严重感染、创伤等病史,无拔牙史。身体发育尚可,面容和智力表现正常,四肢、心、肺、脊柱未见发育异常,皮肤、毛发、指甲、皮脂腺、汗腺无异常。其父母非近亲结婚,母亲孕期未接受X 线照射,未服用过药物,患者无外胚层异常或癌症病史。
患者口内检查可见混合牙列,恒牙仅可见17、16、11、21、24、26、27、36、46 牙萌出,54、53、52、62、63、71、72、73、74、75、81、82、83、84、85 牙滞留。萌出的恒上切牙外形呈铲形,切端可见发育沟。滞留乳前牙均可见不同程度磨耗,松动Ⅱ~Ⅲ度。上下颌咬合为深覆,上下颌牙齿排列稀疏(图1A~C)。锥形束CT(cone beam computer tomography,CBCT)示:除第三磨牙外,15、14、13、12、22、23、25、31、32、33、34、35、37、41、42、43、44、45、47 恒牙胚缺失,27 牙根尖孔开敞,牙根未发育完全,54、52、62、71、72、73、74、81、82、83 滞留乳牙牙根吸收,颌骨发育良好,骨密度正常(图1D)。
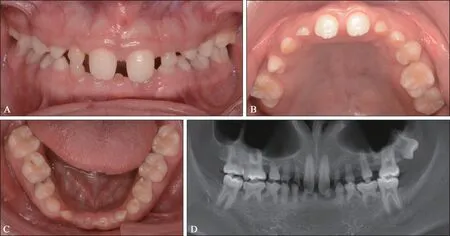
图1 先证者口内像及CBCTFig 1 Intra-oral imaging and CBCT examination of the proband
病例2,先证者姐姐,28 岁,全身情况良好。口内检查见:11、12、14、16、17、21、22、24、26、27、31、33、34、36、37、41、43、44、46、47 牙萌出,53、55、63 牙滞留(图2A~C)。CBCT 示:除第三磨牙外,13、15、23、25、32、35、42、45 恒牙胚缺失,35、45 缺牙区牙槽嵴顶高度降低,牙槽骨萎缩(图2D)。先证者的父母等其他亲属均无先天缺牙表现。
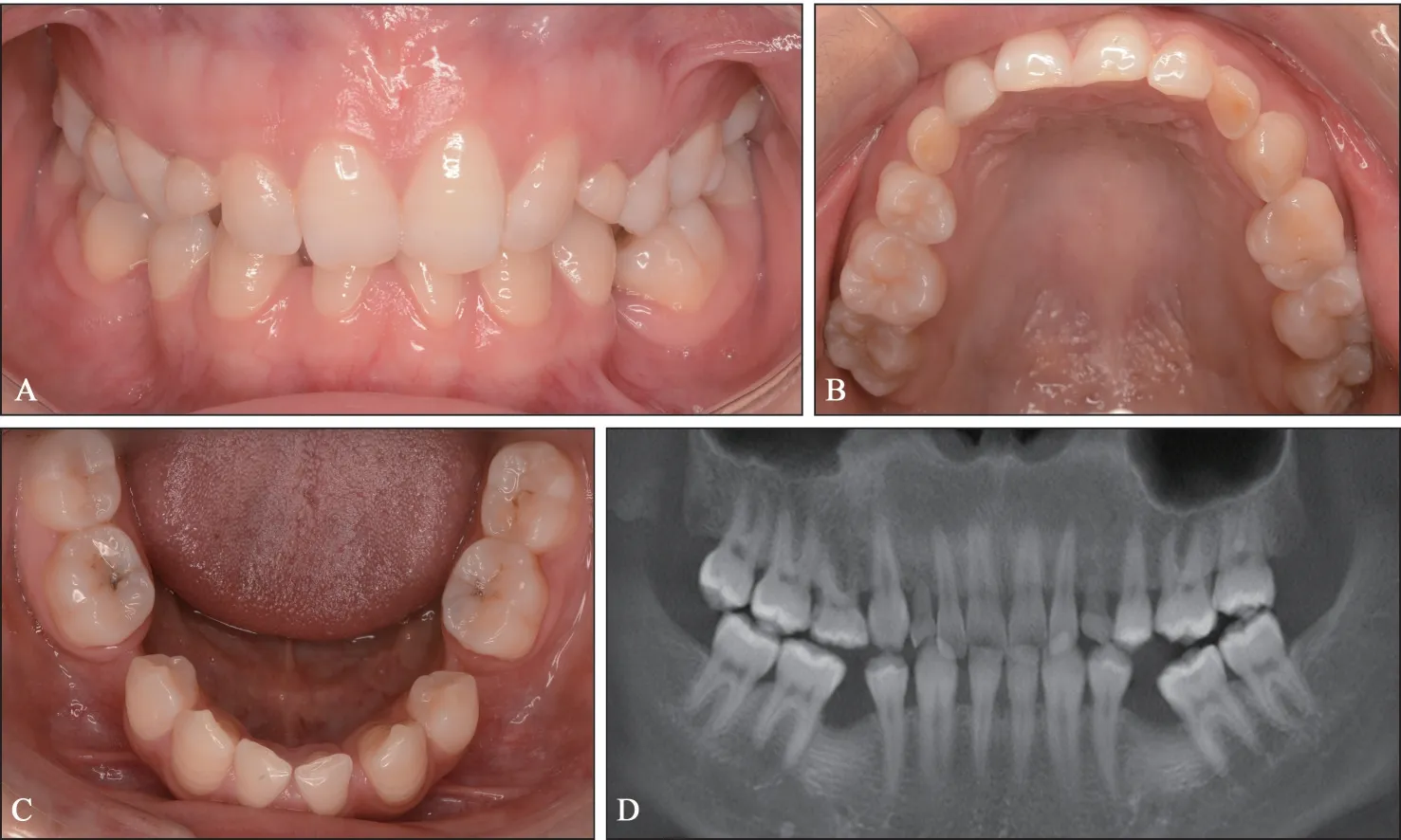
图2 先证者姐姐口内像及CBCTFig 2 Intra-oral imaging and CBCT examination of the proband’s sister
对以上2个病例进行评估,患者为同一父母的后代,先天牙的临床表现与任何综合征均不相关,最终诊断为家族性非综合征型先天缺牙。拟对患者行正畸联合修复治疗,以达到完整牙列的咬合状态。
2 讨论
先天缺牙的发病原因与环境和遗传因素有关[2],但具体的病因机制并不明确。目前最受支持的病因学理论认为,先天缺牙遵循多基因遗传模式,显性上位基因或环境因素(如感染、创伤、药物、放射线照射、环境污染和牙胚发育期间营养不良等)对相关基因表型的表达可产生一定影响[3],从而干扰牙胚形成的启动和增殖过程。但相较于环境因素,遗传因素在先天缺牙中发挥着更为关键的作用[4]。
非综合征型先天缺牙可遵循常染色体显性遗传[5]、常染色体隐性遗传[6]或X染色体连锁[7]遗传模式,在外显率和表达率方面均有显著差异。如果是常染色体显性遗传,兄弟姐妹中约有50%的人患牙缺失,如果是常染色体隐性遗传,兄弟姐妹中约有25%的人患牙缺失。先天缺牙不同的表现型可能是由不同的基因引起的[8],目前,已发现多个基因的突变与先天缺牙相关:肌节同源盒基因(muscle segment homeobox gene,MSX)、成对盒基因9(paired box gene-9,PAX9)、轴抑制蛋白基因2(axis inhibitor-2,AXIN2)、Wnt 家族成 员(Wnt10A和WNT10B)、外胚叶发育不全基因(ec‐todysplasin,EDA)、角蛋白17 基因(keratin 17,KRT17)、低密度脂蛋白受体相关蛋白6(recombi‐nant low density lipoprotein receptor related protein 6,LRP6)、干扰素调节因子6(interferon regula‐tory factor 6,IRF6)、转化生长因子α(transform‐ing growth factor α,TGFα)、成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR-1)等。MSX1 是最早发现的与先天缺牙有关的基因,多遵循常染色体显性遗传方式[8-9]。先前的研究已经在MSX1 中发现了10 多个与先天缺牙相关的突变[10],所有这些突变都是杂合的,缺失的牙齿可能是由于MSX1 蛋白单倍体功能不全造成[11]。受影响的个体缺失了大量的牙齿(多数超过10颗),各个牙位的缺失都可见累及[12]。目前已发现超过50种的PAX9基因变异可引发先天缺牙[13],在大多数病例中,PAX9 的变异遗传方式是常染色体不完全显性遗传,PAX9 变异的形式可以从单个的核苷酸替换从而导致氨基酸变化、过早终止和蛋白功能丧失,到单倍剂量不足的发生[14]。PAX9 变异程度越重,先天缺牙就越严重。分离出PAX 基因变异的个体均缺失下颌第二磨牙,且上颌中切牙易表现为过小牙[15]。β-连环蛋白结合蛋白AXIN2的无义突变可导致家族性先天缺牙[16]。Liu 等[17]研究发现,8 种AXIN2 突变与综合征型或非综合征型先天缺牙有关,其中,6种突变可引发非综合征型先天缺牙,在这6 种突变中,5 种是错义突变,1 种是移码突变。虽然AXIN2 突变患者缺失牙齿的位置并不相同[18-19],但在所有病例中,AXIN2突变的患者至少缺失7 颗牙齿,表明AXIN2 的任何变化都可能导致严重的牙齿发育不全。
先天缺牙的患病率在不同国家、地区和种族之间有差异[20-25],如伊朗为7.66%~9.1%[22-23],德国为8.1%~11.3%[24-25]。另外,患病率的差异可能与研究方法不同也有关[26-28]。有的研究是从随机选择的健康人群中采集资料[29],有的研究是从口腔科就诊的患者中采集资料,而这些患者中以正畸病例占比较多,这些可能会使结果产生偏倚[30]。
关于先天缺牙的牙位,一般来说,在前牙、前磨牙和磨牙3种牙位类型中,每种类型最远端牙齿的先天缺失最为常见[27-28]。Sheikhi 等[31]研究表明,最常见的缺失牙是下颌第二前磨牙,其次是上颌第二前磨牙、上颌侧切牙和上颌第一前磨牙。Polder等[26]研究表明,最常见的先天缺失牙是下颌第二前磨牙,其次是上颌第一前磨牙和上颌第二前磨牙。Endo 等[32]和Rahardjo[33]的研究结果相似,缺失牙最常见的是下颌第二前磨牙,其次是上颌侧切牙和下颌侧切牙。上颌第一前磨牙、尖牙和第一磨牙较少见先天缺失[32]。本病例中,姐弟口内均可见上、下颌第二前磨牙和下颌侧切牙的先天缺失,符合以往研究中常见缺失牙位的规律,除此之外,姐弟口内还可见尖牙的先天缺失,这在以往研究中较为罕见。
关于先天缺牙的数目,回顾既往研究,先天缺牙的群体中75%~90%的患者缺失数目不超过2颗[9,26-28,30],约10%的患者有3颗或3颗以上的缺牙,不同研究间的统计结果略有差异[9,21,26-27,30]。Rakh‐shan 等[34]的Meta 分析研究表明,从人群中随机抽取的先天缺牙患者平均每人缺牙1.5 颗,而从口腔患者或正畸患者中来源的先天缺牙患者平均每人缺牙2 颗。Heuberer 等[35]的单中心研究结果表明,先天缺牙的数目可能与性别特异性相关,男性患者先天缺牙数目更多,先天缺牙的类型可能更为严重。
除了牙齿的缺失,先天缺牙患者口内还可伴发其他异常表现,如牙齿发育迟缓、牙齿尺寸减小、上颌尖牙异位萌出、牙根短、釉质发育不良、牙本质发育不全、牛牙症和“钉状”(peg-shaped)上颌侧切牙等[9,28,36]。但Wisth 等[37]提出先天缺牙与牙齿大小、牙弓宽度的变化无关,仅与牛牙症或“钉状”切牙等牙齿的形态变化相关。有研究[38]推测先天缺牙与牛牙症一样,是以细胞有丝分裂活性降低为特征的综合征的一部分,分裂活性的降低可能会影响牙胚发育。本病例中,弟弟上切牙牙冠呈锥形,左上颌第二磨牙发育迟缓,除此之外,姐弟口内余留牙均未发现牛牙症、釉质牙本质发育不良等异常表现。
对于口腔颌面外科、口腔种植学、儿童口腔学、正畸学和修复学的专家来说,先天多数缺牙的治疗是一个跨学科的挑战[39]。早期诊断和治疗具有重要意义。早期过渡性修复治疗应在患者7~9岁时开始,以维持正常的外貌、发音和咀嚼习惯,尽量减少先天缺牙给患者社会交往带来的不良心理影响[39]。通过多学科合作,最终在临床上达到牙弓中线一致和排列良好的目标,从而获得患者可接受的美观效果,以及稳定的咬合与牙周状况[40]。
缺牙间隙既可以直接修复,也可以通过正畸手段关闭。当患者缺牙数目大于4颗时,通常需要正畸关闭部分间隙后再修复剩余的缺牙间隙。一般来说,缺牙数目增多,需要关闭的间隙会相应减少。而当患者伴发反、深覆、深覆盖,甚至出现无法掩饰的骨性错等问题时[41],正畸治疗就不仅是关闭间隙,还需要纠正相应的错畸形,必要时可以考虑结合正颌手术进行治疗。
在修复治疗中,相较于种植,自体牙移植是更优的选择。对于先天缺牙患者,可通过拔除第三磨牙行自体移植的方法修复无牙间隙,从而达到增加咬合牙齿数量的目的[9]。自体移植的牙齿可通过牙周膜的生理刺激,维持牙槽骨体积的稳定[8]。而骨融合式种植体会限制牙槽骨的生长发育,因此为了防止种植体的下沉,种植应在面部生长发育完成后再进行[8]。不同个体的面部生长发育完成年龄差异较大,男性常见于18~19岁,女性常见于17~18岁。当下切牙缺失时,需要根据上下颌前牙的关系进行美观和功能的修复[30]。当前磨牙缺失时,乳磨牙可能滞留原位,由于存在咬合过低或渐进性牙根吸收的风险,有学者[42]建议拔除乳磨牙后通过正畸关闭间隙;也有学者[43]建议尽可能延长乳磨牙在牙弓的存留时间,待乳磨牙缺失后再用自体移植牙或种植牙替代。
具体到某个病例治疗方案的选择,除了考虑缺失牙数目、余留牙的位置情况外,还需考虑其他多种因素,如牙周状况、牙槽骨量、患者的治疗愿望以及社会和医学因素等,以确保为患者提供完善的个性化治疗计划[40]。本病例中男性患者有3 处连续超过3 颗恒牙缺失,由于缺失牙程度较重,患者存在牙槽骨吸收以及错畸形等问题,这些需要先通过正畸重新排列牙齿。在正畸过程中,弓丝可粘接于滞留乳牙上,考虑到拔牙过程可加重牙槽骨吸收,拔牙应推迟至后期修复时。由于缺失牙数目较多,修复时可考虑游离端缺失的可摘局部义齿或种植体支持的可摘局部义齿。本病例中女性患者的牙位缺失均为不连续的单个牙缺失,缺牙宽度6~14 mm,该类缺牙可选择的修复方法较多。可首先以正畸的方法集中或关闭间隙,而后根据力、间隙分布等情况选择适宜的固定义齿、可摘局部义齿或种植义齿修复方式,以达到完整牙列的咬合状态。
综上,非综合征型先天缺牙较为罕见,临床表现多样,致病的具体病因和相关机制不明。先天缺牙的早期诊断和治疗具有重要意义。先天缺牙的治疗和管理是一个长期而复杂的过程,需要多学科专家间的共同协作。
利益冲突声明:作者声明本文无利益冲突。
