动物冠状病毒检测方法的研究进展
2022-08-09范紫玮郑田利陈嘉熠裴晓方
何 迅,游 兰,范紫玮,郑田利,陈嘉熠,裴晓方
冠状病毒(Coronavirus,CoV)是有包膜的单股正链RNA病毒,病毒直径约80~120 nm,从1937年首次在鸡身上分离出冠状病毒以来,共发现38种冠状病毒,其中有7种可感染人类,分别是HCoV-229E、HCoV-OC43、SARS-CoV、HCoV-NL63、HCoV-HKU1、MERS-CoV和SARS-CoV-2。其中,HCoV-229E、HCoV-OC43、HCoV-NL63和HCoV-HKU1主要引起普通感冒症状,而SARS-COV、MERS-COV、SARS-CoV-2可引起重症呼吸道综合征,甚至死亡[1]。研究表明,SARS-CoV和MERS-CoV均起源于蝙蝠冠状病毒,并分别通过果子狸和单峰骆驼传播至人[2]。研究发现冠状病毒作为RNA病毒,具有较高的变异率,在一定的条件下,两种不同基因类型的病毒在感染同一细胞时,病毒基因可通过重组变异产生新的病毒并适应新的宿主,导致不可预见的流行范围和致病性。已有研究发现犬冠状病毒(Canine coronavirus, CCoV)ORF3b区域缺失毒株可导致致命的感染和长期淋巴细胞减少,且可在犬巨噬细胞/单核细胞及人巨噬细胞中复制,具有可传染人的风险[3];还有从患有急性未分化热病的海地儿童血浆样品中鉴定出猪δ冠状病毒(Porcine deltacoronavirus,PDCoV)[4]。目前,虽然SARS-CoV-2仍溯源不明,有报道显示,针对11个代表性物种的大规模单细胞测序证明猫是SARS-CoV-2靶细胞比例最多的物种[5]。因此,为了避免动物成为将来各种冠状病毒的混合器和中间宿主,有必要对动物中冠状病毒的携带情况进行全面的监测。
1 检测动物冠状病毒的常用样品
已有研究发现,动物冠状病毒主要感染处于幼龄阶段的各类禽畜[6],常导致不同宿主的呼吸道和消化道感染,甚至造成肾脏和生殖系统的感染[7],严重时可导致禽畜死亡。有研究团队[8]用ELISA和RT-PCR对咳嗽、流涕、腹泻病牛的鼻拭子及粪便样品同时进行检测,结果显示,ELISA检测鼻拭子和粪便的BCoV检出率分别为48%和53%,而RT-PCR检出率分别为84%和96%,由此可见在动物冠状病毒的检测中,可针对研究目的采集不同感染阶段动物的不同部位。如表1所示,常见样本主要包括粪便、肛拭子、鼻咽拭子、气管组织和肠道组织等。

表1 常用于检测动物冠状病毒的样品
2 分离培养冠状病毒的细胞类型
动物冠状病毒常用传代细胞进行分离培养,不同病毒所用传代细胞类型如表2所示。在培养冠状病毒过程中,往往需要添加一些特殊的成分或同时盲传多代培养才能观察到细胞病变效应(Cytopathic effect , CPE),如在对PDCoV分离和培养过程中,需要添加胰酶、胰腺酶或未感染仔猪的小肠内容物[17];再如CCoV接种犬纤维肉瘤(A72)细胞系和犬肾上皮(MDCK)细胞,A72细胞系盲传至第7代24 h后才观察到明显CPE;而MDCK细胞在盲传第7代后仍无病毒生长[18]。
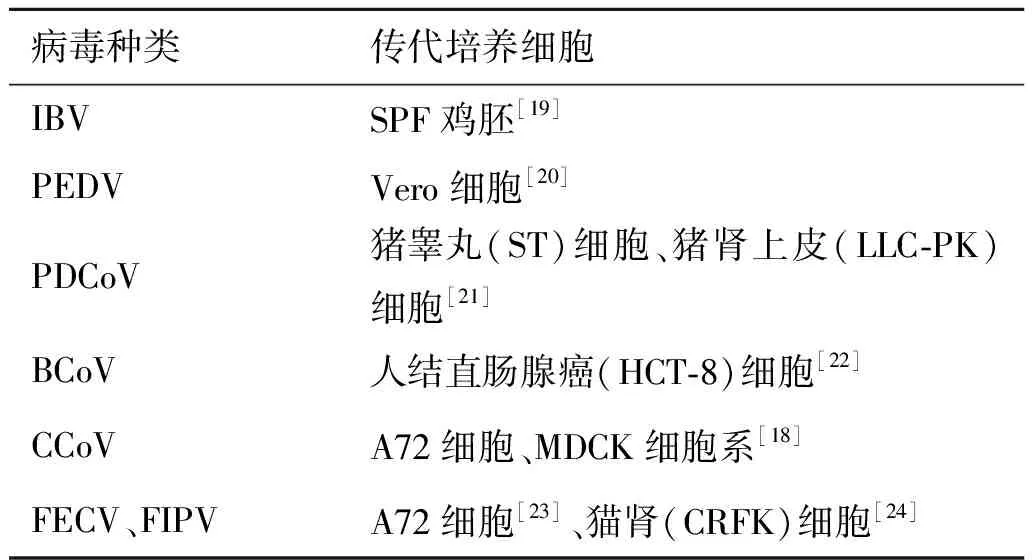
表2 常见分离培养动物冠状病毒的细胞类型
3 冠状病毒分子学检测技术
常用于检测冠状病毒核酸的技术包括逆转录-聚合酶链反应(Reverse Transcription-Polymerase Chain Reaction, RT-PCR)、逆转录环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)、基因芯片技术以及其它新兴技术等。应用最广泛的是普通RT-PCR。随着病毒变异和多重感染的情况出现,研究者们还建立了多种特异性更高、适用范围更广的核酸检测技术。
3.1 逆转录-聚合酶链反应 冠状病毒基因组结构相似,其基因组5′端具有甲基化的帽状结构,3′端具有poly(A)尾,基因组含有约7~10个功能基因,从5′端到3′依次为5′-ORF1a/b-(HE)-S-E-M-N-3′。ORF1ab主要编码病毒的非结构蛋白;剩下基因区域主要编码病毒的结构蛋白。S、E、M和N基因分别编码冠状病毒的刺突蛋白(Spike Protein,S)、包膜蛋白(Envelop Protein,E)、膜蛋白(Membrane Protein,M)和核衣壳蛋白(Nucleocapsid Protein,N),另外还有一些β属冠状病毒编码一种与包膜相关的结构蛋白血凝素酯酶蛋白(Hemagglutinin-esterase Protein,HE)。以PDCoV为例,病毒的基因组如图1所示。基因组结构的差异是冠状病毒分成不同类群的依据,针对差异的基因结构设计检测试剂盒可以有效地鉴别不同的冠状病毒。
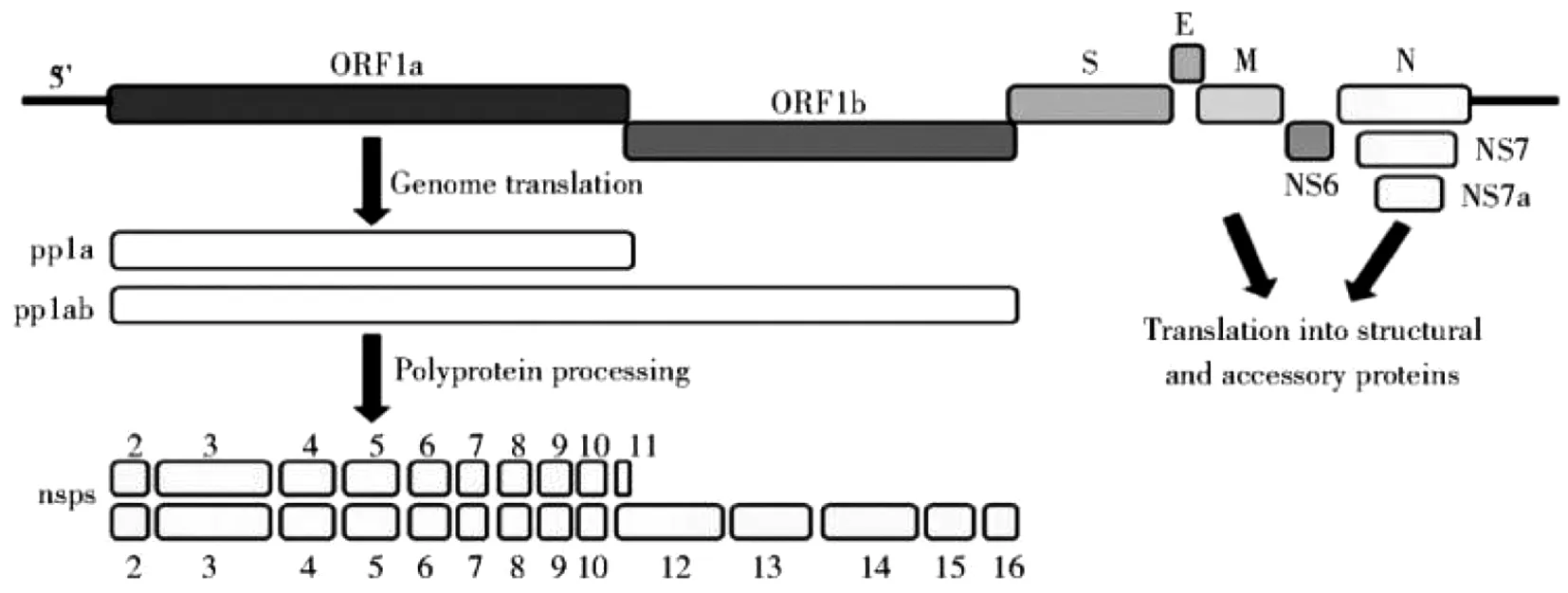
图1 PDCoV的基因组示意图[25]
冠状病毒作为RNA病毒,RT-PCR是检测其最常规的方法,但只能进行定性检测。实时荧光定量PCR技术通过检测荧光信号强度直接对产物进行定性分析和定量分析,具有高灵敏度、高特异性和高精准定量等优点。Xiu L团队[26]针对冠状病毒RNA聚合酶(RNA-dependent RNA polymerase, RdRp)基因设计了通用型引物,建立了一种新的半巢式逆转录RT-PCR方法,并在81份家禽拭子样品中检出25份冠状病毒阳性;109份猪拭子样本中检出1份阳性样本;31份活禽市场气溶胶样本中检出6份阳性样本。除上述通用引物PCR外,应用最普遍的就是分别针对各种冠状病毒的N[27]、M[28]、S[14]基因保守区域所建立的特异性RT-PCR。
除了上述针对一种冠状病毒的单一RT-PCR外,多个研究团队还建立了可同时检测2种及以上病原体的双重及多重RT-PCR或实时荧光PCR方法[13, 29-30]。这在诊断临床混合感染样品及监测疾病中具有较大的优势,但在引物设计、探针合成方面较为严格。
3.2 等温扩增法 常见的等温扩增技术包括环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)、重组酶聚合酶扩增技术(recombinase polymerase amplification, RPA)、滚环扩增技术以及依赖解旋酶等温扩增技术等。LAMP技术使用链置换型DNA聚合酶等温扩增,通过肉眼观察有无白色沉淀即可简单定性,可在15~60 min内实现109~1 010倍的扩增[31]。有学者建立了检测IBV的RT-LAMP方法[32],对268份不同类型的临床样本进行检测,平均检出率为98.65%;另外,该法用于检测PEDV[33]、PDCoV[34]等动物冠状病毒时均显示出较高的灵敏度和特异性。RPA技术是一种依赖于重组酶、单链结合蛋白和DNA聚合酶在常温条件下5~20 min即可完成的等温扩增技术。也有学者针对PDCoV N基因设计特异引物,建立了检测PDCoV的RPA方法[35],最低检测限度为103copies/μL,且检测结果比普通PCR方法更加准确。该技术也成功用于快速检测CCoV[36]。
3.3 基因芯片技术 基因芯片技术的原理为大量合成的DNA探针有序地固定在芯片载体表面成为基因芯片,待检样品经过扩增和标记后,与基因芯片杂交反应,扫描并分析杂交反应的信号,即可得到待检样品的基因信息。基因芯片技术减少了传统检测技术中为同时检测多种病原而增加多种引物带来的非特异性反应的发生概率,对于多种病原混合感染的诊断显示出较大的优势,推动了基因芯片技术在病原检测方面的应用。
胡靖飞团队[37]建立了联合检测猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒A群与猪δ冠状病毒4种猪肠道病毒的寡核苷酸芯片并进行了临床应用,可同步快速区分4种仔猪腹泻,为仔猪腹泻的鉴别诊断和高通量筛查提供了新技术。熊炜研究团队[38]在大量构建特异克隆的基础上筛选,制备了可同时检测并区分CCoV、FECV、和FIPV的特异性基因芯片。
3.4 基因测序技术 冠状病毒具有遗传多样性,容易发生变异和跨种传播。2020年3月以来,先后有多个国家报道了多起SARS-CoV-2动物感染疫情,荷兰、丹麦等国家还出现了人-水貂-人的传播链条[39-40],当冠状病毒出现跨种传播时,原病毒在新宿主体内是否发生变异从而形成一种新的病毒,单靠一般检测技术无法进行准确判别,只能对其基因序列进行测序,进而分析其基因结构以及构建进化树,从而进行病毒溯源。
测序技术是指测定基因组DNA分子中每一个碱基的排列顺序,与数据库比对后进行分类。这项技术几乎可以识别临床上所有病原微生物,尤其在面对未知病原体检测方面,不需对病原体进行分离培养,也不需要依赖已知序列才可设计引物进行扩增和检测。适合于病原体初期识别和病毒溯源,具有特异性高及准确性好等特点,但由于检测周期长,并且对仪器设备和检测人员要求严格,并不适用于快速大量检测。
3.5 其他技术 纳米PCR可用于检测动物冠状病毒含量较低的样品,它是在普通PCR的基础上加入具有优良导热性的纳米金颗粒,可缩短扩增时间,同时能特异性吸附单链DNA分子,从而减少非特异性扩增[41]。Zhu Y等[30]用纳米RT-PCR和普通RT-PCR同时检测病猪的粪便样本,两种方法对PEDV的检出率分别为48.2%和45.6%,且经比较,纳米RT-PCR的灵敏度是普通RT-PCR的10倍,检测下限也明显高于后者。
数字PCR(Digital PCR,dPCR)是近年发展起来的一种核酸绝对定量的检测技术,其原理可理解为分散成无数个独立反应单元的定量PCR,从而实现单分子意义上的绝对定量检测,扩增结束后读取各个反应单元的阴性或者阳性荧光信号并采用泊松分布的统计学方法进行分析,即可计算出原始样本的模板拷贝数[42]。蓝柯团队开发了用于检测SARS-CoV-2的微滴式数字PCR(Droplet digital PCR,ddPCR),检测下限值是RT-PCR的1/500,且临床总体准确率达到94.3%[43]。虽然目前dPCR用于动物冠状病毒的诊断仍处于起步阶段,但其在快速、灵敏和准确定量患畜样品中病毒载量方面具有巨大潜力。
4 免疫学检测
免疫学方法应用于动物冠状病毒的检测较为常见,根据抗原抗体特异性反应的基本原理,可通过检测样本中病毒蛋白或者机体产生的相应抗体来确诊。冠状病毒的S、M、E和N蛋白这4种蛋白常作为免疫检测的特异性靶点。目前,常用的一些免疫学方法包括血清中和实验、酶联免疫吸附实验(ELISA)、免疫胶体金试纸、间接免疫荧光技术(Indirect immunofluorescence,IF)等。对于采集不同的动物样本,综合考虑灵敏度、特异度和准确性等因素选择合适的方法。如针对动物血清样本,常采用血清中和实验、ELISA、IF等方法检测抗体,其中血清中和实验和ELISA都适用于大批量血清学调查,但都存在交叉反应的缺点。ELISA由于具备很好的灵敏度、特异度和稳定性,是目前实验室使用最广泛的检测方法之一,如对PDCoV[44]、BCoV[45]等的检测。ELISA也可用于动物组织、粪便等样本的病原检测[46]。而免疫胶体金试纸则在操作简便、检测速度上更有优势。如今,市面上已有一些动物冠状病毒免疫检测试剂盒的研制和开发,但由于方法本身的缺点、样本复杂性以及交叉反应性等,也易产生假阳或假阴性从而不能准确诊断。因此对于动物冠状病毒的检测,免疫学方法常用作初筛和进一步基因检测和临床诊断的辅助手段。
5 小 结
非典、中东呼吸综合征以及新冠肺炎疫情的发生表明,冠状病毒从动物跨种传播到人类会严重危害人类健康和社会的发展。在“全健康”理念下,加强对动物冠状病毒的监测和研究、及早发现潜在的威胁人群健康的动物病毒、共同促进人和动物健康显得尤为重要。
目前已经建立了多种检测动物冠状病毒的方法,然而每一种方法各有优缺点,单一的技术不足以解决临床样本检测中的所有问题。细胞分离培养虽然作为病毒诊断的金标准,但它耗时费力不便于快速检测,仅适用于实验室病原体的研究;虽然作为目前最常用的检测技术,但PCR技术对设备要求高且具有一定的检出下限,同时易交叉污染,出现假阳性或假阴性结果;等温扩增检测技术虽具有灵敏度高、扩增速度快以及无需变温等优势,但也存在引物设计复杂、容易出现假阳性等弊端;基因芯片技术虽具有准确且高通量的优点,但成本相对较高,对于临床样本检测的实用性不强。免疫学手段虽能检测病毒的抗体或抗原,但不适合于早期诊断,不利于及时发现病毒。基因测序技术作为确定病毒种类和病毒溯源的有力方法,但不适用于疫情暴发时的快速诊断。数字PCR虽能准确定量病毒含量,但现在仍处于初步发展阶段。因此,未来开发新型的冠状病毒检测技术应以快速、灵敏、高效和准确为主要特征,可从电化学、试纸条、数字化及纳米技术等方向出发,开发出具有快速诊断、低成本、高灵敏度和不需专业人员操作的检测技术,为传染病早期监控提供技术保障。
利益冲突:无
引用本文格式:何迅,游兰,范紫玮,等.动物冠状病毒检测方法的研究进展[J].中国人兽共患病学报,2022,38(1):42-47.DOI:10.3969/j.issn.1002-2694.2021.00.166
