大豆分离蛋白-壳聚糖美拉德反应产物的 制备及功能特性
2022-08-09刘佳哲吴小芝张东娜王喜萍
◎ 路 畅,刘佳哲,吴小芝,张东娜,王喜萍
(吉林农业科技学院,吉林 吉林 132001)
目前,国内外关于大豆分离蛋白-多糖美拉德反应的研究大多以美拉德反应机理的研究为主,其原材料多糖使用葡萄糖、乳糖、麦芽糖较多,本试验原材料壳聚糖的选择相对比较新颖。对于反应产物的研究现有的多是抑制褐变、保鲜以及和氨基酸(酪氨酸)的相互作用等方面,有关其功能特性的研究少之又少,此次试验将为以后的研究提供依据。
已知大豆分离蛋白是以大豆粕为原料生产的食品添加剂,营养全面,是可替代动物蛋白的植物蛋白,含约90%蛋白质,氨基酸种类齐全[1-3]。单独的大豆分离蛋白无法拥有多个特性,难以进一步应用,因此对大豆分离蛋白进行改性,具有重要意义[2-3]。甲壳素N-脱乙酰基生成碱性多糖壳聚糖,与甲壳素、纤维素化学结构相近,具有细胞亲和性、生物降解性和生物效应等性质,壳聚糖2C位上是氨基,与甲壳素、纤维素不同,活性更强,因此具有更优异的生物学功能,可用于化学修饰[4]。本试验以二者为原料进行美拉德反应(天然化学改性),进一步提升蛋白质的功能特性(如乳化活性、乳化稳定性、起泡性和溶解性等)[5]。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(山东爱采生物科技有限公司);壳聚糖(苏州美亿辰生物科技有限公司)。
DPPH粉末、HCl、NaOH、NaCl、甲醇、pH 7.0的磷酸缓冲液及十二烷基硫酸钠(均为天津市鼎盛鑫化工有限公司);花生油(市售);试验用水均为蒸馏水。
1.2 仪器与设备
AL-2045电子天平,上海菁海仪器有限公司;HH-4恒温水浴锅,国华电器有限公司;SY-720超声波清洗机,昆山超声仪器公司;BCD-221WDPT冰柜,青岛海尔股份有限公司;DHL-820A恒温鼓风干燥箱,上海精宏实验设备有限公司;H2050R高速冷冻离心机,湖南湘仪试验室仪器开发有限公司;SK-1快速混匀器,金坛市城东新瑞仪器厂;V-721PC紫外分光光度计,上海驰唐仪器设备有限公司。
1.3 大豆分离蛋白-壳聚糖美拉德反应条件优化
1.3.1 工艺流程
大豆分离蛋白-壳聚糖美拉德反应产物制备的工艺流程为:大豆分离蛋白+壳聚糖→混合→搅拌→调pH→反应釜反应→冷却→透析→不同分子量美拉德反应产物。
1.3.2 0.1 mol·L-1DPPH溶液的配制
用分析天平称取DPPH粉末0.004 g,用甲醇溶解,100 mL容量瓶定容,制得0.1 mol·L-1的DPPH溶液。
1.3.3 测定美拉德反应产物DPPH清除率
取3只比色管,分别加入以下物质。①加入样液2 mL、0.1 mol·L-1DPPH溶液6 mL。②加入样液2 mL、甲醇溶液6 mL。③加入甲醇溶液2 mL、0.1 mol·L-1DPPH溶 液6 mL。然 后 分 别 以3 500 r·min-1离 心 20 min,测定其在517 nm波长的吸光度。美拉德反应产物DPPH清除率的计算公式为:
美拉德反应产物DPPH清除率=

式中:A1为管①的吸光值;A2为②管的吸光值;A3为③管的吸光值。
1.4 单因素试验
在试验中,有许多的因素影响大豆分离蛋白-壳聚糖美拉德反应产物的生成。主要有大豆分离蛋白∶壳聚糖(质量比)、反应温度、反应时间以及反应pH。
1.4.1 大豆分离蛋白∶壳聚糖(质量比)对大豆分离蛋白-壳聚糖美拉德反应的影响
将大豆分离蛋白与壳聚糖按1.0∶0.5、1.0∶1.0、1.0∶1.5、1.0∶2.0和1.0∶2.5(质量比)比例配制反应物,进行大豆分离蛋白与壳聚糖的美拉德反应,反应温度60 ℃,反应时间80 min,反应pH值为4,以反应产物的DPPH清除率为考察指标,确定大豆分离蛋白∶壳聚糖的较佳值。
1.4.2 反应温度对大豆分离蛋白-壳聚糖美拉德反应的影响
按优化的大豆分离蛋白-壳聚糖配制反应物(从试验中得到的质量比),分别选取反应温度40 ℃、 50 ℃、60 ℃、70 ℃和80 ℃,进行大豆分离蛋白与壳聚糖的美拉德反应,反应80 min,反应pH值为4,以反应产物的DPPH清除率为考察指标,确定大豆分离蛋白-壳聚糖美拉德反应的较佳反应温度。
1.4.3 反应时间对大豆分离蛋白-壳聚糖美拉德反应的影响
按优化的大豆分离蛋白-壳聚糖配制反应物(从试验中得到的质量比、反应温度),分别选取提取时间40 min、60 min、80 min、100 min和120 min,反应pH值为4,进行大豆分离蛋白与壳聚糖的美拉德反应,以反应产物的DPPH清除率为考察指标,确定大豆分离蛋白-壳聚糖美拉德反应的较佳反应时间。
1.4.4 反应pH对大豆分离蛋白-壳聚糖美拉德反应的影响
按优化的大豆分离蛋白-壳聚糖配置反应物(从试验中得到的质量比、反应温度、反应时间),分别选取提取pH值为2.0、3.0、4.0、5.0和6.0,进行大豆分离蛋白与壳聚糖的美拉德反应,以反应产物的DPPH清除率为考察指标,确定大豆分离蛋白-壳聚糖美拉德反应的较佳反应pH。
1.5 正交试验设计
根据单因素试验的结果,以大豆分离蛋白-壳聚糖质量比、反应的温度、时间以及pH为影响因素,DPPH清除率为评价指标,完成正交试验,确定最优反应组合。因素水平表见表1。
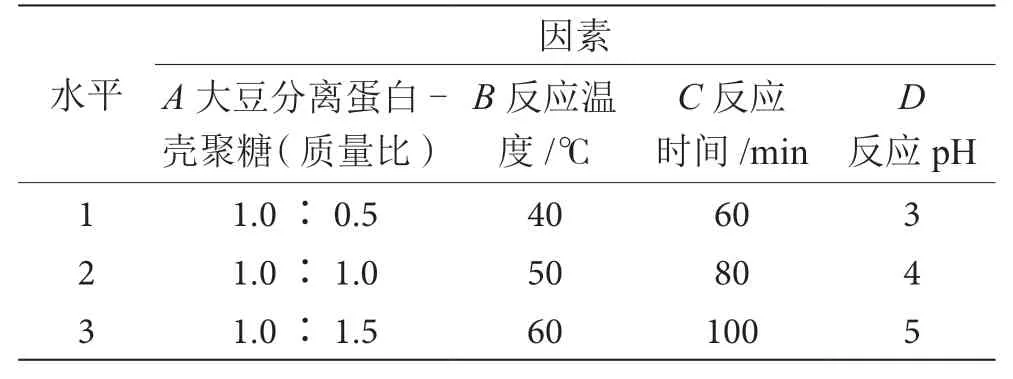
表1 正交试验因素水平表
1.6 大豆分离蛋白-壳聚糖美拉德反应产物的纯化(样品纯化)
以正交试验得出的最优反应条件组合进行大豆分离蛋白-壳聚糖美拉德反应产物的制备。采用3 500 Da 和8 000 Da的透析袋进行透析,得到分子量<3 500 Da、 分子量为3 500~8 000 Da、分子量>8 000 Da的样液,烘干后得到样品,用于功能特性的测定。
1.7 大豆分离蛋白-壳聚糖美拉德反应产物功能特性的测定
1.7.1 乳化活性的测定
称样品0.1 g溶解于20 mL、pH值为7.0的PBS缓冲液(0.05 mol·L-1),充分搅拌,水化30 min,加入 4.0 mL花生油,均质(8 000 r·min-1、1 min)。迅速从乳液下端量取100 L乳浊液,离散到10 mL 0.1%的月桂醇硫酸钠溶液中,于500 nm波长下测定该稀释液的吸光度A0,吸光度A0与界面面积呈正相关[6-7]。乳化活性的计算公式如下:
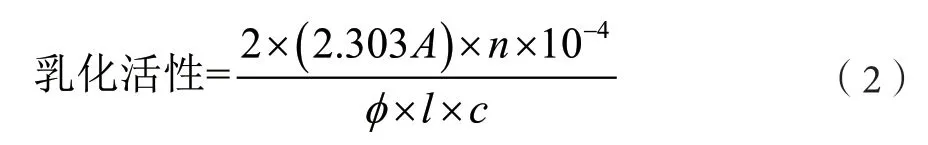
式中:A为大豆分离蛋白,m²·g-1;n为稀释倍数;ϕ为体系中油相所占的比例,本试验为0.2;c为蛋白质溶液的浓度,g·mL-1;l为比色池光径,本试验为1 cm。
1.7.2 乳化稳定性的测定
上述样品静置15 min,从下端量取100 μL乳浊液,离散于10 mL 0.1%的月桂醇硫酸钠溶液中,测定 500 nm波长的吸光度At[6-7]。乳化稳定性以es表示,计算公式如下:
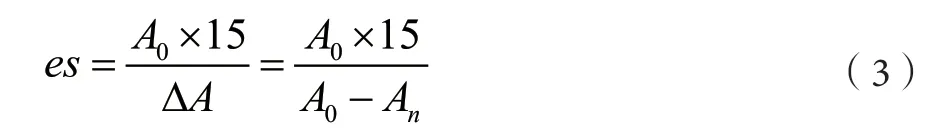
式中:A0为0时刻吸光值;An为n时刻时吸光值;ΔA为Δt内吸光值差。
1.7.3 起泡性的测定
起泡性的测定采用搅打发泡测定法,即用pH值为7.0的PBS缓冲溶液溶解样品,配成3%的乳浊液。取200 mL 3%乳浊液,打泡(8 000 r·min-1、3 min),测泡沫体积,记录为V0[8-9]。按下式计算起泡度(FAI):
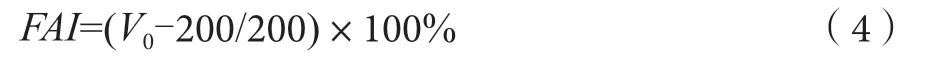
静置30 min,测泡沫体积,记录为VT[7-8]。按下式计算泡沫稳定性(FS):

1.7.4 溶解性的测定
称取样品100 mg,15 mL蒸馏水溶解,用低浓度NaOH或HCl溶液调节pH,搅拌30 min,离心 (4 000 r·min-1、30 min)。凯氏定氮法测定该pH条件下可溶性蛋白质含量及总氮含量[8-9]。溶解度计算公式如下:

2 结果与分析
2.1 单因素试验结果与分析
2.1.1 大豆分离蛋白-壳聚糖质量比对大豆分离蛋白-壳聚糖美拉德反应产物的影响
由图1可知,随着大豆分离蛋白-壳聚糖质量比的减小,DPPH清除率呈现出先增大后减小的趋势,大豆分离蛋白-壳聚糖质量比为1.0∶1.0的DPPH清除率最大,即大豆分离蛋白-壳聚糖美拉德反应产物的物料比为1.0∶1.0时产量最优。
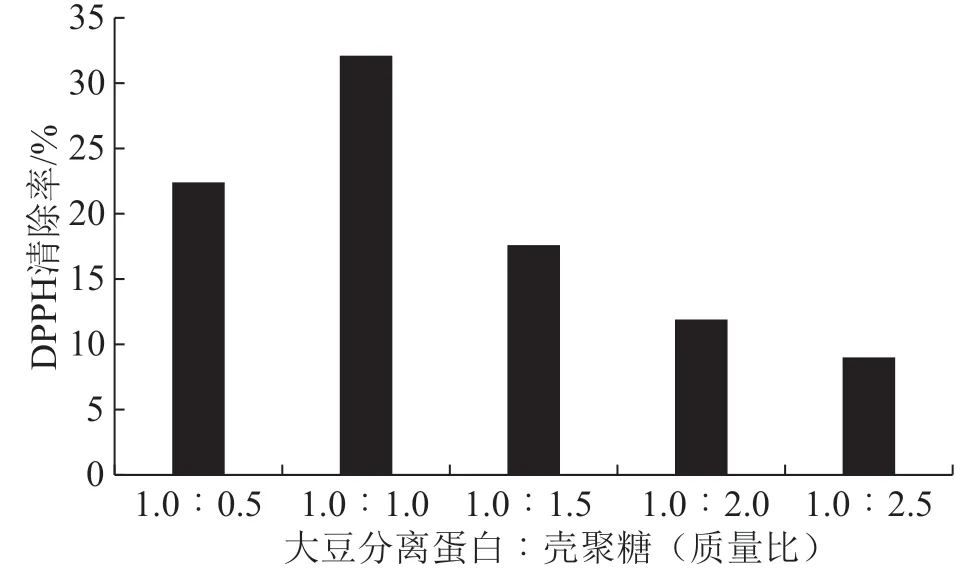
图1 大豆分离蛋白∶壳聚糖(质量比)对反应产物的影响图
2.1.2 反应温度对大豆分离蛋白-壳聚糖美拉德反应产物的影响
由图2可知,随着反应温度的升高,DPPH清除率呈现出先增大后减小的趋势,反应温度为50 ℃的DPPH清除率最大,即大豆分离蛋白-壳聚糖美拉德反应产物的反应温度为50 ℃时为最优反应条件。
2.1.3 反应时间对大豆分离蛋白-壳聚糖美拉德反应产物的影响
由图3可知,随着反应时间的增加,DPPH清除率呈现出先增大后减小的趋势,反应时间为80 min的DPPH清除率最大,即大豆分离蛋白-壳聚糖美拉德反应产物的反应时间为80 min时产量最优。
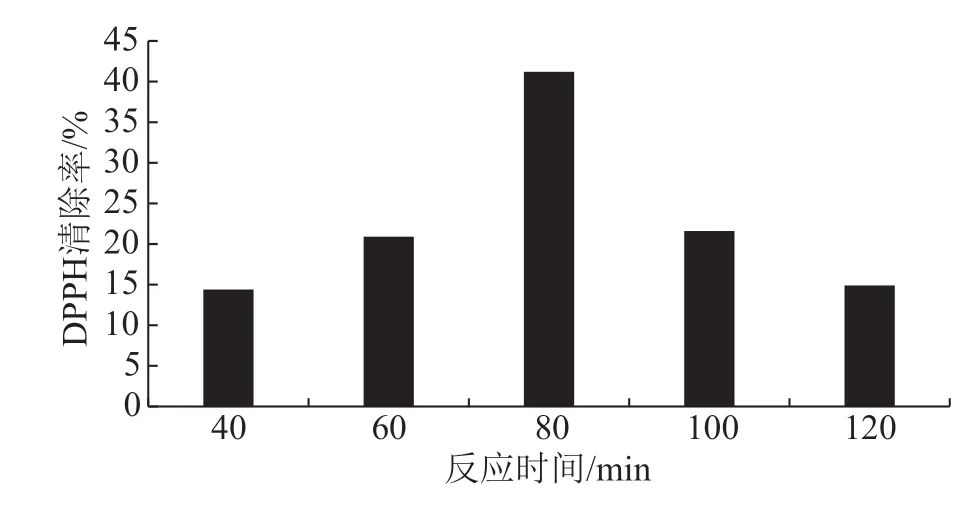
图3 反应时间对大豆分离蛋白-壳聚糖美拉德 反应产物的影响图
2.1.4 反应pH对大豆分离蛋白-壳聚糖美拉德反应产物的影响
由图4可知,随着pH值的增大,DPPH清除率呈现出先增大后减小的趋势,pH值为4的DPPH清除率最大,即大豆分离蛋白-壳聚糖美拉德反应产物的反应pH值为4时产量最优。
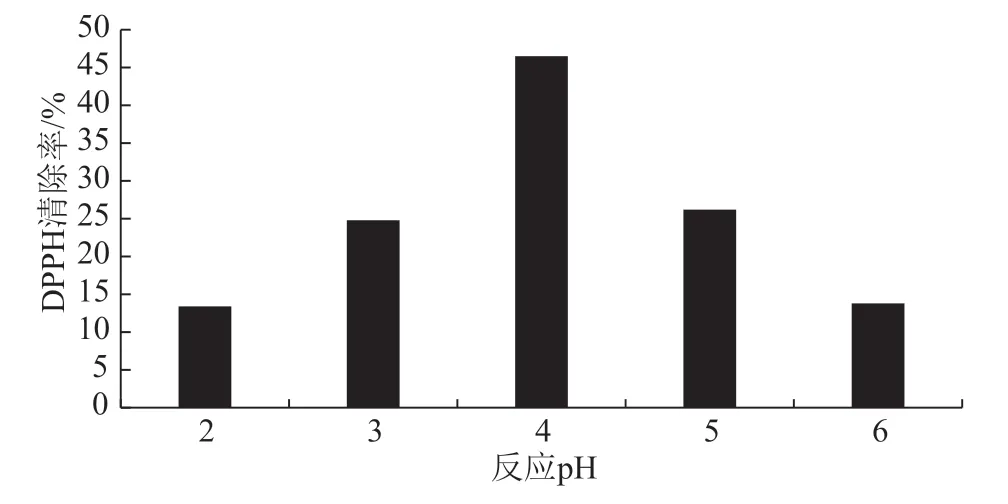
图4 反应pH对大豆分离蛋白-壳聚糖美拉德 反应产物的影响图
2.2 正交试验结果分析
以DPPH清除率为考察指标,在单因素试验的基础上,分别选取大豆分离蛋白∶壳聚糖(质量比)、反应温度、反应时间以及反应pH 4个影响因素的3个较佳水平,进行L9(34)正交试验,最终确定最佳反应条件。试验结果见表2。
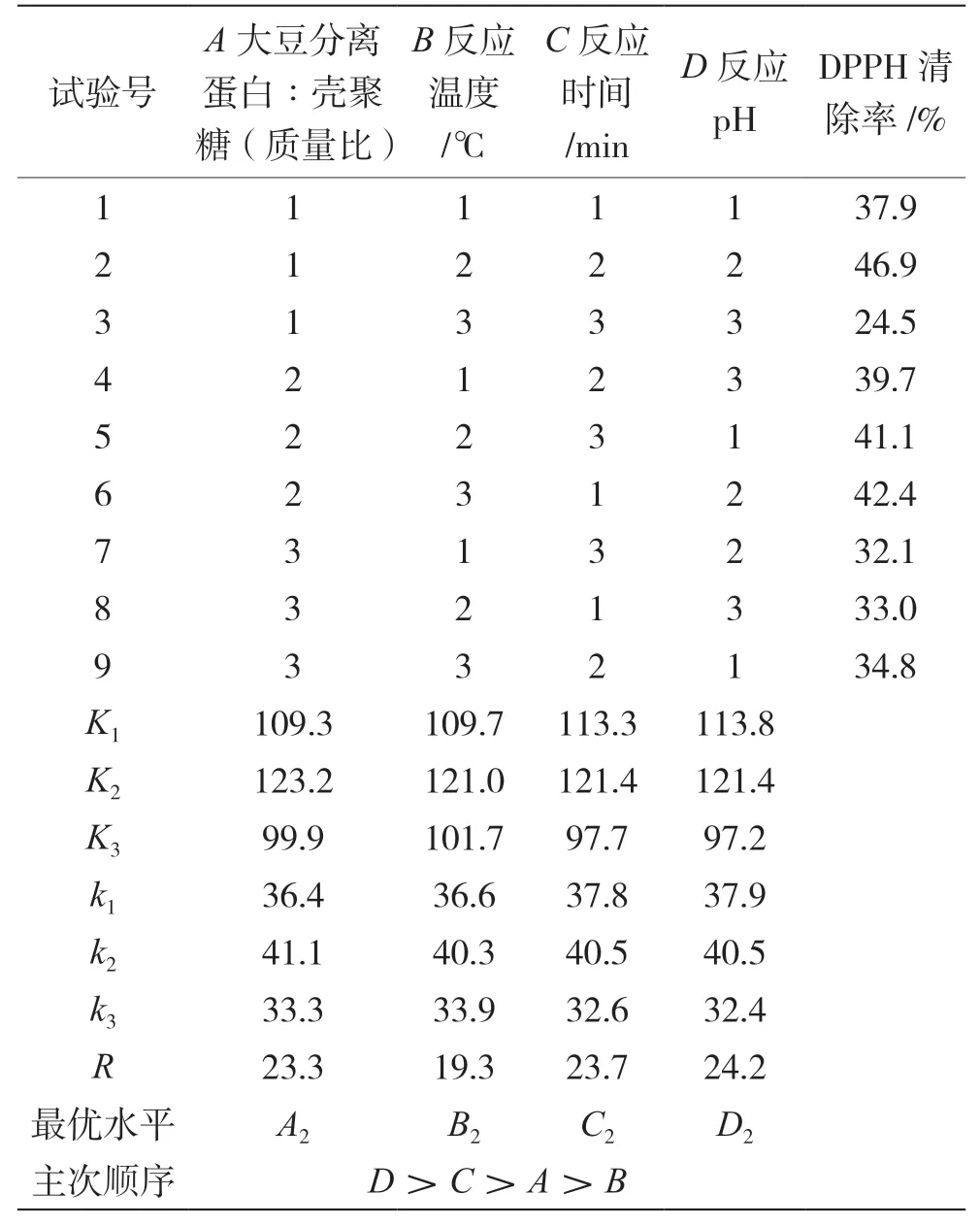
表2 正交试验结果表
由表2可知,4种因素的主次顺序是反应pH>反应时间>质量比>反应温度,其中反应pH影响程度明显最大。根据表中的极差分析法可以对最优水平进行判断,最佳设计方案为A1B2C2D2(46.9%),而由K值分析可知,最佳组合应为A2B2C2D2,因此对两种组合分别做3次试验验证,再求其平均值。试验验证结果表明,A1B2C2D2组合条件下的美拉德反应产物DPPH清除率为46.3%,A2B2C2D2组合条件下的美拉德反应产物DPPH清除率为为48.7%,因此A2B2C2D2为最佳条件,即最佳反应条件为大豆分离蛋白∶壳聚糖(质量比)1∶1,反应温度50 ℃,反应时间 80 min,反应pH 4。
2.3 大豆分离蛋白-壳聚糖美拉德反应产物功能特性的测定
2.3.1 乳化活性的测定结果
根据公式(2)计算样液的乳化活性,结果如图5所示。大豆分离蛋白-壳聚糖美拉德反应产物会透析成不同分子量的反应产物,分子量为3 500~8 000 Da的DPPH清除率较高,即该阶段的反应产物乳化活性较好。分子量<3 500 Da和分子量>8 000 Da的美拉德反应产物的DPPH清除率相差不多,其乳化活性相似。
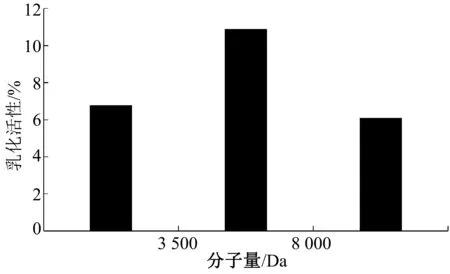
图5 乳化活性的测定结果图
2.3.2 乳化稳定性的测定结果
根据公式(3)计算样液乳化稳定性,结果如图6 所示。大豆分离蛋白-壳聚糖美拉德反应产物会透析成不同分子量的反应产物,3 500~8 000 Da的美拉德反应产物的DPPH清除率较高,即该阶段的反应产物乳化稳定性较好。
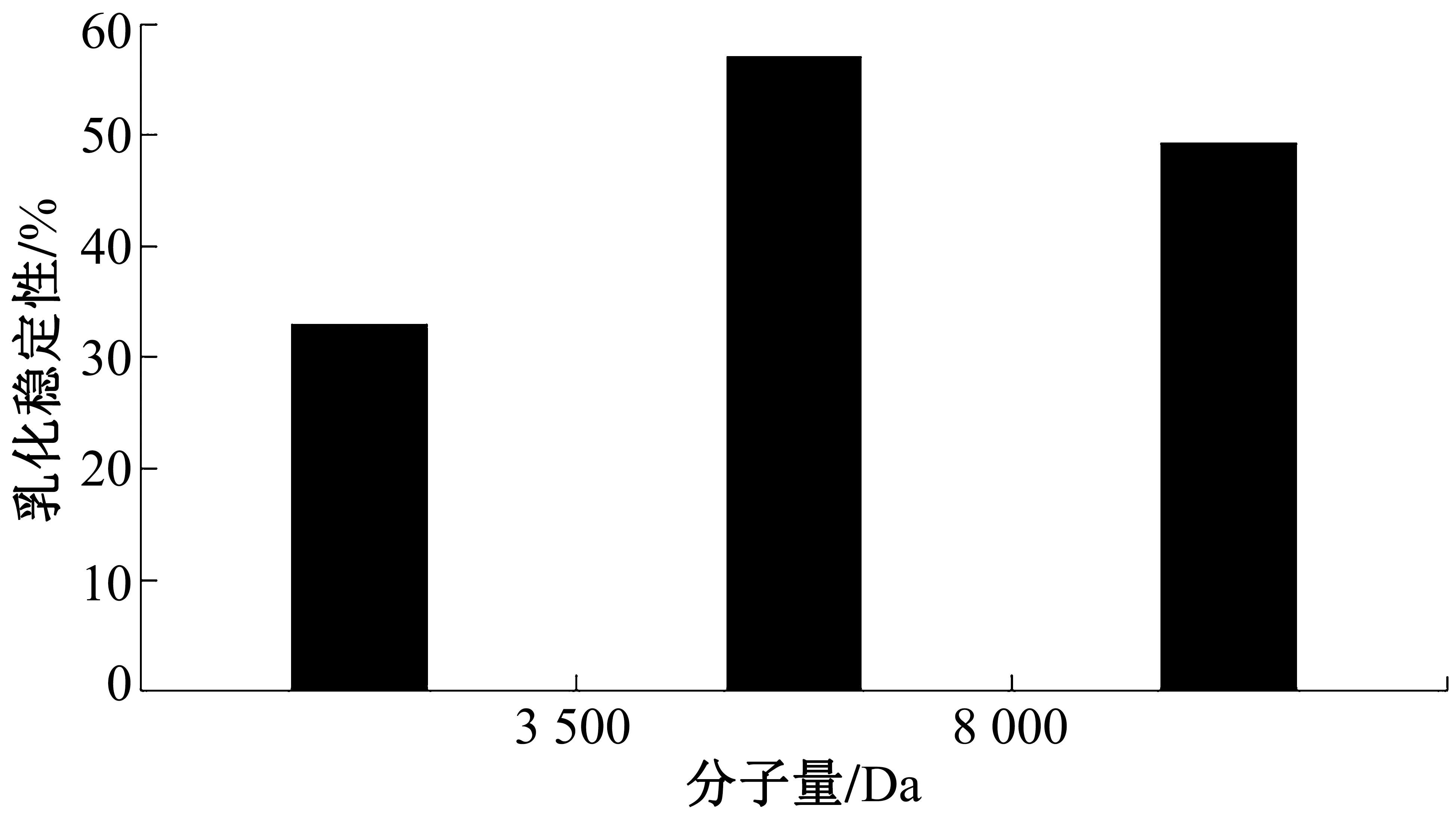
图6 乳化稳定性的测定结果图
2.3.3 起泡性的测定结果
按公式(4)计算样液起泡度,结果如图7所示。大豆分离蛋白-壳聚糖美拉德反应产物会透析成不同分子量的反应产物,3 500~8 000 Da的美拉德反应产物的DPPH清除率较高,即该阶段的反应产物起泡度较好。分子量<3 500和分子量>8 000的美拉德反应产物的DPPH清除率相差不大,其起泡度 相似。
按公式(5)计算样液起泡稳定性,结果如图8所示。大豆分离蛋白-壳聚糖美拉德反应产物会透析成不同分子量的反应产物,3 500~8 000 Da的美拉德反应产物的DPPH清除率较高,即该阶段的反应产物起泡稳定性较好。分子量<3 500 Da和分子 量>8 000 Da的美拉德反应产物的DPPH清除率相差不大,其起泡稳定性相似。
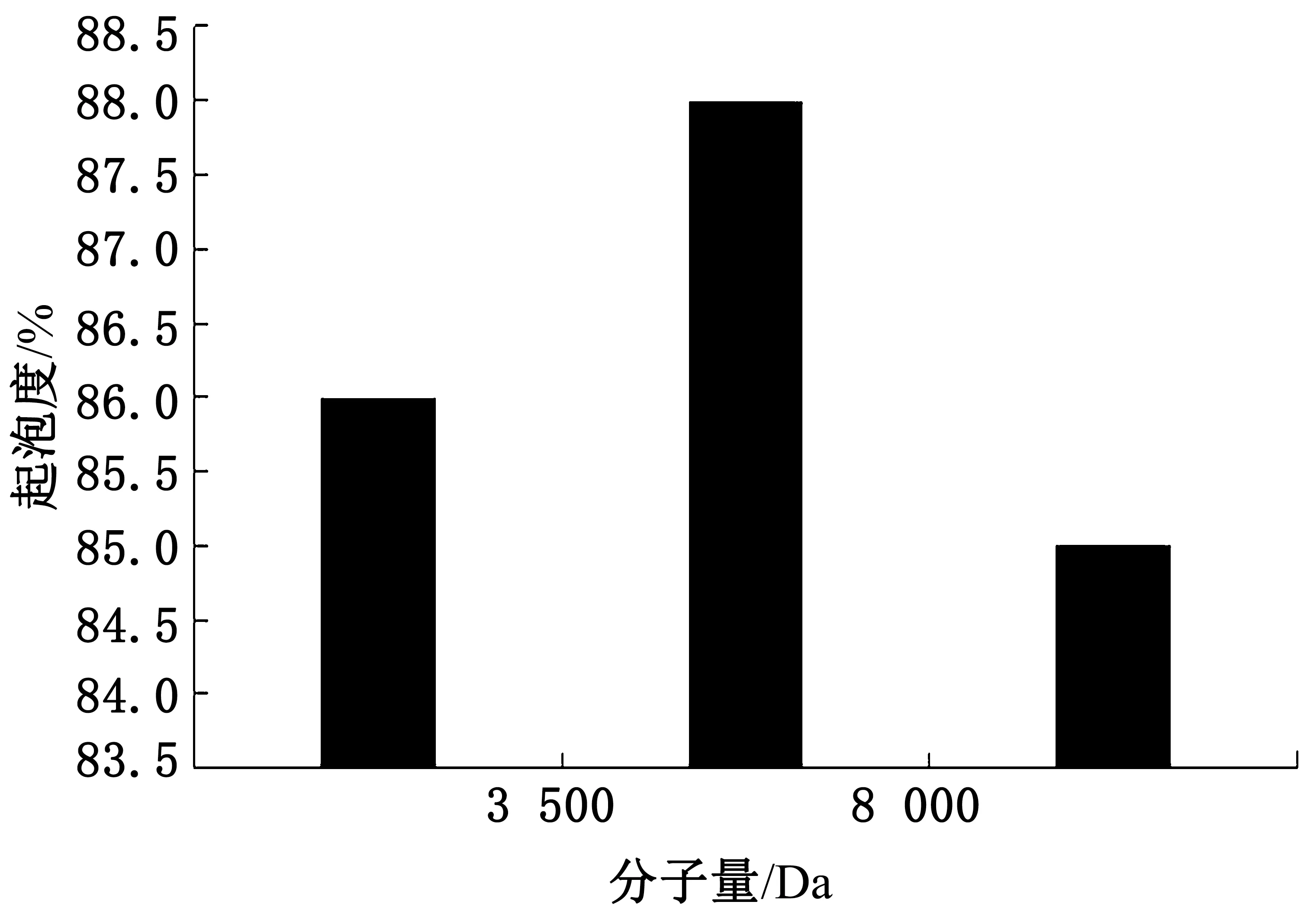
图7 起泡度的测定结果图
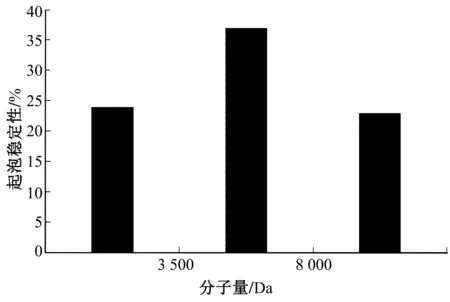
图8 起泡稳定性的测定结果图
2.3.4 溶解性的测定结果
利用公式(6)计算溶解度,结果如图9所示。大豆分离蛋白-壳聚糖美拉德反应产物会透析成不同分子量的反应产物,3 500~8 000 Da的美拉德反应产物的DPPH清除率较高,即该阶段的反应产物溶解性较好。分子量<3 500 Da和分子量>8 000 Da的美拉德反应产物的DPPH清除率相差不大,其溶解性相似。
3 结论
本试验以大豆分离蛋白和壳聚糖为原料在反应釜内进行美拉德反应,使大豆分离蛋白得到化学改性,使其功能特性得到提高。实验结果表明,不同的物料比、反应温度、反应时间和反应pH都会影响大豆分离蛋白与壳聚糖美拉德反应产物的生成,由单因素试验和正交试验得出最佳反应条件为大豆分离蛋白∶壳聚糖(质量比)1∶1、反应温度50 ℃、反应时间80 min、pH 4。该研究结果将为大豆分离蛋白-壳聚糖美拉德反应的制备起到指导性作用。利用上述试验结果,进行反应产物的制备,并用透析袋进行透析得到不同分子量(<3 500 Da、3 500~8 000 Da、> 8 000 Da)的美拉德反应产物,进行功能特性的分析。结果表明3 500~8 000 Da的美拉德反应产物的乳化活性、乳化稳定性、起泡性以及溶解性最高, 而<3 500 Da 和>8 000 Da的美拉德反应产物的各个功能特性相近。美拉德反应是蛋白质化学改性的天然方法,能够使其功能特性得到一定程度的提高。
