UPLC-MS/MS 分析绿茶中12 种酚酸类物质
2022-08-09黄永桥于以竹毛敏霞简银池吴新文
卢 专,黄永桥,于以竹,毛敏霞,简银池,吴新文
(贵州省检测技术研究应用中心,贵州贵阳 550014)
关键字:绿茶;超高效液相色谱-串联质谱;酚酸
茶叶因其特殊风味和保健功效,深受消费者喜爱。茶叶中富含多种营养成分,如茶多酚、咖啡碱、氨基酸、有机酸、茶多糖及矿物元素等,其中酚酸类化合物含量约占鲜叶干重的5%[1-2]。酚酸类物质主要是没食子酸、咖啡酸等形成的简单酚酸和奎宁酸、没食子酸、咖啡酸等形成的缩合衍生物,如鞣花酸、间双没食子酸、绿原酸等[3-4]。研究表明,酚酸在许多药用植物中作为活性成分发挥药理作用,如绿原酸具有利胆、抗菌、降压、增高白细胞及兴奋中枢神经系统等功效;鞣花酸具有抗菌、抗突变、抗癌及增白等功效[5-7]。因此茶叶中酚酸化合物的含量测定对其生物活性研究具有重要意义。
目前,酚酸化合物的含量测定方法主要有薄层色谱法[8]、毛细管电泳法[9]、高效液相色谱法[10-12]、液相色谱-质谱法[13-15]、气相色谱法[16]和气相色谱-质谱法[17]等。高效色谱-质谱法具有选择性强、灵敏度高、抗干扰能力强和结果准确可靠等特点,是测定酚酸含量常用的分析方法之一。
本研究以遵义市、都匀市、雷山县3 个地区的绿茶作为研究对象,采用高效液相色谱-串联质谱仪,通过优化仪器及前处理条件,建立分析测定方法,并对建立的方法进行方法学验证。通过建立的分析测定方法对不同产地的绿茶进行分析测定,计算各酚酸的含量,通过对不同产地的绿茶中12 种酚酸物质含量差异进行分析,探讨酚酸含量的差异与产地是否存在联系,以期为茶叶化学分类方法提供更多的数据支持。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈(均为色谱纯),德国Merck 公司;没食子酸(99.35%),德国Dr.Ehrenstorfer 公司;甲酸(色谱纯)、鞣花酸(99.9%),上海安普实验科技股份有限公司;绿原酸、新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、咖啡酸、对香豆酸和邻香豆酸(纯度>95%),天津阿尔塔科技有限公司;间双没食子酸(98.2%),美国Cayman 公司;实验室用水均为超纯水。
茶叶样品分别购自湄潭、雷山、都匀3 个地区茶叶生产企业生产的60 批次绿茶,均选取当地茶叶进行生产的绿茶,其中湄潭24 批次、雷山23 批次、都匀13 批次。
1.2 仪器与设备
三重四极杆质谱仪(Agilent 6470,配ESI 源)、超高效液相色谱仪(Agilent 1290),美国Agilent 公司;GM200 刀式研磨粉碎仪,德国Retsch 公司;超声波清洗器,上海科导超声仪器有限公司;UMV-2 多管涡旋混合器,北京普立泰科仪器有限公司;L-550 离心机,湖南湘仪离心机仪器有限公司;Milli-Q 超纯水机,美国Millipore 公司。
1.3 方法
1.3.1 标准溶液配制
准确称取上述12 种酚酸标准品,分别加入甲醇溶解并定容至刻度,配制浓度为1.0 mg/mL 的标准储备液,于-18℃保存。用80%甲醇溶液稀释标准储备液,配制浓度为0.02 μg/mL、0.05 μg/mL、0.20 μg/mL、0.50 μg/mL、1.00 μg/mL、2.00 μg/mL、5.00 μg/mL 和10.00 μg/mL 的系列标准工作液,现配现用。
1.3.2 色谱条件
色 谱 柱ZORBAX Eclipse Plus-C18(150 mm×2.1 mm,1.8 μm), 美 国Agilent 公 司; 流 速0.3 mL/min;柱温40 ℃;进样体积2.0 μL;流动相A 为0.1%乙酸水溶液,B 为乙腈。
梯 度 洗 脱 程 序 为0 ~0.5 min,2.0%B;0.5 ~6.0 min,2.0% ~16.0%B;6.0 ~9.0 min,16.0% ~42.0%B;9.0 ~10.0 min,42.0% ~46.0%B;10.00 ~10.01 min,46.0%~95.0%B;10.01 ~11.00 min,95.0B%;11.00 ~11.01 min,95.0% ~2.0%B;11.01 ~12.0 min,2.0%B。
1.3.3 质谱条件
电喷雾离子源:负离子扫描;多反应监测;毛细管电压为3.5 kV;雾化器压力为40 psi;干燥气流速为10 L/min;干燥气温度为325 ℃;鞘气流速为10 L/min;鞘气温度为325 ℃;目标物质谱参数见表1。

表1 质谱参数
1.3.4 样品前处理
称取粉碎后的茶叶样品0.50 g 于50 mL 具塞离心管中,准确加入20 mL 80%甲醇溶液,超声15 min,涡旋振荡30 min,5 000 r/min 离心10 min,取上清液过膜上机。
1.4 数据处理
实验数据计算采用Excel 2016 版,图谱绘制采用Origin 2018 版,Bayes 判别分析采用SPSS 22.0 版。
2 结果与分析
2.1 质谱条件优化
采用0.5 μg/mL 的标准溶液,在负离子模式下全扫描质谱得到各目标物一级碎片离子,优化去簇电压,对母离子进行二级质谱扫描,得到子离子特征碎片质谱图,选择响应值高、基线噪声低的两对离子对作为定性和定量离子对,进一步优化碰撞能量及其他质谱参数,得到最优的质谱条件。
2.2 色谱条件优化
比较了Agilent Poroshell SB-a(q100 mm×2.1 mm,2.7 μm)、Agilent Poroshell SB-C18(100 mm×2.1 mm,2.7 μm) 和Agilent ZORBAX Eclipse Plus C18(150 mm×2.1 mm,1.8 μm)。结 果 表 明,Poroshell SB-aq 和Poroshell SB-C18两根色谱柱未能有效分离出12 种酚酸化合物,且两根色谱柱的色谱峰响应和峰型较差,Eclipse Plus C18色谱柱分离较好,峰形尖锐,且各物质的响应值均高于另外两根色谱柱。考察了水相中加入甲酸、乙酸及甲酸铵对目标物离子化效率和灵敏度的影响,结果表明,0.1%乙酸溶液对目标物的分析灵敏度最好。进一步考察以甲醇和乙腈为有机相,甲醇条件下目标物相应增加但对于异绿原酸A、B 和C 3 种同分异构体分离较差。因此,选用0.1%乙酸溶液和乙腈为流动相。采用梯度洗脱程序,12 min 内,各物质能较好分离,图1 为12 种酚酸标准溶液总离子流图。

图1 混合标准溶液总离子流图
2.3 前处理优化
选取超纯水、甲醇和乙醇作为提取溶剂,结果发现采用超纯水对目标物提取效率低于甲醇和乙醇提取溶剂的提取率。在此基础上,进一步对比不同比例的甲醇溶液和乙醇溶液的提取率。结果表明,使用80%甲醇溶液为提取溶剂时提取效率最好。实验前期对超声提取和涡旋振荡提取时间进行考察。因此,本实验选用体积分数80%甲醇溶液超声提取15 min,涡旋振荡提取30 min 作为样品提取方法。
2.4 方法学验证
2.4.1 标准曲线
使用配制的系列标准工作液,以标准溶液质量浓度对峰面积做标准曲线(见表2)。结果表明,12种酚酸在0.02 ~10.00 μg/mL,线性关系良好,相关系数r>0.991,适用于定量分析。
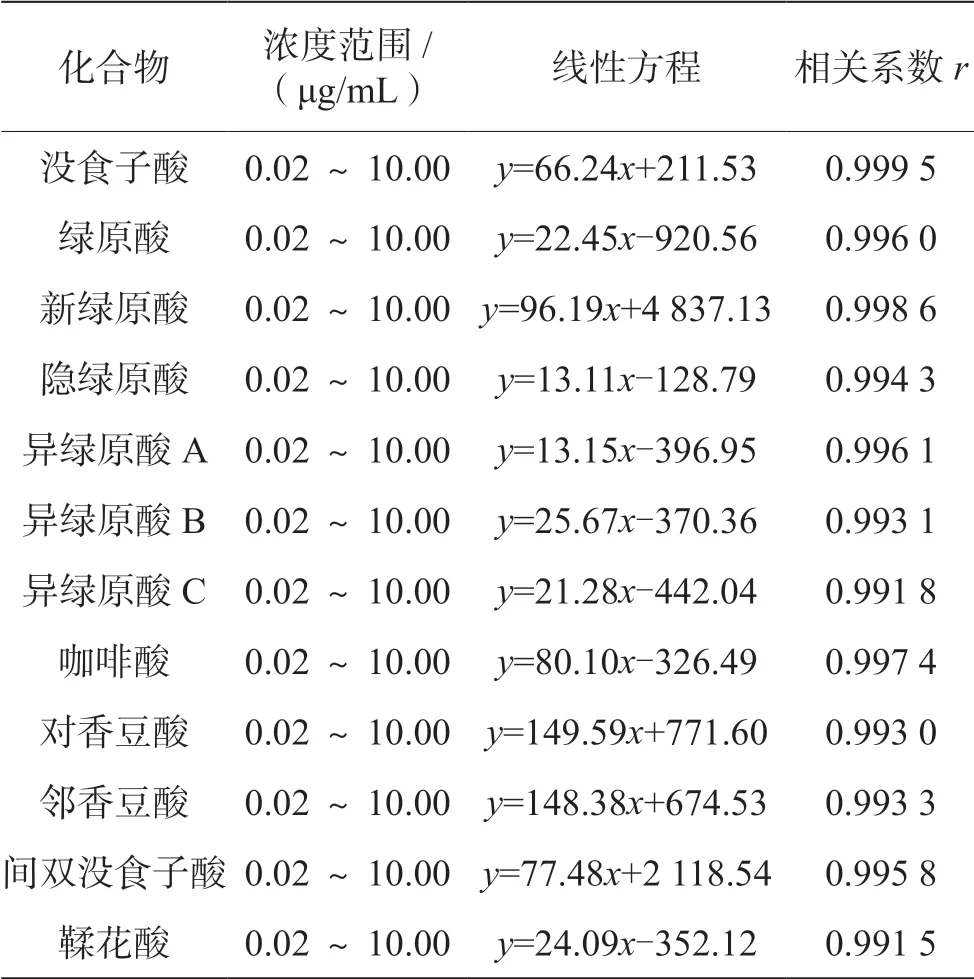
表2 标准曲线方程
2.4.2 重复性试验
称取同一茶叶样品6 份,依据建立的前处理和仪器分析方法,计算12 种酚酸含量及RSD,结果如表3 所示。RSD 在0.3%~6.4%,均小于10%,说明方法具有良好的重复性。
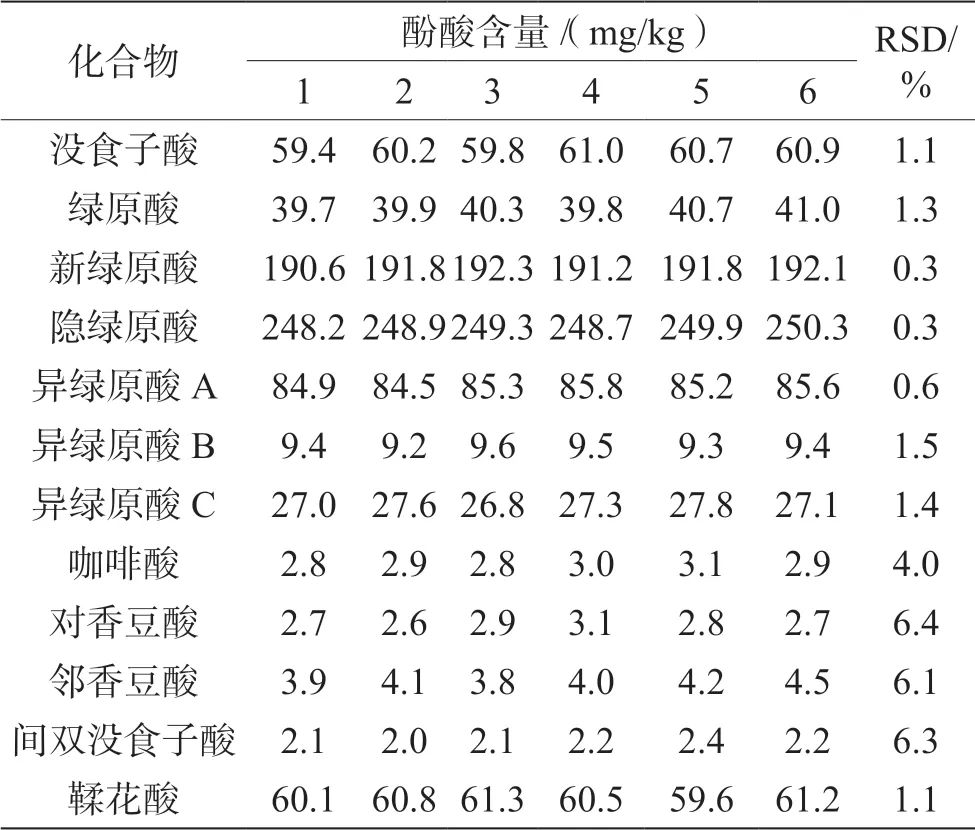
表3 重复性试验
2.4.3 稳定性试验
用同一供试品溶液分别在0 h、2 h、4 h、8 h、12 h 和24 h 时进样分析,计算各酚酸含量及RSD 值,结果见表4。RSD 在1.5%~8.4%,说明样品保存在4 ℃、24 h 内具有良好的稳定性。
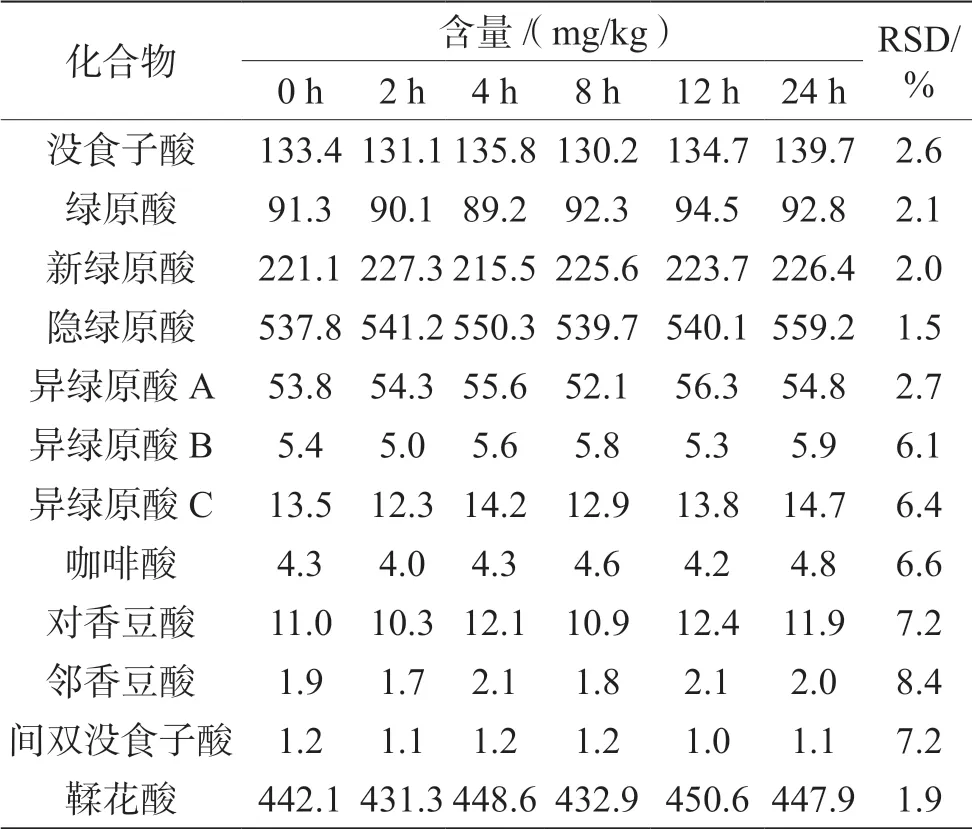
表4 稳定性试验(n=3)
2.5 Bayes 判别分析
使用12 种酚酸含量对3 个地区的绿茶进行Bayes 判别分析,结果见表5。结果表明,13 个都匀绿茶样品判别率为61.5%,24 个湄潭绿茶样品判别率为79.2%,23 个雷山绿茶样品判别率为30.4%,判别图总判别56.7%。因此,使用12 种酚酸含量对3个产地的判别效果不佳。
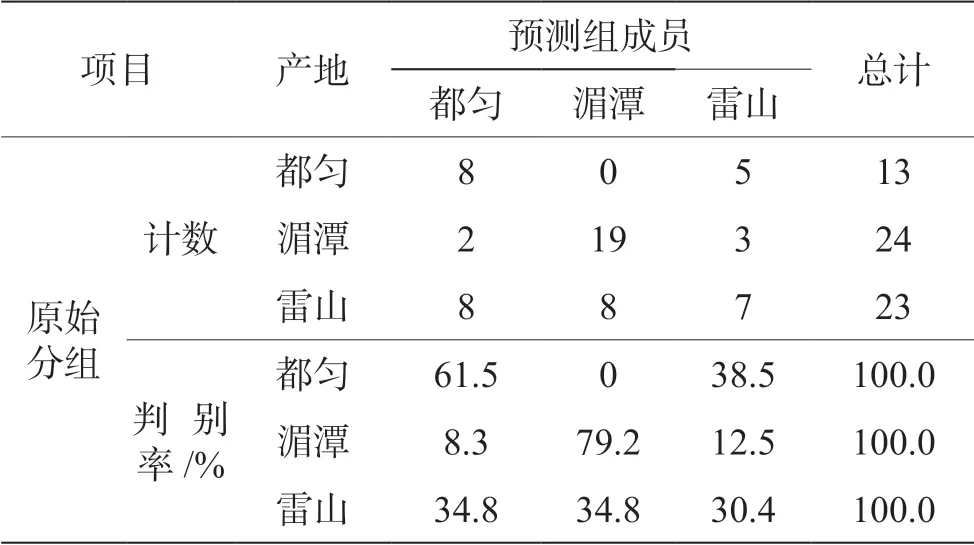
表5 茶叶分类判别结果
3 结论
采用超高效液相色谱-串联质谱仪对3 个地区绿茶中12 种酚酸化合物的含量进行测定,12 种酚酸化合物在质量浓度范围内的相关系数r>0.991,重复性和稳定性均小于10%。都匀、湄潭、雷山3 个产地的绿茶中酚酸类物质的含量存在明显差异,说明茶叶产地的不同可能会导致酚酸类物质的含量差异。使用12 种酚酸含量对不同产地的绿茶进行Bayes 判别,结果表明,3 个地区绿茶的总判别率56.7%,说明使用12 种酚酸含量能对绿茶的产地进行一定的判别,但判别效果不佳,无法完全区分。本研究为茶叶的化学分类提供了一定参考,后续研究应进一步加大样本量,根据现有成果增加更多的分析判别方法对茶叶中多种酚酸进行比较与验证,并考虑结合茶叶中儿茶素、咖啡碱等成分进行判别分析。
