miR-130a在老年骨折患者血清中的表达水平及对骨髓间充质干细胞成骨分化的调控▲
2022-08-08苏海涛
苏海涛 陈 海 湛 川
(广西玉林市第一人民医院1 急诊科,2 骨科,玉林市 537000;3 中国医科大学附属第四医院骨二科,辽宁省沈阳市 110032)
骨折是常见的骨科疾病,老年人骨折多因骨质疏松引起,老年人骨质较为脆弱,稍受外力即可发生骨折。骨折一般采用手术治疗,但术后愈合时间长,恢复过程复杂,机体需要产生大量骨细胞以加快骨质的合成和钙化[1]。成骨细胞由分化和增殖能力强、取材广泛的骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)分化而来,在骨愈合过程中可合成骨基质[2]。研究BMSC的分化特性可以更好地指导其在骨折患者中的应用[3]。研究显示,BMSC的分化在骨质形成中容易受到炎症、药物等多种因素的影响[4]。许多miRNA被证实参与了骨质形成的过程[5],其中miR-130a可以调控关节软骨细胞的增殖和分化[6],但其在骨折患者中的表达情况及相关研究较少。Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)是促进BMSC向成骨细胞分化的特异性转录调节因子,其通过调控成骨细胞特异性细胞外基质蛋白基因的表达和成骨细胞周期参与成骨细胞的分化过程,促进骨形成和抑制骨吸收[7]。而miR-130a是否在骨折患者中表达,以及是否可以通过RUNX2对BMSC的分化进行调控,还尚不清楚。本研究探讨miR-130a在老年骨折患者血清中的表达水平及其通过RUNX2对BMSC的分化调控作用,为临床治疗老年骨折患者提供研究基础。
1 资料与方法
1.1 临床资料 选取2019年4月至2020年4月在广西玉林市第一人民医院治疗的40例老年胫骨骨折患者作为观察组,男性24例、女性16例,年龄60~71(64.2±11.3)岁。所有患者均经体格检查及影像学检查确诊为胫骨骨折,并接受手术治疗,均无骨质疏松、恶性肿瘤、严重心脑血管疾病等,入院前均未服用激素类药物。选择同期40名健康体检者为对照组,排除骨质疏松、肿瘤、严重心脑血管疾病等,其中男性22例、女性18例,年龄61~73(64.5±12.4)岁。两组研究对象的性别、年龄比较,差异均无统计学意义(均P>0.05)。具有可比性。所有研究对象均签署知情同意书,本研究通过广西玉林市第一人民医院医学伦理委员会批准。
1.2 主要试剂 胎牛血清(货号:12676-029)、PBS(货号:02-024-1ACS)、TRIzol试剂盒(货号:DP501)均购自天根生化科技(北京)有限公司;IP细胞裂解液(货号:PS0009)购自江莱生物公司;二喹啉甲酸(bicinchoninic acid,BCA)试剂盒(货号:PC0020)购自北京索莱宝科技有限公司;实时荧光定量PCR试剂盒(批号:FSR22266)购自上海抚生实业有限公司。苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)裂解液(北京普利莱基因技术有限公司,批号:C1055-100);鼠抗人RUNX2单克隆抗体(货号: H00000860-M01)、鼠抗人碱性磷酸酶(alkaline phosphatase,ALP;货号:E-EL-R0057)、鼠抗人骨钙素(货号:PL03-0470R)均购自上海易汇生物科技有限公司;辣根过氧化物酶标记的山羊抗小鼠IgG(货号:JN0201-UXM)购自北京百奥莱博科技有限公司;GAPDH抗体(货号:BTN130593-JVC)购自北京百奥莱博科技有限公司;人BMSC(货号:GD-C819059)购自广州赛业生物科技有限公司;ECL试剂盒(货号:P0018S)购自上海哈灵生物科技有限公司。茜素红(货号:BTN121105)购自北京百奥莱博科技有限公司。
1.3 实验方法
1.3.1 细胞培养与转染:复苏BMSC后,将其置于DMEM完全培养基,在37 ℃、5% CO2、100%湿度培养箱中培养至3代。按3×105个/孔密度接种在96孔板,将细胞分为对照组、成骨诱导组、NC组、miR-130a增强组、miR-130a抑制剂组进行实验。对照组和成骨诱导组不做转染处理,NC组转染miRNA-NC,miR-130a增强组转染模拟高表达miR-130a的miR-130a mimics,miR-130a抑制剂组转染模拟低表达miR-130a的miR-130a inhibitor。转染质粒由南京尧顺禹生物科技有限公司构建。用150 μL减血清培养基(Opti-minimal essential medium,Opti-MEM)(赛默飞公司,批号:51985091)稀释3 μL脂质体(美国Invitrogen公司,批号:11668-027),室温放置5 min;用150 μL Opti-MEM稀释5 μL相应质粒(终浓度为100 nmoL/L);将上述两者溶液混合后室温下放置20 min,将混合液均匀滴于6孔板中,37 ℃、5% CO2条件下采用Opti-MEM培养基进行培养4~6 h后,换回正常DMEM完全培养基继续于37 ℃、5% CO2培养箱中培养,供后续实验使用。转染24 h后进行成骨诱导。
1.3.2 成骨诱导:对成骨诱导组和各转染组细胞进行成骨诱导。细胞转染后,待细胞融合度达70%~80%时,更换成骨诱导液(10 mmol/L β-甘油磷酸钠、1×10-5mmol/L地塞米松、50 μg/mL维生素C),37 ℃、5% CO2保温箱继续培养,记为第1天,后每隔1 d换液培养。
1.3.3 实时荧光定量PCR检测miR-130a和RUNX2 mRNA相对表达量:采集观察组患者术后1周、对照组研究对象健康体检时的静脉血5 mL,室温下以1 000 r/min离心10 min后收集上清液,置于-80 ℃保存待测。收集成骨诱导第7天时各组细胞,采用实时荧光定量PCR方法检测血清及BMSC的miR-130a、RUNX2 mRNA表达量。
按照TRIzol试剂盒(上海梵态生物科技有限公司,批号:FT30506yy)说明书提取血清、BMSC中的总RNA。按反转录试剂盒(北京伊塔生物科技有限公司,批号:YT9036)将RNA反转录为cDNA。按照实时荧光定量PCR试剂盒说明书进行反应体系的配制,反应体系包括SYBR Premix Ex TaqⅡ 10 μL、Primer Mix(10 μm)1.6 μL、cDNA 1.5 μL、dH2O 6.9 μL。反应条件为95 ℃预变性30 s,95 ℃ PCR反应5 s,60 ℃ 30 s,重复40次。miR-130a引物序列见表1。以U6、GAPDH为内参,采用比较CT值法对获得的数据进行相对定量分析。实验重复3次。

表1 引物序列表
1.3.4 Western blot检测RUNX2、ALP、骨钙素蛋白表达量:成骨诱导第7天时,收集各组细胞,使用PBS清洗1次,常温下800~1 000 r/min离心3~5 min后弃上清,重复2~3次。加入PMSF裂解液后在冰上裂解30 min,4 ℃ 12 000 r/min离心5 min,收集上清液在-20 ℃下保存。使用BCA试剂盒检测样本总蛋白含量,每孔加入待测蛋白40 μg进行SDS-PAGE,转膜后使用鼠抗人RUNX2(1 ∶500)、ALP(1 ∶500)、骨钙素(1 ∶500)、GAPDH1(1 ∶500)4 ℃孵育过夜,TBST洗膜 3次,每次3 min,加入辣根过氧化物酶标记的山羊抗小鼠IgG抗体(1 ∶1 000),室温摇床上轻摇孵育1 h。加入ECL试剂,显影、定影,用凝胶图像处理系统分析条带灰度值,以GAPDH为内参,计算目的蛋白相对表达量。实验重复3次。
1.3.5 ALP染色:在成骨诱导第7天时进行ALP染色。将各组细胞用冷纯丙酮在-4 ℃环境下固定24 h后,蒸馏水冲洗、沥干,加入孵育液(5 mL 3%甘油磷酸钠、1 mL 2%硫酸镁、5 mL 2%巴比妥钠、10 mL 2%氯化钙、蒸馏水10 mL)孵育3 h;取出培养瓶后用蒸馏水冲洗,加入2%硝酸钴处理2 min,加入1%硫化铵2 min处理1 min,用PBS冲洗后干燥,显微镜下观察及照片。染色后细胞核染为红棕色,ALP阳性细胞的胞浆为蓝色。
1.3.6 矿化物结节染色(茜素红染色法):在成骨诱导第21天时对各组细胞进行茜素红染色。取12孔板,每孔加PBS冲洗,加2 mL 4%中性甲醛固定30 min,每孔加1 mL 0.1%茜素红染液染3~5 min,采用10%氯化十六烷基吡啶洗脱茜素红,吸走茜素红染液后用PBS冲洗2~3次,干燥培养板,显微镜下观察红色点状矿化结节并拍照,ImageJ 1.48软件计算矿化面积比例。
1.4 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料采用(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,两两比较采用LSD-t检验;计数资料采用例数和百分比表示,比较采用χ2检验;采用Pearson检验分析观察组血清miR-130a表达量与RUNX2 mRNA表达量的相关性。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组研究对象血清miR-130a、RUNX2 mRNA表达量的比较 观察组血清miR-130a表达量低于对照组,血清RUNX2 mRNA表达量高于对照组(均P<0.05),见表2。Pearson相关性分析显示,观察组患者血清miR-130a表达量与RUNX2 mRNA表达量呈负相关(r=-0.538,P=0.020)。

表2 两组研究对象血清miR-130a、RUNX2 mRNA相对表达量的比较(x±s)
2.2 5组BMSC中miR-130a及RUNX2、ALP、骨钙素蛋白表达量的比较 成骨诱导组细胞中miR-130a表达量低于对照组,RUNX2、ALP、骨钙素蛋白表达量均高于对照组(均P<0.05)。miR-130a增强组细胞中miR-130a表达量高于成骨诱导组和NC组,RUNX2、ALP、骨钙素蛋白表达量均低于成骨诱导组和NC组(均P<0.05);miR-130a抑制组细胞中miR-130a表达量低于转染NC组和miR-130a增强组,RUNX2、ALP、骨钙素蛋白表达量均高于成骨诱导组、NC组和miR-130a增强组(均P<0.05)。见表3、图1。

表3 5组BMSC中miR-130a及RUNX2、ALP、骨钙素蛋白相对表达量的比较(x±s)
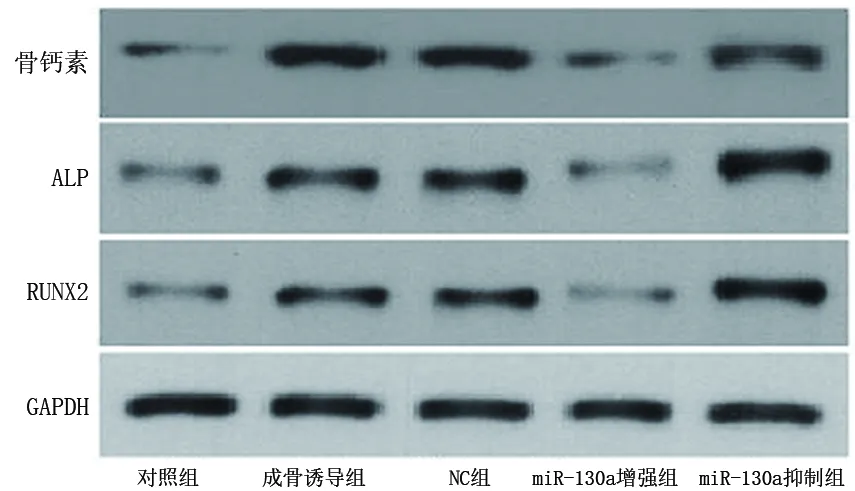
图1 蛋白条带图
2.3 BMSC分化情况 BMSC成骨诱导第7天时,经ALP染色的成骨诱导组细胞出现大量棕黑色或黑色颗粒,胞浆染色呈深蓝色,细胞已经开始成骨分化,见图2。成骨诱导第21天时,经茜素红染色的成骨诱导组细胞出现深红色点状矿化结节,形成片状矿化结节,miR-130a增强组矿化面积比例低于成骨诱导组、NC组,miR-130a抑制组矿化面积比例高于成骨诱导组、NC组和miR-130a增强组(均P<0.05),见表4、图3。

图2 成骨诱导后的BMSC(ALP染色,×200)

表4 4组BMSC细胞矿化面积比例的比较(x±s,%)

图3 茜素红染色结果(×200)
3 讨 论
BMSC是一类具有自我更新和多向分化潜能的干细胞,可以在不同诱导条件下分化为成骨细胞、软骨细胞、脂肪细胞、肌腱细胞、骨髓基质和神经胶质细胞等[8]。BMSC在成骨能力方面表现突出,其可在体内或体外诱导分化为成骨细胞,可为骨缺损的修复和成骨缺陷疾病的治疗提供支持[9]。但在老年人中,老化的BMSC成骨分化能力减弱,因此抑制BMSC老化并促进BMSC成骨分化可为提高老年骨骼质量提供重要的研究途径。
miRNA是参与各种基因调控过程的非编码小RNA,其不仅可以参与细胞的增殖、分化、凋亡等过程,还能够调节细胞的多向分化[10]。随着研究的不断深入,越来越多的证据表明miRNA与骨关节炎、骨质疏松症等多种骨疾病的发生和发展密切相关。研究表明,miRNA参与调控BMSC的成骨分化过程,但参与调控BMSC成骨分化的通路及具体作用机制尚未完全清楚[11-12]。miR-130a被证实在多种疾病中表达异常,例如,孙强等[13]研究发现,半月板损伤的患者软骨组织中miR-130a-3p表达降低,可增强软骨组织的细胞增殖。还有学者在BMSC 向软骨细胞分化的过程中检测到miR-130a表达降低[14]。本研究结果显示,观察组血清miR-130a表达量低于对照组,血清RUNX2 mRNA表达量高于对照组,体外细胞实验结果显示,成骨诱导组细胞中miR-130a表达量低于对照组(均P<0.05),这提示miR-130a参与了骨折的修复过程,可能与成骨细胞的分化过程有关。
成骨细胞分化是骨愈合的关键,成骨细胞是骨形成过程中的重要功能细胞,来源于未分化并具有多潜能的间充质干细胞。在多种因子的作用下,BMSC可分化为不同类型的细胞。RUNX2基因在成骨细胞分化和骨形成中起重要作用,适度的RUNX2表达可调控BMSC向成骨细胞分化的过程[15-16]。有研究显示,在成骨细胞分化的过程中,RUNX2呈高表达状态,而RUNX2基因的表达受到多种miRNA(包括miR-155、miR-103-3p、miR-132等)的调控[17-19]。ALP和骨钙素是成骨分化的标志基因,常用于反映成骨细胞的分化程度[20]。本研究中,成骨诱导后的BMSC的RUNX2、ALP、骨钙素蛋白表达均上调,与上述研究结论相符。上调miR-130a后,经成骨诱导的BMSC的RUNX2、ALP、骨钙素蛋白表达量较经单纯成骨诱导的细胞降低,且茜素红染色显示成骨细胞分化程度降低;而抑制miR-130a表达后,经成骨诱导的BMSC的RUNX2、ALP、骨钙素蛋白表达量升高,茜素红染色显示矿化结节明显,成骨细胞分化程度高;同时相关性分析显示观察组患者血清miR-130a表达量与RUNX2 mRNA表达量呈负相关。由此推测,miR-130a可以通过调节RUNX2的表达实现对成骨细胞分化过程的调控,其中miRNA-130a低表达可通过上调RUNX2表达水平来促进成骨细胞分化[20]。
综上所述,miR-130a在老年骨折患者血清中的表达降低,低表达水平的miR-130a可通过上调RUNX2的表达来促进BMSC的成骨分化。
