达格列净联合骨化三醇治疗糖尿病肾病患者的效果及对微炎症状态的影响▲
2022-08-08张一婷张雅琪李苏童
张一婷 张雅琪 李苏童 雷 洁
(陕西省西安市中心医院肾脏内科,西安市 710003)
近年来,全球糖尿病的患病率大幅上升,糖尿病患者人数已超过4.5亿,已成为全球的公共卫生问题[1]。糖尿病肾病是糖尿病主要的微血管并发症之一,发生率为20%~40%[2]。糖尿病肾病是导致终末期肾脏病的主要原因,而在肾脏替代治疗的患者中,糖尿病肾病的患者比例高达51%,该并发症严重影响患者的预后[3]。研究发现,微炎症状态是慢性肾脏病进展的独立危险因素[4],如何有效抑制微炎症、减缓糖尿病肾病的进展,成为目前临床上亟待解决的问题。达格列净是一种高效、可逆的选择性钠-葡萄糖共转运蛋白2抑制剂,具有降血糖、保护心脏、保护肾脏等特性,被广泛用于2型糖尿病的治疗[5]。血清25-羟维生素D3[25-hydroxyvitamin D3,25(OH)D3]可以调控炎症因子的表达,并通过影响胰岛素抵抗参与2型糖尿病的发生[6]。本研究探讨达格列净联合骨化三醇(活性维生素D3)治疗糖尿病肾病患者的临床效果,以及对患者机体微炎症状态的影响,为糖尿病肾病的治疗提供参考。
1 资料与方法
1.1 临床资料 选取2019年1月至2020年12月在西安市中心医院肾脏内科诊治的107例糖尿病肾病患者作为研究对象。纳入标准:(1)年龄>18岁;(2)符合糖尿病肾病Mogensen分期诊断标准[7];(3)自愿参与本研究并签署知情同意书。排除标准:(1)合并糖尿病急性并发症(包括糖尿病酮症酸中毒、低血糖、高渗昏迷等)的患者;(2)其他原发性及继发性肾脏疾病患者;(3)近期使用维生素D类药物治疗者;(4)治疗依从性差者;(5)近期使用损害肾功能药物、急性肾损伤、感染、心功能衰竭、妊娠或哺乳期、有精神疾病不能配合治疗者及存在器质性疾病者。按随机数字表法将患者随机分为对照组54例与观察组53例,对照组中男性31例、女性23例,年龄41~75(53.50±8.82)岁,病程4~18(8.45±3.90)年,合并高血压21例;观察组中男性31例、女性22例,年龄38~78(55.45±9.40)岁,病程3~17(7.80±2.61)年,合并高血压23例。两组患者的一般资料比较,差异均无统计学意义(均P>0.05),具有可比性。本研究经我院医学伦理委员会审批通过。
1.2 方法 两组患者均给予饮食指导、运动指导、控制血压、控制血脂及降糖治疗,降糖方案包括口服降糖药及注射胰岛素,使血糖达到目标水平(空腹血糖水平<7.0 mmol/L、餐后2 h血糖水平<11.1 mmol/L)。两组患者均给予达格列净(阿斯利康制药有限公司,批号:2101060)10 mg/d口服,观察组患者在此基础上给予骨化三醇(正大制药有限公司,批号:2003181) 0.25 μg/d口服,疗程均为3个月。
1.3 临床疗效 治疗3个月后对两组患者进行临床疗效评价。临床疗效的评价标准参照《糖尿病肾病诊断、辨证分型及疗效评定标准(试行方案)》[8]:显效为患者的症状消失,24 h尿蛋白定量较治疗前减少>50%,糖化血红蛋白(glycosylated hemoglobin,HbA1c)较治疗前降低>70%,肾功能指标恢复正常;有效为患者的症状好转,24 h尿蛋白定量较治疗前减少但不足50%,HbA1c较治疗前降低35%~70%,肾功能指标基本恢复正常;无效为未达以上标准。治疗总有效率=(显效+有效)例数/总例数×100%。
1.4 观察指标 比较两组患者治疗前及治疗3个月后的收缩压、舒张压,血清HbA1c、三酰甘油、总胆固醇、血尿酸、白蛋白、尿素氮、血肌酐水平及24 h尿蛋白定量,以及血清总25(OH)D3、超敏C-反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6水平。血压的测量方法:患者取坐位,安静状态下测量,早晚各测量1次,取平均值。治疗前及治疗3个月后采集患者空腹静脉血3~5 mL,以4 000 r/min离心10 min,获取血清,采用日立7600全自动生化分析仪及美国贝克曼AU5800全自动生化分析仪测定白蛋白(正常范围:35~55 g/L)、尿素氮(正常范围:3.6~9.5 mmol/L)、肌酐(正常范围:57~111 μmol/L)、尿酸(正常范围:208~420 μmol/L)、三酰甘油(正常范围:<1.7 mmol/L)、总胆固醇(正常范围:3~5.7 mmol/L)、hs-CRP(正常范围:<10 mg/L)水平;采用电化学发光法测定血清总25(OH)D3水平(≤20 ng/mL为缺乏,>20 ng/mL但≤29 ng/mL为不足,>29 ng/mL但≤65 ng/mL为充足,>65 ng/mL为过量);化学发光免疫分析法测定HbA1c(正常范围:4%~6%)、IL-6(正常范围:<10 pg/mL)水平;ELISA测定TNF-α(正常范围:10~15 pg/mL)及IL-1β(正常范围:<5 pg/mL)水平。收集24 h尿液,混匀后取标本采用免疫比浊法进行24 h尿蛋白定量(正常范围:<150 mg)。以上检测均由具备资质的固定人员操作,并定期对仪器进行质检。
1.5 统计学分析 使用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料采用[n(%)]表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者治疗前后观察指标的比较 治疗前,两组患者各观察指标比较,差异均无统计学意义(均P>0.05)。治疗3个月后,观察组血清总25(OH)D3、白蛋白水平均高于治疗前和对照组(均P<0.05);两组患者的收缩压、舒张压,血清HbA1c、三酰甘油、总胆固醇、尿酸、尿素氮、肌酐水平及24 h尿蛋白,以及血清hs-CRP、TNF-α、IL-1β、IL-6水平均低于治疗前,且观察组血清尿素氮、肌酐、hs-CRP、TNF-α、IL-1β、IL-6水平及24 h尿蛋白均低于对照组(均P<0.05)。见表1。

表1 两组患者治疗前后观察指标的比较(x±s)

组别n舒张压(mmHg)治疗前治疗后t值P值总胆固醇(mmol/L)治疗前治疗后t值P值对照组5484.83±6.9281.92±5.852.0410.0486.23±1.864.74±1.044.466<0.001观察组5385.33±5.3278.38±7.375.341<0.0016.18±1.694.63±1.314.634<0.001 t值0.1841.7010.1260.424P值0.8540.0970.9000.673
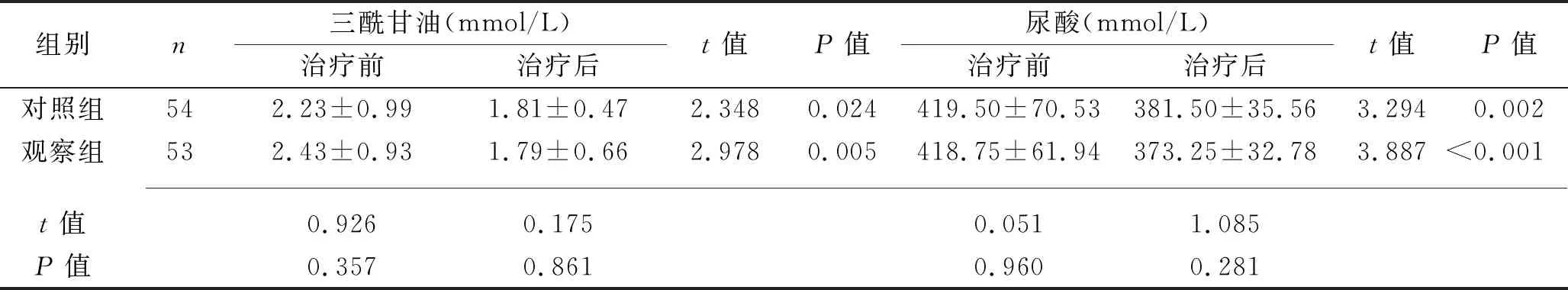
组别n三酰甘油(mmol/L)治疗前治疗后t值P值尿酸(mmol/L)治疗前治疗后t值P值对照组542.23±0.991.81±0.472.3480.024419.50±70.53381.50±35.563.2940.002观察组532.43±0.931.79±0.662.9780.005418.75±61.94373.25±32.783.887<0.001 t值0.9260.1750.0511.085P值0.3570.8610.9600.281

组别n白蛋白(mmol/L)治疗前治疗后t值P值24 h尿蛋白(g)治疗前治疗后t值P值对照组5429.13±4.8532.63±3.79-9.632<0.0012.26±0.591.95±0.402.9000.006观察组5329.60±5.1534.25±4.52-8.950<0.0012.18±0.721.48±0.564.748<0.001 t值0.425-2.0200.4764.275P值0.6720.0460.635<0.001

续表1

组别nhs-CRP(mg/L)治疗前治疗后t值P值TNF-α(pg/mL)治疗前治疗后t值P值对照组5415.98±5.3413.72±4.502.0740.04549.98±5.0143.83±4.165.733<0.001观察组5315.38±5.279.87±4.954.940<0.00149.78±4.1241.10±6.886.045<0.001 t值0.5062.8260.1952.143P值0.6140.0060.8460.035
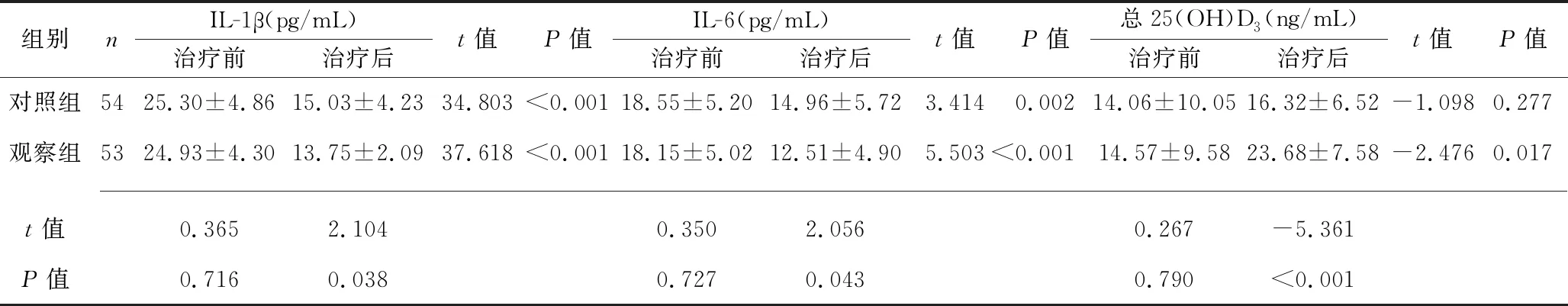
组别nIL-1β(pg/mL)治疗前治疗后t值P值IL-6(pg/mL)治疗前治疗后t值P值 总25(OH)D3(ng/mL)治疗前治疗后t值P值对照组5425.30±4.8615.03±4.2334.803<0.00118.55±5.2014.96±5.723.4140.00214.06±10.0516.32±6.52-1.0980.277观察组5324.93±4.3013.75±2.0937.618<0.00118.15±5.0212.51±4.905.503<0.00114.57±9.5823.68±7.58-2.4760.017 t值0.3652.1040.3502.0560.267-5.361P值0.7160.0380.7270.0430.790<0.001
2.2 两组患者临床疗效的比较 治疗3个月后,对照组显效4例、有效24例、无效26例,治疗总有效率为51.85%(28/54);观察组显效7例、有效31例、无效15例,治疗总有效率为71.70%(38/53)。观察组治疗总有效率高于对照组(χ2=4.457,P=0.035)。
3 讨 论
糖尿病肾病是糖尿病患者主要的微血管并发症之一,已逐渐成为慢性肾脏病的主要病因,据统计,约1/3的糖尿病肾病患者最终发展为终末期肾脏病[9]。在糖尿病肾病患者中,高血糖可诱发受损的肾小球和肾小管细胞表达炎症介质,使机体处于微炎症状态,并通过不同的机制导致肾功能损害[10]。微炎症状态是指机体有发生全身或局部急性感染的趋势,其主要表现为急性时相反应蛋白水平的变化和细胞因子的活化[11]。越来越多的流行病学和临床证据表明,炎症反应与糖尿病肾病的发生和发展存在密切的关系[12]。在糖尿病肾病中,TNF-α及其受体参与细胞因子、趋化因子、生长因子、细胞外基质蛋白的合成,影响白细胞的募集和激活,加剧了糖尿病肾病相关的炎症反应,并介导足细胞、系膜细胞、内皮细胞和上皮细胞等多种细胞的毒性作用[13]。IL-1β是先天免疫系统中最有效的分子之一,由巨噬细胞产生,可诱导肾小管间质纤维化,使糖酵解和基质产生的平衡进一步失调[14]。IL-6在炎症性病理中起关键作用,阻断IL-6受体可抑制糖尿病大鼠炎症和氧化应激[15]。 针对特定炎症介质包括细胞黏附分子、趋化因子和细胞因子,以及细胞内信号传导途径的几种抗炎策略,在糖尿病肾病实验模型中显示出有益的作用,可减少蛋白尿和减轻肾脏病理改变[16]。因此,糖尿病肾病患者的治疗除了控制血糖、血压和血脂,以及保护肾功能外,还需兼顾清除炎症因子,从而更好地控制病情进展。
钠-葡萄糖共转运蛋白2抑制剂是用于治疗2型糖尿病的一类相对较新的降糖药。达格列净是一种高效、可逆的选择性钠-葡萄糖共转运蛋白2抑制剂,可通过抑制位于近曲小管中的高容量葡萄糖转运蛋白来减少肾脏中葡萄糖的重吸收,并促进其从尿液中排出,从而降低血浆葡萄糖水平[17-18]。最近有研究表明,钠-葡萄糖共转运蛋白2抑制剂具有减轻糖尿病肾病患者机体炎症反应的作用[19]。达格列净可减少2型糖尿病小鼠肾脏的巨噬细胞浸润,并降低转化生长因子、外周血趋化因子配体2、骨桥蛋白和细胞间黏附分子-1等炎性因子的表达,可有效抑制炎症反应并改善纤维化进程[20-21]。维生素D属于类固醇激素,可促进骨骼代谢稳态,还能调节细胞的生长和分化,调节先天和适应性免疫功能,并对糖尿病和心血管疾病具有保护作用[22]。已有研究证实,糖尿病患者的维生素D水平明显低于无糖尿病者[23],维生素D水平与白蛋白尿患病率呈负相关[24]。而受到各种原因的影响,糖尿病肾病患者存在维生素D缺乏症的风险,主要原因之一是大量蛋白尿导致25(OH)D3的主要载体蛋白维生素D结合蛋白丢失[25]。研究发现,维生素D能够抑制肾素的分泌,机体在缺乏维生素D的状态下可致肾素-血管紧张素-醛固酮系统激活,进一步增加糖尿病肾小球内压,促使肾小球高滤过,加速肾小球硬化和间质纤维化[26]。另一方面,维生素D缺乏可使足细胞足突融合消失,同时使肾小球基底膜增厚,加重肾小球损伤[27]。维生素D可抑制环氧合酶-2的表达并上调15-羟前列腺素脱氢酶的表达,该酶诱导前列腺素的分解代谢,从而降低了前列腺素的水平并抑制促炎细胞因子的产生[28]。随着糖尿病肾病病情的进展,血清中25(OH)D3水平逐渐下降,补充25(OH)D3可降低炎性因子水平,从而起到保护肾脏功能的目的[29]。越来越多的研究表明,补充维生素D在白蛋白尿和肾小球硬化的消退中起着关键作用[30]。本研究结果显示,治疗3个月后,观察组血清总25(OH)D3、白蛋白水平均高于治疗前及对照组(P<0.05);两组患者的血清HbA1c、收缩压、舒张压、三酰甘油、总胆固醇、尿酸、尿素氮、肌酐水平及24 h尿蛋白,以及血清hs-CRP、TNF-α、IL-1β、IL-6水平均较治疗前下降,且观察组血清尿素氮、肌酐、hs-CRP、TNF-α、IL-1β、IL-6水平及24 h尿蛋白均低于对照组(均P<0.05),观察组治疗总有效率高于对照组(P<0.05)。这说明达格列净联合骨化三醇治疗糖尿病肾病可明显改善糖尿病肾病患者的生化指标及炎症指标。分析其原因可能为:达格列净可抑制糖尿病肾病患者巨噬细胞浸润,降低炎症因子表达并改善纤维化,骨化三醇可抑制肾素分泌,抑制肾素-血管紧张素-醛固酮系统激活,从而降低肾小球内压,减轻肾小球的高滤过;另一方面,骨化三醇可抑制环氧合酶的表达,抑制炎症因子的表达[27,30]。
综上所述,达格列净联合骨化三醇能有效治疗糖尿病肾病患者,降低尿蛋白水平,改善肾功能,延缓肾功能不全进展,并能减轻其微炎症状态,值得临床推广。
