恩他卡朋片微生物限度检查方法的建立及验证
2022-08-08赵同申秦桂霞于洪华季智飞徐伟娜
赵同申,秦桂霞,于洪华*,季智飞,徐伟娜
(1. 山东华鲁制药有限公司,山东 聊城 252100;2. 山东省药学科学院,山东 济南 250101)
恩他卡朋片是抗帕金森病药物,有效成分为恩他卡朋,辅料包括甘露醇、微晶纤维素、交联羧甲基纤维素钠、氢化蓖麻油。恩他卡朋片可作为左旋多巴/苄丝肼或左旋多巴/卡比多巴的辅助用药,用于治疗以上药物不能控制的帕金森病及剂末现象(症状波动)。
经查阅文献,未见恩他卡朋片微生物限度检验方法的研究。试验中发现恩他卡朋片有抑菌作用,因此,本文建立了稀释法消除抑菌性的微生物限度检验方法,并选用3批样品进行方法适用性试验。
1 仪器与材料
1.1 仪器
SPX-250生化培养箱(北京市永光明医疗仪器厂);DHP-600电热恒温培养箱(北京市永光明医疗仪器厂);MZ-301微生物限度仪(杭州美卓生物科技有限公司);滤膜(上海市新亚净化器件厂,直径50 mm,孔径0.45 μm);YXQ-LS-50SⅡ立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);KF-3102电子天平(浙江凯丰集团有限公司);DZKW-C恒温水浴锅(龙口市电炉制造厂)。
1.2 试验菌种
铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕,大肠埃希菌(Escherichia coli)〔CMCC(B)44 102〕,金黄色葡萄球菌(Staphylococcus aureus) 〔CMCC(B)26 003〕,枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B)63 501〕,白色念珠菌(Candida albicans)〔CMCC(F)98 001〕,黑曲霉(Aspergillus niger)〔CMCC(F)98 003〕,均购自山东省食品药品检定研究院。
1.3 培养基及试剂
胰酪大豆胨琼脂培养基(批号:210122),胰酪大豆胨液体培养基(批号:210129),沙氏葡萄糖琼脂培养基(批号:210223),麦康凯琼脂培养基(批号:190301),麦康凯液体培养基(批号:200520),pH 7.0氯化钠-蛋白胨缓冲液(批号:1901162,北京三药科技开发公司)按标签说明配制,经高压蒸汽灭菌后密封备用,培养基适用性自行完成,均符合规定。聚山梨酯80(批号:20181016,天津市科密欧化学试剂有限公司)。
1.4 样品
恩他卡朋片(山东华鲁制药有限公司,批号:200801,210301,210401)。
2 方法与结果
2.1 菌液制备
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、大肠埃希菌新鲜培养物,分别用0.9 %无菌氯化钠溶液制成适宜浓度菌悬液。取含黑曲霉的沙氏葡萄糖琼脂斜面培养基,用含0.05 %聚山梨酯80的0.9 %无菌氯化钠溶液将孢子洗脱,并稀释制成适宜浓度黑曲霉孢子悬液。
2.2 供试液制备
称取恩他卡朋片10 g,加含1 %聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液至100 ml,置45 ℃恒温水浴锅中,振荡至均匀分散,作为1:10(m:v)供试液。量取1:10供试液适量,用含1 %聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液稀释制成1:20及1:50供试液。
2.3 计数方法适用性试验
分别取1:10,1:20及1:50供试液9.9 ml,置无菌试管中,分别加入试验菌菌悬液0.1 ml(含菌量不大于1000 cfu),混匀,取1 ml混匀后的供试液注入90 mm无菌培养皿中,加入培养基,其中接种金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌、黑曲霉菌的培养皿加胰酪大豆胨琼脂培养基,另取接种白色念珠菌、黑曲霉菌的培养皿加沙氏葡萄糖琼脂培养基,混匀,凝固,将平皿倒置于相应培养箱培养,计数。
同步取pH 7.0无菌氯化钠-蛋白胨缓冲液代替供试液,作为菌液对照组;以含1 %聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液代替供试液,作为稀释剂对照;以供试液代替菌悬液,作为供试品对照。
计算稀释剂对照组回收比值,回收比值=稀释剂对照组菌落数/菌液对照组菌落数,回收比值应在0.5~2.0范围内。结果见表1。
小试最佳结果:当塔顶温度78℃,塔釜温度100℃,回流比4∶1,塔顶馏出液氨氮浓度65 000 mg/L,折合氨水浓度7.9%,塔釜液氨氮浓度<10 mg/L。小试中塔釜脱氨液浓度达到预期,但塔顶氨水作为资源化尚不够。分析原因:冷凝温度不够低,部分氨气无法冷凝,从经济性角度考虑,宜采用吸收来替代冷凝。考虑到除防垢,对塔釜液进行离心分离,塔釜液SS为1 046 mg/L,300r/min离心分离后,SS去除率约50%,800 r/min离心分离,SS去除率>75%,为中试提供依据。

表1 稀释剂对照组回收比值
结果:含1 %聚山梨酯80稀释剂对微生物无毒性。
计算试验组回收比值,回收比值=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数,回收比值应在0.5~2.0范围内。结果见表2。
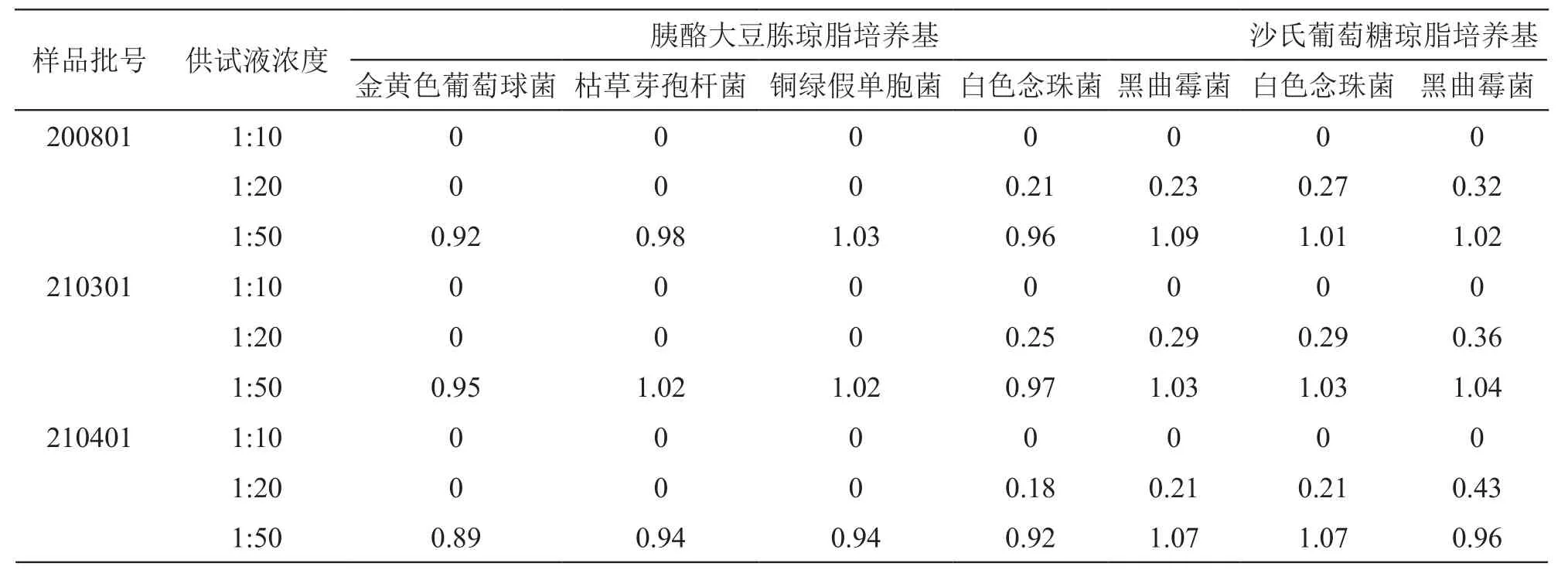
表2 试验组回收比值
结果:当供试液浓度为1:50时,试验组回收比值在0.5~2.0范围内,可确认供试液在该检验条件下无抑菌作用或抑菌作用可忽略不计。
2.4 控制菌检验方法适用性
取1:10供试液10 ml,加含试验菌大肠埃希菌的菌悬液0.1 ml(含菌量不大于100 cfu),混匀,置于100 ml胰酪大豆胨液体培养基中,混匀,33.0 ℃培养18 h,取培养物1 ml接种至100 ml麦康凯液体培养基中,43.0 ℃培养24 h,取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,33.0 ℃培养18 h。
同步设立阳性对照,阴性对照,供试品对照及稀释剂对照。
结果:阴性对照组无菌生长,试验有效。稀释剂对照组、试验组均检出试验菌,且菌落形态与阳性对照组一致,确定为大肠埃希菌形态特征。可以判定,含1 %聚山梨酯80稀释剂对大肠埃希菌无毒性,1:10供试液在该检验条件下可正常检出大肠埃希菌。
3 讨论
3.1 稀释方式的选择
3.2 稀释倍数的确定
经前期试验,本品1:10供试液对微生物有抑制作用,且不溶于水,不宜采用薄膜过滤法,结合样品特性及限度要求,遵循“就简不就繁”的原则,选用稀释法,使每个平皿中样品量降低,可有效去除药品本身的抑菌性,且该方法操作简单,重复性好[3-6]。综上,选择增加稀释法进行方法适用性试验,并设定不同稀释浓度(1:10,1:20,1:50)进行试验,比较试验结果,最终确定供试液浓度在1:50时最佳。
4 结论
本品不属于抗生素类药品,从药理作用及理化性质方面,判断不出是否具有抗菌性,在日常检测中,容易忽略其可能存在的未知的抑菌性[7]。本研究采用增加供试液稀释级别提高试验菌种的回收率[8],使微生物限度检验更准确,更科学有效,符合药典要求。本文对类似性质药品的微生物限度检验方法的建立及验证有一定参考意义。
