鞣花酸对DSS诱导的溃疡性肠炎小鼠的改善及对COX2/p38/JNK/ERK/IκB-α/NF-κB和iNOS/3-NT/CYP2E1信号通路的作用
2022-08-08姜林娟朴丙熙權英珠
郑 志 ,姜林娟,朱 瑜,朴丙熙, ,權英珠
(1. 新乡医学院 公共卫生学院,河南 新乡 453000;2. 韩陵医药研究院有限公司,江苏 南京211100;3. 莱帕坚(株)公司,韩国 首尔 04393;4. 梨花女子大学 药学院,韩国 首尔 04393)
溃疡性结肠炎(ulcerative colitis,UC)是一种急性或慢性肠道炎性疾病,其间溃疡反复发生[1]。局部长期慢性炎症的结果是肠纤维化,慢性炎症的反复刺激会使细胞外基质(extracellular matrix,ECM)过多沉积,从而导致管腔直径减小、肠道狭窄甚至会发生肠梗阻,加重患者症状[2]。UC在我国的发病率迅速升高,尤其慢性UC已成为常见的消化系统疾病[3-4]。慢性UC的病程迁延反复,需长期用药和复查,不仅给患者带来巨大的身心痛苦和沉重的经济负担,也耗费了大量的医疗资源。目前慢性UC尚无规范化治疗,发病机制至今尚未完全明确。鞣花酸是一种天然酚类,主要分布于坚果、软果中,具有抗氧化、抑制增殖、诱导凋亡、阻断病毒感染、抑制炎症等生物活性功效[5]。研究报道,含鞣花酸成分的扎冲十三味丸通过多靶点调控,发挥抗炎作用,但其组成成分较多,化学成分复杂,复方物质基础及作用机制还需进一步探究[6]。本研究采用硫酸葡聚糖钠(dextran sulfate sodium,DSS)诱导UC动物模型,探讨鞣花酸对UC的改善效果及对环氧化酶2(COX2)、蛋白激酶p38、c-Jun氨基末端激酶(JNK)、细胞外信号调节激酶(ERK)、核因子κB抑制蛋白α(IκB-α)、核因子κB(NF-κB)、诱导型一氧化氮合酶(iNOS)、3-硝基酪氨酸(3-NT)、细胞色素P450 2E1(CYP2E1)、肿瘤坏死因子α(TNF-α)、白介素1(IL-1)及一氧化氮(NO)水平的影响。
1 仪器与材料
1.1 仪器
Micro17微量离心机(美国Thermo Scientific公司);SX-300高温高压灭菌锅(日本Tomy公司);SDS-PAGE电泳仪(美国Bio-Rad公司);ECL Plus蛋白质印迹检测系统(美国Cytiva公司);HR-6型手持式组织匀浆机(上海泸析公司);CX21光学生物显微镜(日本Olympus公司);Pannoramic MIDI数字切片扫描仪(匈牙利3DHistech公司)。
1.2 材料
鞣花酸(美国Sigma-Aldrich,纯度>99 %);DSS[美国安培生物医疗器械贸易(上海)有限公司];iNOS,3-NT,CYP2E1,COX2,磷酸化JNK(p-JNK),磷酸化ERK(p-ERK),磷酸化p38(p-p38),磷酸化IκB-α(p-IκB-α),磷酸化NF-κB(p-NF-κB)抗体及其二抗,甘油醛-3-磷酸脱氢酶(GAPDH,美国圣克鲁斯生物技术公司)。PierceTMBCA蛋白定量检测试剂盒(美国赛默飞世尔科技公司);TNF-α,IL-1β,NO酶联免疫试剂盒(美国R&D Systems公司)。
1.3 动物
30只雄性8周龄BALB/c小鼠购于北京维通利华实验动物有限公司。饲养环境为温度22±2 ℃、湿度55 %±8 %,正常饮食,12 h白/暗调节(07:00~19:00)环境。
2 方法
2.1 DSS诱导炎症小鼠模型及动物分组
DSS剂量参考文献[5,7]设置,预实验后确定为60 mg/kg。小鼠进行一周适应性饲养,随机分为3组,每组10只,分别为:正常组,自由饮水+经口灌胃生理盐水;模型组,自由饮用5 % DSS溶液+经口灌胃生理盐水溶液;给药组,自由饮用5 %DSS溶液+经口灌胃鞣花酸溶液(7 g/L)。连续7 d。所有动物实验均在新乡医学院伦理委员会的伦理审查和监督下完成。
2.2 生物组织样本的采集
实验结束后,所有动物用CO2处死,心脏采血,12 000 r/min离心10 min,吸取上层血清,-70 ℃保存。从底部切除肠组织5 cm,肉眼观察其损伤程度,并称重。剪出离肛门1 cm的肠组织,用PBS(pH 7.4)缓冲溶液洗3次,称重。取5 mg组织,添加含0.5 %十六烷基三甲基溴化铵的50 mmol/L PBS(pH 6.0),用手持式组织匀浆机匀浆3次,每30 s一次;-70 ℃冷冻3 h,37 ℃条件下解冻,其过程反复3次。组织匀浆液在12 000g条件下离心15 min,取上层液, -70 ℃保存。其他肠组织和肝组织用4 ℃预冷生理盐水冲洗3遍,放入10 %中性福尔马林溶液中,用于组织病理学分析。
2.3 小鼠结肠和肝组织病理学分析
采用传统苏木素-伊红染色法(hematoxylineosin staining,HE)进行。将固定好的胃和结肠组织水洗,依次经不同浓度乙醇溶液和无水乙醇脱水,用二甲苯和石蜡混合液包埋,切片,厚度为5 μm,烘干,HE染色,封片,用Pannoramic MIDI数字切片扫描仪对各组织切片进行扫描拍照,观察上皮细胞的损伤及炎症浸润等。
2.4 血液中炎症因子水平测定
采用酶联免疫试剂盒测定小鼠血清中TNF-α、IL-1β和NO水平。
2.5 Western blot检测
用PierceTMBCA蛋白定量检测试剂盒检测各结肠匀浆液中蛋白质浓度。取匀浆液(蛋白质含量50 μg)进行SDS-PAGE电泳,蛋白转印至聚偏二氟乙烯(PVDF)膜后,于5 %脱脂奶粉中封闭,再分别经iNOS、3-NT、CYP2E1、COX2、p-JNK、p-ERK、p-p38、p-IκB-α及p-NF-κB抗体标记,室温下孵育过夜,三羟甲基氨基甲烷盐酸缓冲液(TBST)洗3次,二抗孵育2 h,再用TBST洗3次,最后用高效化学发光液(ECL)显色,利用ECL Plus蛋白质印迹检测系统拍照记录并分析。以上操作重复3次。
2.6 统计分析
数据均以平均值±标准差表示,通过SPSS16.0处理分析数据,组间样本比较采用t检验,P<0.05被认为差异有统计学意义。
3 结果
3.1 鞣花酸对UC小鼠结肠和肝脏的影响
鞣花酸对UC小鼠结肠和肝脏的影响见图1。由图1可见,DSS诱导的UC小鼠结肠明显缩短变窄,均有萎缩、充血、溃疡和坏死等表现,结肠的长度为4.2±0.8 cm,结肠重量为0.4±0.1 g,肝脏重量为0.6±0.2 g,与正常组小鼠(结肠长度为7.5±1.0 cm,结肠重量为0.8±0.1g,肝脏重量为1.7±0.3 g)相比,显著降低(P<0.05),表明5 %DSS诱导的UC小鼠模型成功建立。给药组小鼠结肠表面光泽、完整,未出现萎缩、充血、溃疡、坏死等,结肠无明显缩短、变窄。结果还显示,给药组小鼠与模型组小鼠相比,结肠的长度(5.9±0.7 cm)、重量(0.6±0.1 g)显著恢复(P<0.05),差异具有统计学意义。此外,给药组小鼠的肝脏重量为1.2±0.2 g,与模型组小鼠相比,差异具有统计学意义(P<0.05),说明鞣花酸具有改善急性UC的作用。
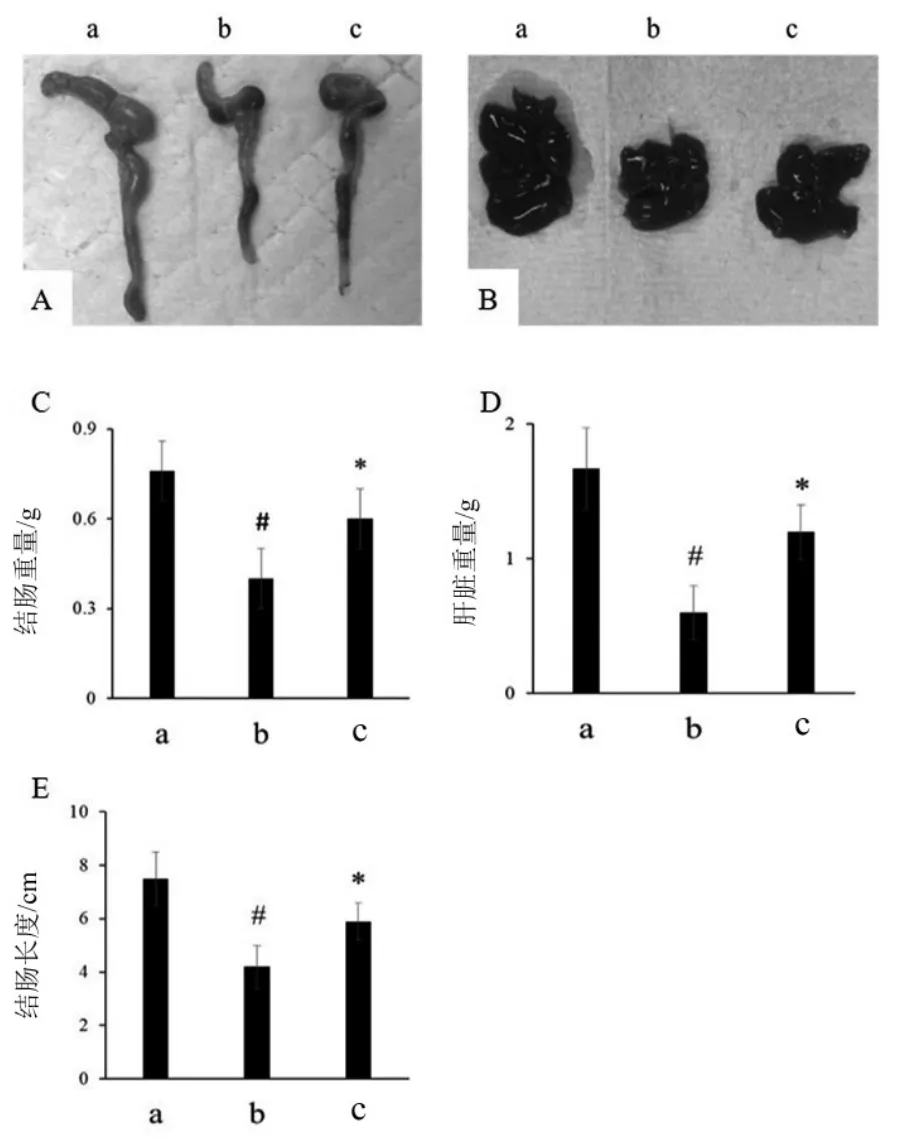
图1 鞣花酸对溃疡结肠炎小鼠结肠和肝脏的影响(n=10)
3.2 小鼠结肠和肝组织病理学分析结果
病理分析结果见图2、图3。由图2可见,模型组小鼠结肠组织中发现大量炎细胞浸润,隐窝消失、环状细胞减少,黏膜下层出现水肿。给药组小鼠的结肠上皮细胞完整,隐窝、环状细胞损伤、水肿程度较轻。由图3可见,模型组小鼠肝细胞出现大量细胞核破坏和损伤(图3B箭头所示),但给药组小鼠肝脏未发现明显损伤(图3C箭头所示),说明鞣花酸能减轻肠和肝脏组织的炎症程度和组织学损伤。

图2 小鼠结肠组织病理学分析结果(HE染色×200)

图3 小鼠肝脏组织病理学分析结果(HE染色×200)
3.3 血清炎症因子水平
血清炎症因子测定结果见图4。血清中TNF-α,IL-1β,NO高水平表达是急性炎症的典型特征。模型组小鼠血清中TNF-α水平为415±22 ng/L,IL-1β水平为720±30 ng/L,NO水平为 635±20 mol/L,与正常组(TNF-α水平为390±26 ng/L,IL-1β水平为570±50 ng/L,NO水平为550±12 mol/L)相比,均显著增高(P<0.05)。给药组小鼠的TNF-α水平为370±10 ng/L,IL-1β水平为420±30 ng/L,NO水平为530±20 mol/L,与模型组小鼠比较,显著降低(P<0.05),说明鞣花酸能抑制血清中炎症因子的表达,这与组织病理学分析结果一致。

图4 血液中炎症因子(TNF-α,IL-1β,NO)表达水平测定结果(n=10)
3.4 抗氧化因子Western blot检测结果
抗氧因子能通过抑制自由基的产生,清除、熄灭活性氧自由基,从而减少基因或蛋白质的氧化损伤。小鼠血清中抗氧化因子(iNOS、3-NT、CYP2E1)的Western blot检测结果见图5。模型组小鼠血清中iNOS(100±4.1)、3-NT(100±6.0)、CYP2E1(10 240±10.0)的表达水平,与正常组(iNOS为25±5.0、3-NT为40±4.1、CYP2E1为23±3.2)相比明显增高(P<0.01)。给药组小鼠的iNOS(54±4.2)、3-NT(70±4.0)、CYP2E1(53±3.1)的表达水平,与模型组小鼠相比明显被抑制(P<0.05),说明鞣花酸能抑制抗氧化因子,这与血清中炎症因子分析结果一致。

图5 抗氧化因子(iNOS,3-NT,CYP2E1)Western blot检测结果(n=10)
3.5 抗炎症因子Western blot检测结果
COX2及MAPK信号通路磷酸化激活后转录因子(p-ERK,p-p38,p-IκB-α,p-NF-κB)是主要抗炎症因子,小鼠血清中抗炎症因子的Western blot检测结果见图6。DSS诱导的小鼠血清中COX2(100±5.0)、p-JNK(100±6.1)、p-ERK(100±8.2)、 p-p38(100±4.0)、p-IκB-α(100±3.9)、p-NF-κB(100±8.2)的表达水平与正常组(COX2为41±4.1、p-JNK为44±3.9、p-ERK为62±6.0、p-p38为70±8.1、p-IκB-α为56±5.9、p-NF-κB为25±10.0)相比,均显著增高(P<0.05)。鞣花酸处理的试验组小鼠的抗炎症因子表达水平(COX2为46±6.0、p-JNK为62±6.0、p-ERK为75±2.1、p-p38为82±5.9、p-IκB-α为63±4.1、p-NF-κB为40±3.0)与模型组小鼠比较,均显著被抑制(P<0.05),说明鞣花酸能抑制抗氧化因子,这与血清中炎症因子和抗氧化因子水平分析的结果一致。

图6 抗炎症因子Western blot检测结果(n=10)
4 讨论
本研究选取天然酚类──鞣花酸,探讨其对5 %DSS诱导的UC小鼠的影响,发现鞣花酸对UC小鼠的结肠和肝脏组织具有改善作用,能缓解炎症程度和组织学损伤,其作用与MAPK/IκB-α/NF-κB/COX2炎症信号通路与CYP2E1/iNOS/3-NT氧化应激通路有关。
4.1 鞣花酸抑制MAPK/IκB-α/NF-κB/COX2炎症信号通路
MAPK信号通路的主要枢纽包括p-38、JNK、ERK等,通过调节关键枢纽, 介导细胞炎症反应、细胞增殖、凋亡等[7]。其中,磷酸化激活后的JNK(p-JNK)是各种应激原作用中信号传导的关键因子;磷酸化激活后的ERK(p-ERK)是多种炎症反应中的必须因子;磷酸化激活后的p-38(p-p-38)参与细胞炎症和凋亡。故转录因子p-JNK、p-ERK、p-p-38是治疗UC的重要的药物靶点[8]。有研究报道,MAPK下游的核转录因子NF-κB调控多种促炎因子的表达,并参于炎症性肠病[8],而NF-κB的抑制蛋白IκB是此通路的中间环节。NF-κB和IκB参与急性/慢性炎症、组织纤维化、细胞凋亡等病理生理过程,还能调控促炎因子TNF-α、IL-1β、IL-6、IL-8等的转录水平[9]。其中,TNF-α是炎症反应相关重要启动细胞因子,在UC发生时其高表达可加重炎症反应,诱导病理性损伤的增大。IL-1β是由巨噬细胞和单核细胞分泌,介导机体炎症调控与免疫应答,其高表达与UC炎症的发生也有密切关系[10]。Yu等[11]报道有效抑制NF-kB和MAPK信号通路,便会减少促炎细胞因子的产生。本研究的结果显示鞣花酸显著降低模型小鼠血清TNF-α、IL-1β释放(P<0.05),认为这可能与MAPK/IκB-α/NF-κB通路的抑制有关。
此外,NF-κB能下游调控COX2的转录,导致COX2表达增多,从而促进多种炎性递质产生,扩大和持续炎症发生[12]。本研究发现,模型组动物结肠组织中COX2、IκB-α、NF-κB、p-JNK、p-ERK、p-p38蛋白表达显著高于正常组(P< 0.05),说明该炎症细胞因子群的高表达与DSS诱导的UC发生发展密切相关。上述细胞因子属于炎症信号通路的关键因子,因此,鞣花酸可能是基于MAPK/IκB-α/NF-κB/COX2炎症通道发挥抗炎作用,从而显著减少促炎细胞因子TNF-α、IL-1β的释放。
4.2 鞣花酸抑制CYP2E1/iNOS/NO/3-NT氧化通路
疾病条件下,氧化应激的增加可增加炎性细胞因子释放,而炎性细胞因子的增加可刺激自由基的产生,从而诱导氧化应激。有研究表明,CYP2E1在脂肪酸氧化过程中产生过量的ROS[13], 诱导iNOS的生成,进而调节血红素氧合酶1(HO-1)表达[14]。而超氧化物存在下形成的NO高表达,通过与蛋白质上的酪氨酸残基反应形成3-NT,导致包括非酒精性脂肪性肝病或阻塞性肺病等高氧性组织损伤。UC患者发炎黏膜中的管腔隐窝细胞、中性粒细胞和单核细胞中的 3-NT 表达也增加[15]。本研究结果发现,模型组动物血液和结肠组织中CYP2E1、iNOS、NO、3-NT的表达显著均高于正常组(P<0.05),说明CYP2E1/iNOS/NO/3-NT通路与DSS诱导的UC发生密切相关。鞣花酸对UC小鼠模型结肠组织中过量表达的CYP2E1、iNOS、NO、3-NT均有下调作用(P<0.05), 表明鞣花酸改善UC可能是基于对CYP2E1/iNOS/3-NT抗氧化应激通路的抑制。本研究的病理组织形态学结果表明,鞣花酸显著改善了DSS诱导的UC小鼠的肠和肝脏组织的炎症程度和组织学损伤。
综上,本研究发现鞣花酸抑制MAPK/IκB-α/NF-κB/COX及CYP2E1/iNOS/3-NT通路,从而显著减少TNF-α、IL-1β、NO释放,进而产生改善UC的作用。但抗氧抗炎涉及信号通路较多,本研究还有待于更深入探索。
