一种7β-羟基类固醇脱氢酶的酶学性质研究及在熊去氧胆酸生物合成中的应用
2022-08-08刘英梅郭新艳张秀华王丽丽张晓元张艳艳袁丹丹
刘英梅,郭新艳,张秀华,王丽丽,刘 飞,张晓元,陈 勉,张艳艳,袁丹丹
(山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室 多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101)
熊去氧胆酸(UDCA),化学名称3α, 7β-二羟基-5β-胆甾烷-24-酸,是名贵中药材熊胆粉的主要活性成分之一,临床用于治疗胆结石和原发性胆汁性肝硬化(PBC)等肝脏类疾病。UDCA可提高胆汁中胆固醇的溶解度,降低胆固醇的析出,从而减少胆结石的形成,具有保肝利胆的功效。同时UDCA也是第一个经美国FDA批准用于治疗PBC的一线药物,在食品和药品领域有广泛的应用[1-6]。UDCA在自然界的获得途径主要是活熊取胆或引流取胆汁。2017年新修订《野生动物保护法》后,国家加强了对野生动物药物资源的管理,使得熊胆粉的资源愈加紧缺,亟需开发人工合成UDCA[7-8]。
UDCA的合成方法主要有化学合成和生物合成两种方法。化学合成法通常是以牛、羊、猪胆酸及鹅去氧胆酸等为原料经多步化学反应合成,反应条件剧烈,成本高,安全性能差,且可能有有毒化学试剂残留。随着分子生物学及酶工程的快速发展,运用生物合成转化得到UDCA成为一种既经济又绿色的手段[7]。7β-羟基类固醇脱氢酶(7β-HSDH)是UDCA酶法生物合成过程中发挥关键作用的酶[9-11],可用于化学药物中间体7-羰基石胆酸(7K-LCA)向UDCA的转化,见图1。本研究通过对基因工程菌进行发酵、表达、分离、纯化,得到高纯度、高活性的7β-HSDH蛋白,深入研究其酶学性质,确定酶促反应的最适条件,为UDCA的工业化生产提供支持。
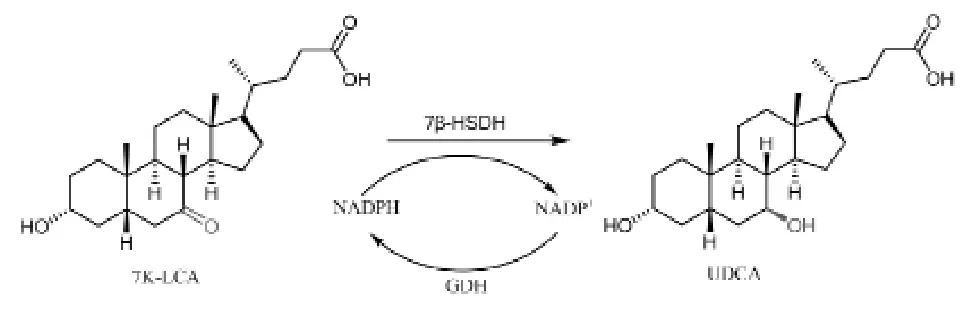
图1 UDCA的酶转化途径
1 仪器与材料
1.1 仪器
Sorvall lynx 6000台式离心机(美国Thermo Scientific);U-T6分光光度计(屹谱仪器制造);BASIC 1645050电泳仪(美国Bio-Rad);S210K pH计[梅特勒托利多仪器(上海)];AKTA蛋白纯化层析系统(美国GE)。
1.2 试剂
蛋白预分子量标记(美国Thermo Scientific);7K-LCA(浙江华纳);还原辅酶II四钠盐(NADPH,上海源叶);葡萄糖脱氢酶(GDH,上海源叶);镍离子金属螯合亲和层析介质(Ni-NTA,常州天地人和);异丙基-β-D-硫代半乳糖苷(IPTG,索莱宝);Bradford蛋白浓度测定试剂盒(Solarbio);薄层层析硅胶板(德国Merck)。
1.3 质粒
7β-HSDH基因序列来源于Collinsella aerofaciens,由济南博尚生物技术有限公司优化并合成得到pET-28a-7β-HSDH质粒。
1.4 培养基
种子培养基:普通LB培养基;发酵培养基:甘油10 g/L,蛋白胨18 g/L,酵母粉20 g/L,三水合磷酸氢二钾16.43 g/L,磷酸二氢钾2.31 g/L,氯化镁0.48 g/L,调pH至7.0。
2 方法
2.1 pET-28a-7β-HSDH E. coli BL21(DE3)重组菌株的构建
利用传统热激法(42 ℃水浴90 s)将pET-28a-7β-HSDH质粒转化到E.coliBL21(DE3)感受态细胞,得到pET-28a-7β-HSDHE.coliBL21(DE3)重组菌株。
2.2 pET-28a-7β-HSDH E. coli BL21(DE3)重组菌株的发酵表达
将重组菌株接种于LB液体培养基,37 ℃振荡培养过夜,按4 %接种量接种至含250 ml发酵培养基的摇瓶中,37 ℃下培养至OD600为0.4~0.6,加入终浓度为0.2 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导,并降温至16 ℃,继续培养过夜。8000 r/min离心10 min,收集菌体,用pH 7.4磷酸盐缓冲液(10 mmol/L)洗涤菌体1次。用100 ml Ni柱结合缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L 咪唑,pH 8.0)重悬,超声破碎菌体,12 000 r/min离心10 min,得到上清样品80 ml。
2.3 7β-HSDH重组蛋白的分离、纯化
重组菌株质粒pET-28a中含组氨酸标签(His-Tag),可敖合镍亲和柱(Ni柱)中的镍离子,故使用Ni柱层析纯化重组蛋白。通过AKTA蛋白纯化层析系统,先用Ni柱结合缓冲液冲洗Ni柱至UV值不再变化,上样2.2项下样品;再用Ni柱结合缓冲液和洗涤缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L咪唑,pH 8.0)分别冲洗Ni柱,将杂蛋白和结合不牢的目的蛋白洗涤干净;最后用洗脱缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,250 mmol/L咪唑,pH 8.0)冲洗Ni柱,收集目的蛋白,置入截留分子量3 kD的透析袋,于pH 7.4磷酸盐缓冲液(10 mmol/L)中透析,去除残余咪唑,每隔4~6 h更换一次透析液,共透析48 h。置入截留分子量3 kD的浓缩管,4000 r/min离心浓缩蛋白,直至将目的蛋白浓缩至11 ml,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测目的蛋白表达情况。
2.4 7β-HSDH重组蛋白的酶活测定
按参考文献[7]中方法操作。酶活单位定义:相应条件下,每分钟转化 1 μmol NADPH底物所需的酶量定义为一个酶活单位U。酶的比活为每毫克酶蛋白含有的活性单位数,单位为U/mg。
2.4.1 蛋白含量测定 使用Bradford蛋白浓度测定试剂盒测定蛋白质浓度。先将蛋白质标准品稀释至终浓度为0.2 mg/ml,按0,2,4,6,8,12,16,20 μl分别加至96孔板中(标准曲线孔),加1×PBS稀释液补足至20 μl。再将样品适当稀释,加至96孔板中,每孔20 μl。每孔加1×G250染色液200 μl,室温放置3~5 min。使用酶标仪测定595 nm处吸光度值。根据蛋白质标准品标准曲线计算出样品蛋白质浓度。
2.4.2 NADPH标准曲线的制备 用去离子水配制不同梯度浓度(0.1,0.2,0.3,0.4 mmol/L)的NADPH水溶液,以去离子水为空白,在340 nm处测吸光度,以NADPH 浓度为横坐标,以OD340为纵坐标,进行线性回归,得到NADPH标准曲线的线性方程。
2.4.3 7β-HSDH重组蛋白酶活检测 向2 ml的比色皿中加入50 mmol/L Tris-HCl 缓冲液(pH 8.0)1.935 ml,50 mmol/L NADPH(终浓度 0.5 mmol/L)20 μl,7β-HSDH 5 μl,混匀,在340 nm处调零,加入25 mmol/L 7K-LCA(终浓度 0.5 mmol/L)40 μl,充分混合,记录反应 30 s 后340 nm处吸光度值的变化,根据NADPH的标准曲线计算30 s NADPH的变化。根据酶活单位的定义,计算7β-HSDH重组蛋白的酶活。
2.5 7β-HSDH重组蛋白的酶学性质测定
2.5.1 pH对7β-HSDH重组蛋白酶活的影响 分别配制不同pH梯度缓冲液:pH 5.0~8.0磷酸钠缓冲液(50 mmol/L),pH 8.0~9.0的Tris-HCl缓冲液(50 mmol/L)以及pH 9.0~11.0的甘氨酸(Gly)-NaOH缓冲液(50 mmol/L),每个梯度间隔0.5 pH值[12]。 测定7β-HSDH重组蛋白在pH 5.0~11.0的缓冲液中的酶活,确定7β-HSDH的最佳pH。
2.5.2 金属离子对7β-HSDH重组蛋白酶活的影响取适量NaCl,KCl,CuCl2,MgCl2,MnSO4,分别溶于50 mmol/L Tris-Hcl缓冲液(pH 5.5),配制成0,0.5,2.5,25,50,100,250,500 mmo/L金属离子溶液[12]。测定7β-HSDH重组蛋白在含不同浓度金属离子缓冲液中的酶活,确定金属离子对7β-HSDH重组蛋白酶活的影响。
2.5.3 温度对7β-HSDH重组蛋白酶活的影响 在底物7K-LCA和NADPH过量的条件下,测定7β-HSDH在不同温度下的底物转化率。向5 ml离心管中加入 50 mmol/L Tris-HCl 缓冲液(pH 5.5)1.6975 ml,50 mmol/L NADPH 100 μl,7β-HSDH 2.5 μl,25 mmol/L 7K-LCA 200 μl,充分混合,分别置于22,27,32,37,42,47 ℃水浴锅反应5 min。加浓盐酸100 μl,再加乙酸乙酯1 ml提取后,薄层色谱(TLC)检测产物转化率。
2.5.4 7β-HSDH重组蛋白在不同温度下的热稳定性将50 mmol/L磷酸缓冲液(pH 5.5)分别置于不同温度梯度下(17,22,27,32,37,42,47,52,57,62,67,72,77 ℃)放置30 min,测定酶在不同温度缓冲液中的瞬时酶活;将酶加入除底物外的酶活反应体系中,分别于不同温度梯度下(17,22,27,32,37,42,47 ℃)放置30 min,测定残余酶活。
2.6 UDCA的酶催化合成产率测定
向5 ml离心管中分别加入50 mmol/L Tris-HCl缓冲液(pH 8.0)2070 μl, 50 mmol/L NADPH 20 μl,20 mmol/L葡萄糖 72 μl,103.41 U/ml GDH 194 μl,14 U/mg 7β-HSDH 10 μl,25 mmol/L 7K-LCA 40 μl,充分混合,37 ℃反应5~10 h,加浓盐酸150 μl,再加乙酸乙酯1 ml提取后浓缩,TLC检测产物转化率。
3 结果
3.1 pET-28a-7β-HSDH E. coli BL21(DE3)重组菌株构建、发酵、表达及蛋白分离纯化
通过对pET-28a-7β-HSDHE.coliBL21(DE3)重组菌株质粒进行测序验证,7β-HSDH酶基因序列正确无误。发酵菌体破碎后上清经Ni柱亲和层析分离纯化图谱见图2,SDS-PAGE检测结果见图3,去咪唑纯化后最终酶蛋白液电泳检测结果见图4。
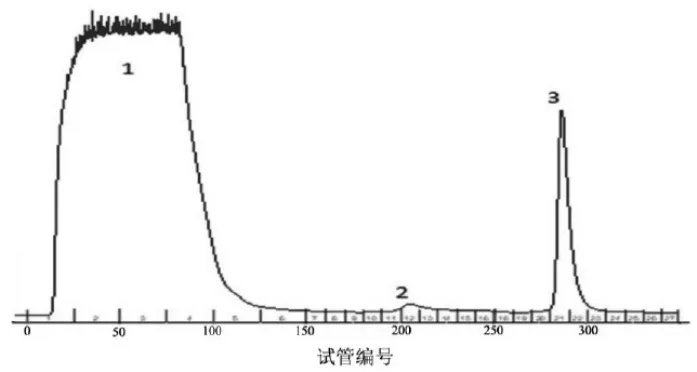
图2 7β-HSDH蛋白经Ni柱亲和层析分离纯化图谱
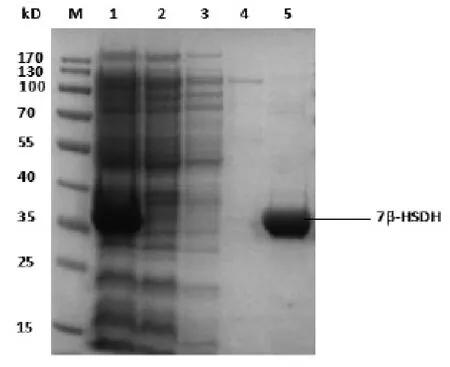
图3 7β-HSDH蛋白亲和层析洗脱液SDS-PAGE电泳图
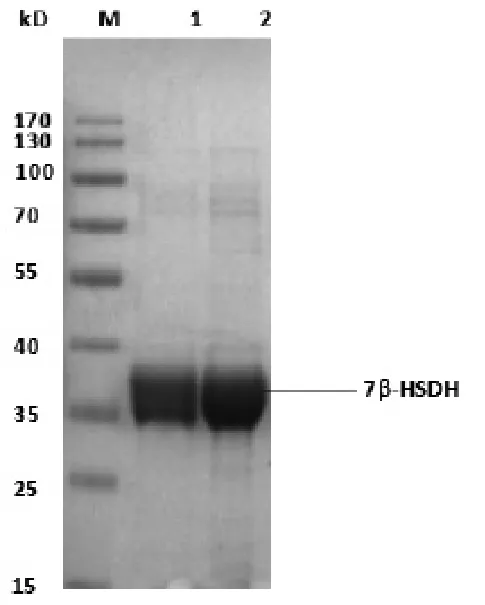
图4 7β-HSDH蛋白透析前后SDS-PAGE电泳图
由图2可见,除峰1穿透峰外,主要有2个紫外吸收峰,分别为峰2、峰3,从出峰位置和峰面积大概判断前面的峰2可能是杂蛋白和结合不牢的目的蛋白,峰3为重组7β-HSDH目的蛋白。
对洗脱的蛋白样品进行SDS-PAGE电泳检测,结果见图3。条带5为图2中第3个峰的收集液检测条带,条带中几乎全部为目的蛋白,杂蛋白较少。经进一步透析浓缩后用于酶学性质研究。
透析前后酶蛋白电泳图见图4。由图4可见,使用透析法去咪唑,透析前后酶蛋白几乎无损失,且最终去咪唑后的酶蛋白样品几乎无杂带。
以上结果表明,重组菌发酵后,发酵菌体破壁上清经分离、纯化,可得到高纯度的酶蛋白。
3.2 7β-HSDH重组蛋白的酶活测定结果
按2.4.1项下方法测得酶蛋白浓度为3.5 mg/ml。按2.4.2项下方法得到NADPH标准曲线线性方程为:y=2.5895x-0.0519,R2=0.9984。按2.4.3项下方法,用7β-HSDH酶蛋白液5 μl转化NADPH,测得30 s内,OD340的变化值为:Δy=0.32,代入标准曲线方程,并根据酶活单位的定义可知,7β-HSDH酶蛋白样品的酶活为49.89 U/ml,比活为14 U/mg。
3.3 7β-HSDH重组蛋白的酶学性质测定
3.3.1 pH对7β-HSDH重组蛋白酶活的影响 结果见图5。由图5可见,pH 5.5缓冲液体系中,酶活最高,酶的比活为53 U/mg,是p8.0条件下(14 U/mg)的3.7倍左右。
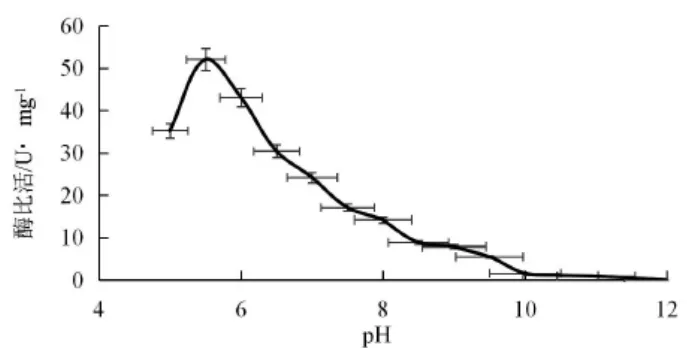
图5 不同pH对7β-HSDH蛋白酶活的影响
3.3.2 金属离子对7β-HSDH重组蛋白酶活的影响结果见图6。由图6可见,除Cu2+外,其他几种离子对酶活均有不同程度的促进作用,Cu2+有显著的抑制作用。其中Mg2+对酶活的促进作用最为显著,在添加100 mmol/L MgCl2的缓冲液中7β-HSDH重组蛋白酶的比活最高,为83 U/mg,与未添加金属离子的对照53 U/mg相比,酶活提高约57 %。
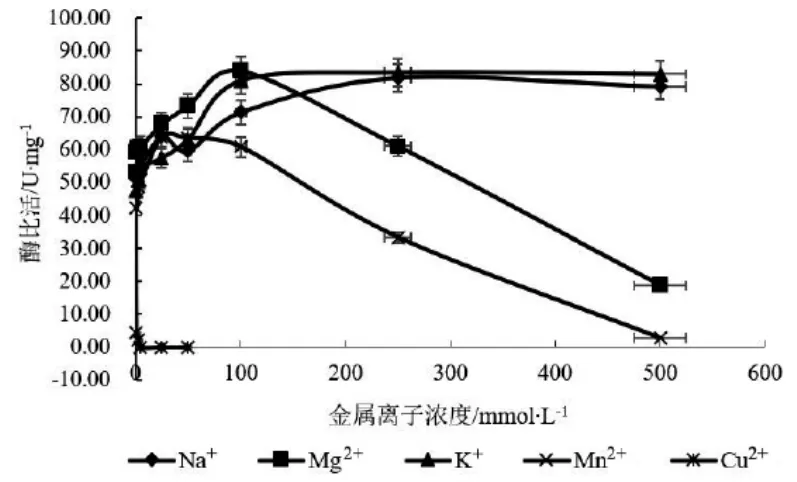
图6 不同浓度金属离子对7β-HSDH蛋白酶活的影响
3.3.3 温度对7β-HSDH重组蛋白酶活的影响 在底物过量的反应体系中,加入7β-HSDH重组蛋白,进行转化反应,不同温度下反应5 min,测定UDCA产物的生成量。结果见图7。在32~42 ℃的条件下反应5 min,UDCA生成量最多,该温度范围为7β-HSDH酶酶反应的最适温度范围。

图7 温度对7K-LCA转化率影响的TLC检测结果
3.3.4 7 β-HSDH重组蛋白酶在不同温度下的热稳定性 结果见图8、图9。由图8可见,温度62 ℃的缓冲液中,7β-HSDH酶的瞬时酶活最高,比活为88 U/mg,是17 ℃(25 U/mg)缓冲条件下酶活的3.5倍。此结果可为后续放大生产过程中缩短反应时间,进而降低生产成本提供有效的理论依据。
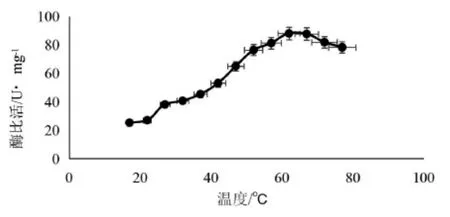
图8 不同温度缓冲液对7β-HSDH蛋白酶活的影响
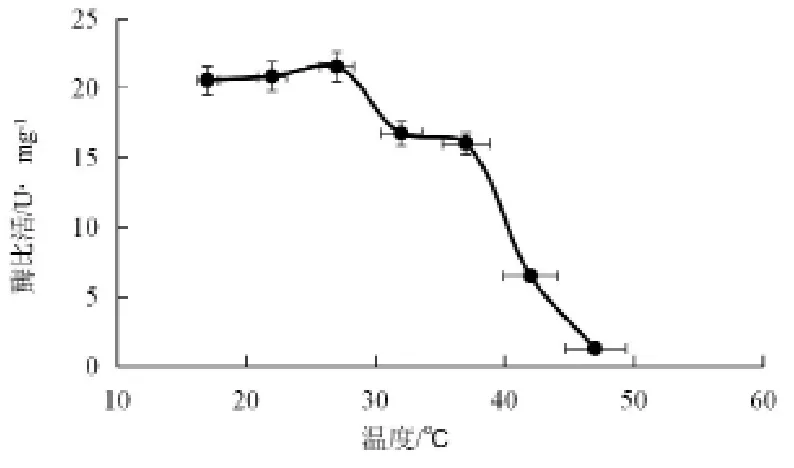
图9 7β-HSDH重组蛋白酶在不同温度下放置30 min后酶活变化
由图9可见,7β-HSDH酶在17~27 ℃下放置30 min,7β-HSDH的酶活几乎无损失;37 ℃下放置30 min,7β-HSDH的酶活损失约25 %;42 ℃下放置30 min,7β-HSDH的酶活损失约75 %,47 ℃下放置30 min,酶活几乎降为0。
3.4 UDCA的酶催化合成产率测定结果
产物转化率TLC检测结果见图10。由图10可见,条带3中反应后产物几乎全部为UDCA,底物剩余量较少。结果表明,本实验合成的生物酶可高效合成UDCA。
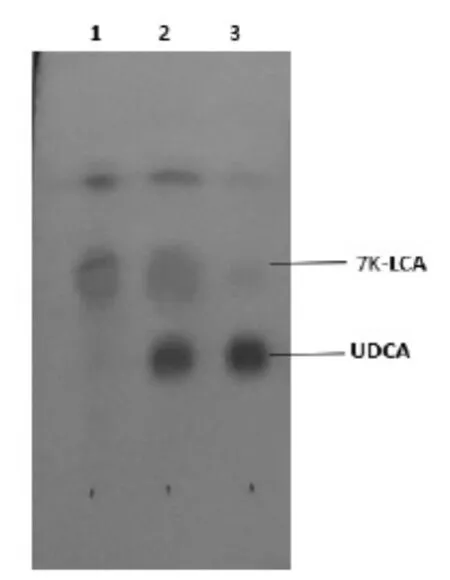
图10 酶法合成UDCA反应产物TLC检测结果
4 结论
7β-HSDH酶作为UDCA酶法合成过程中的关键酶,在UDCA生物合成中具有举足轻重的作用。本研究深入探索其酶学性质,发现Mg2+可作为7β-HSDH酶促反应最佳金属离子,与未添加金属离子的对照组相比,酶活提高57 % 左右。同时发现,缓冲液瞬时高温条件下,7β-HSDH酶的瞬时酶活可提高3.5倍,酶促反应效果明显,此结果可为后续UDCA的生物合成和工业化生产过程中缩短反应时间,进而降低生产成本提供有效的理论依据,也可为其他化学药物的酶法生物合成提供参考。
