非小细胞肺癌患者中免疫检查点抑制剂相关甲状腺炎的调查
2022-08-08王雪滢顾嘉慧穆原徐建南京医科大学第一附属医院检验学部南京210029
王雪滢,顾嘉慧,穆原,徐建(南京医科大学第一附属医院检验学部,南京 210029)
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)是一类通过阻断程序性死亡受体1(programmed cell death protein,PD-1)/程序性死亡配体-1(programmed cell death ligand 1,PD-L1)等信号通路,增强机体抗肿瘤免疫应答的药物[1-2]。ICI对于非小细胞肺癌(non-small cell lung cancer,NSCLC)等肿瘤治疗具有较好的疗效[3]。研究表明,对于局部晚期不可切除的Ⅲ期NSCLC 患者,与安慰剂相比,PD-L1 抑制剂可延长11 个月的无进展生存期[4]。然而,由于ICI可能打破机体原有的免疫稳态,其造成的免疫相关不良反应不容忽视[5]。甲状腺是免疫治疗不良反应常常累及的器官,ICI所致的免疫相关甲状腺炎(immune-related thyroiditis,irT)主要包括免疫相关性甲亢和免疫相关性甲减[6]。目前,国内鲜有 PD-1/PD-L1 免疫检查点抑制剂相关irT的报道。本研究对在南京医科大学第一附属医院接受PD1/PD-L1 免疫治疗的NSCLC患者的临床数据进行分析,以期了解NSCLC患者irT的发生情况和影响因素,为免疫治疗不良反应的预防和管理提供实验依据。
1 对象和方法
1.1 研究对象 收集2019年1月至2021年12月于南京医科大学第一附属医院肿瘤科接受PD1/PD-L1免疫检查点抑制剂治疗的NSCLC 住院患者51例作为研究对象。男39例,女12例,年龄(62.7±9.0)岁。按病理分类,肺鳞癌 27 例(52.9%),肺腺癌 21 例(41.1%),腺鳞癌 1例(2.0%),肺肉瘤样癌1 例(2.0%),NSCLC 伴神经内分泌分化癌 1 例(2.0%)。NSCLC 的诊断依据中华医学会 2021 年出版的肺癌临床诊疗指南[7]。纳入标准:(1)经病理组织学确诊为NSCLC;(2)至少经历过4 个周期规范的PD1/PD-L1 免疫检查点抑制剂治疗,每个治疗周期持续2周或3 周;(3)在免疫治疗前3 个月内曾检测游离三碘甲状腺原氨酸(free triiodothyronine 3,FT3)、游离四碘甲状腺原氨酸(free tetraiodothyronine 4,FT4)和促甲状腺激素(thyroid stimulating hormone,TSH)。排除标准:(1)合并甲状腺疾病;(2)有甲状腺疾病病史或接受过甲状腺手术;(3)治疗前存在 FT3、FT4 或 TSH 水平异常;(4)患有自身免疫性疾病。本研究通过南京医科大学第一附属医院医学伦理委员会审核批准(No.2021-SR-145)。
1.2 资料收集 通过电子病历系统和实验室信息系统收集所有患者的临床资料和实验室检查数据,包括性别、年龄、病理类型、免疫检查点抑制剂类型及血清甲状腺激素水平。FT3、FT4 和TSH 的数据包含免疫治疗前3个月内的基线水平,以及治疗后每3~6周1次的定期监测数据。irT 的诊断主要依据临床检测甲状腺功能。参照美国甲状腺协会指南[8],根据甲状腺功能FT3、FT4和TSH的数据将irT分为甲减、甲亢、亚临床甲减和亚临床甲亢4类。
1.3 方法 血清甲状腺激素FT3,FT4及TSH均采用Cobas e 601电化学发光全自动免疫分析系统及其配套试剂(德国 Roche 公司)检测。FT3 参考范围:3.1~6.8 pmol/L;FT4 参考范围:12 ~22 pmol/L;TSH 参考范围:0.27~4.2 mIU/L。
1.4 统计学分析 采用SPSS 22.0 统计学软件进行统计分析。应用K-S 检验对数据进行正态性和方差齐性分析,符合正态分布的数据以表示,计量资料用两独立样本t检验,非正态计量资料以中位数(四分位数)[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。计数资料应用χ2检验或者Fisher 确切法,率的比较用 χ2检验。以 P <0.05为差异有统计学意义。
2 结果
2.1 患者甲状腺功能异常的发生率 44 例(86.3%)患者接受 PD-1抑制剂治疗,7 例(13.7%)接受PD-L1抑制剂治疗。PD-1抑制剂包括替雷利珠单抗 (13 例,29.5%)、信迪利单抗 (12 例,27.3%)、帕博利珠单抗(9 例,20.5%)、卡瑞利珠单抗(5 例,11.4%)、纳武利尤单抗(3 例,6.8%)、特瑞普利单抗(2 例,4.5%);PD-L1 抑制剂均为度伐利尤单抗。经治疗后,19例(37.3%)发生irT。其中5例(9.8%)为甲减,3 例(5.9%)为甲亢,8 例(15.7%)为亚临床甲减,3例(5.9%)为亚临床甲亢。
2.2 甲状腺功能异常的发生时间 患者发生irT的中位时间为124 d。5 例甲减分别发生于第一次ICI后的第 54、68、96、97、151 天;3 例甲亢发生于第25、26、46 天;8 例亚临床甲减发生于第 55、162、180、184、209、231、269、313 天;3 例亚临床甲亢发生于第 53、55、210 天。
2.3 甲状腺功能异常与患者临床病理参数的关系对irT和非irT患者进行对比发现,性别、年龄、病理类型、药物种类及治疗前FT3、FT4水平差异均无统计学意义(P>0.05)。irT 患者治疗前 TSH 水平显著高于非 irT 患者[2.09 (1.82,3.06)mIU/L vs 1.73 (1.27,2.69)mIU/L,U=201,P =0.04],见表1。经ROC 分析,TSH 用于鉴别irT 的最佳截断值(cut-off)为1.44 mIU/L,阴性预测值为 92.9%,即治疗前 TSH<1.44 mIU/L 的 14 名患者中存在 1 人发生 irT(图 1)。
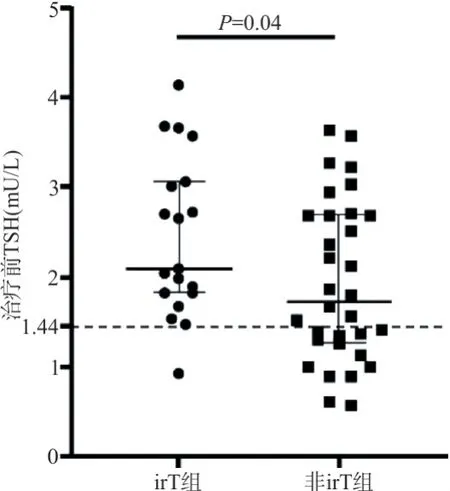
图1 治疗前TSH水平
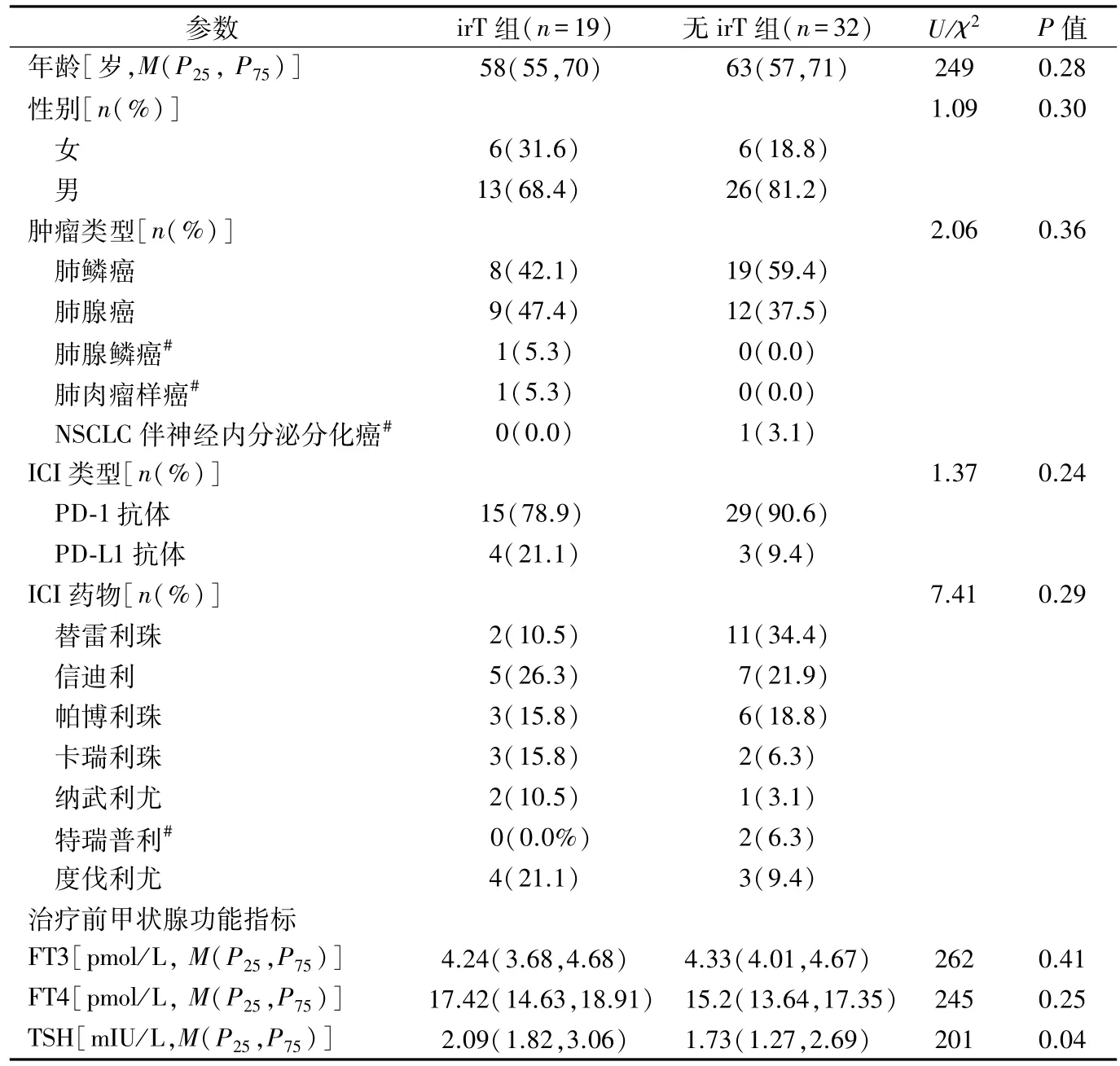
表1 51例患者的临床病理参数
3 讨论
ICI 是肿瘤免疫治疗的重要手段,针对PD-1/PD-L1通路的单抗药物被广泛应用于NSCLC 的治疗[6]。甲状腺功能异常是ICI治疗常见的副作用,但有关irT在PD-1/PD-L1抑制剂治疗的NSCLC患者中的发生率却鲜有研究报道[9]。本研究通过对51例NSCLC患者进行回顾性分析发现,irT 的发生率达 37.3%,其中甲减占 9.8%,甲亢 5.9%,亚临床甲减15.7 %,亚临床甲亢5.9%。一项Meta分析结果显示,在使用PD-1 抑制剂纳武利尤单抗和帕博利珠单抗的患者中,甲减发生率分别为6.5%和7.9%;甲亢发生率分别为 2.5%和 3.8%[10]。本研究报道的irT发生率高于该Meta分析的结果原因,可能与肿瘤类型不同有关,也可能与患者的种族有关。杨子仲等[11]报道,经 PD-1/PD-L1 抗体治疗的患者中irT发生率为29.0%,与本研究的结果相近。
PD-1/PD-L1免疫检查信号通路能防止T细胞过度激活,是机体维持免疫自稳的重要机制。PD-1/PD-L1抑制剂在增强抗肿瘤免疫应答的同时,可能破坏机体的免疫稳态,从而诱发自身免疫性不良反应。PD-1/PD-L1 抑制剂相关irT 的确切发病机制尚不明确。一般认为,可能与产生交叉抗原、诱导自身反应性T细胞及免疫耐受性降低等因素有关[12-13]。
本研究以3 ~6 周为甲状腺功能监测周期,最早1例甲状腺功能异常发生于用药后第25 天,最迟1 例发生于用药后的第 313 天,中位时间为124 d。其中发生临床型甲功异常(甲亢和甲减)的中位时间为61 d。这与Darnell等[14]报道的发生甲亢的中位时间47 d、甲减的中位时间70 d 接近。irT患者通常症状较轻,无需终止ICI 治疗,也无需额外治疗[15],但极少数严重的irT 可能引发危象。因此建议临床应定期监测甲状腺功能,以及时发现irT的发生。
本研究发现irT与治疗前TSH 水平有关,而与患者性别、年龄、病理类型、ICI 治疗类型、药物种类、治疗前 FT3 和 FT4 水平无关。在 TSH <1.44 mIU/L的14例的患者中,仅1 例发生irT。Pollack等[16]对68例患者的回顾性研究也发现,当治疗前TSH<1.72 mUI/L 时无 1 例患者发生 irT,提示治疗前TSH水平对于是否发生irT 是1 个较好的阴性预测指标。
综上所述,接受 PD1/PD-L1 抑制剂治疗的NSCLC 患者中irT发生率高,应定期监测甲状腺功能;治疗前TSH水平与irT 的发生有关。但本研究仍存在局限性,如本次回顾性研究存在一定的偏倚,以及纳入研究的病例数较少,亟需更大规模的研究数据以证实。
