FTO 基因rs9939609 多态性与青少年肥胖及血细胞分析参数的相关性
2022-08-08宁美微徐奥红曾嵘王博达刘湘湖北中医药大学检验学院武汉430000湖北中医药大学黄家湖医院检验科武汉430000
宁美微,徐奥红,曾嵘,王博达,刘湘(.湖北中医药大学检验学院,武汉 430000;.湖北中医药大学黄家湖医院检验科,武汉 430000)
肥胖是影响人身心健康的重要因素,肥胖症已成为全球公共健康问题。肥胖的发生是遗传因素和环境因素相互作用的结果。脂肪量与肥胖相关(fat mass and obesity-associated, FTO)基 因rs9939609位点是全基因组关联分析(genome-wide association studies,GWAS)鉴定的第 1 个肥胖易感位点[1]。该基因位于16 号染色体上,其表达产物通过神经调节控制能量平衡,从而影响肥胖症的发生。rs9939609多态性位于FTO基因的第1个内含子中,对FTO 基因转录调控起决定性作用[2]。研究发现,FTO基因变异不仅与脂肪组织增加及炎症有关,而且可引起相关血细胞分析参数的改变[3]。然而,目前分析肥胖与FTO基因rs9939609 多态性对血细胞分析参数影响的文献少见。因此,本研究进一步验证青少年人群中FTO 基因rs9939609 多态性与肥胖的相关性,旨在探讨肥胖和FTO 基因多态性是否对血细胞分析参数产生影响。
1 材料与方法
1.1 研究对象 选取2020 年1 月至12 月于黄家湖医院体检的青少年人群541例作为研究对象,其中男性206例,女性335 例,中位年龄19 岁。平均体质指数(BMI)为 21.20±3.09。根据 BMI 进一步分为体重过轻组(BMI<18.5)、正常组(BMI 18.5 ~23.9)、超重组(BMI 24.0 ~27.9)和肥胖组(BMI≥28)。纳入标准:(1)年龄为 16 ~26 岁健康的中国汉族青少年人群;(2)各研究对象之间无亲缘关系。排除标准:(1)贫血或患血液病、心血管疾病、肝、肾、肺等疾病或炎症相关疾病;(2)服用可能影响体重药物的患者;(3)肝、肾、甲状腺功能异常及精神功能异常患者;(4)在过去3 个月内减重超过2.3公斤或正在接受减肥治疗的人群;(5)怀孕女性。本研究经湖北中医药大学医学伦理委员会批准,批准文号为[2018]IEC(010)号,研究对象均知情同意。
1.2 主要仪器及试剂 Sysmex XN-1000 全自动血液分析仪及原装配套溶血剂(日本Sysmex 公司),血液DNA提取试剂盒(北京索莱宝公司),PCR 扩增试剂、Taq DNA 聚合酶(武汉生工公司),琼脂糖电泳试剂(北京天根公司)。Nane-400 超微量核酸分析仪(杭州奥盛仪器公司),Biometra Tone梯度基因扩增仪(德国Biometra公司),Tanon-1600全自动数码凝胶成像分析系统(上海天能公司),WIX-ep600c电泳仪、WIX-liteDNA电泳槽(北京韦克斯公司),ABI3730xl基因测序仪(美国ABI公司)。
1.3 全血细胞检测 收集各研究对象清晨空腹静脉血2 mL,EDTA-K2抗凝,颠倒混匀后置于4 ℃保存。采用半导体激光的流式细胞术,使用Sysmex XN-1000全自动血液分析仪检测血液学分析参数,激光照射细胞所得的前向散射光、侧向荧光、侧向散射光对细胞进行计数和分类。检测指标包括各血细胞分析参数并计算联合炎性指标。其中白细胞参数:白细胞(WBC)、中性粒细胞(NEUT)、淋巴细胞(LYMPH)、单核细胞(MONO)、嗜酸性粒细胞(EO)、嗜碱性粒细胞(BASO);红细胞参数:红细胞(RBC)、血红蛋白(Hb)、红细胞压积(HCT)、红细胞平均体积(MCV)、平均血红蛋白量(MCH)、平均血红蛋白浓度(MCHC)、红细胞分布宽度-标准差(RDW-SD)、红细胞分布宽度-变异系数(RDW-CV);血小板参数:血小板(PLT)、血小板压积(PCT)。联合炎性指标:中性粒细胞计数/淋巴细胞计数(NLR)、血小板计数×中性粒细胞计数/淋巴细胞计数(SⅡ)、单核细胞×中性粒细胞计数/淋巴细胞计数(SⅠRⅠ)、淋巴细胞计数/单核细胞计数s(LMR)、单核细胞计数/淋巴细胞计数(MLR)、血小板计数/淋巴细胞计数(PLR)。
1.4 DNA 提取 取上述 EDTA-K2抗凝全血 200 μL,按照血液DNA 提取试剂盒说明书抽提基因组DNA。取1 μL DNA样本,用Nane-400超微量核酸分析仪检测 DNA 的浓度和纯度,选择浓度大于100 ng/μL,纯度约为 1.8 的 DNA 样本用于后续试验,样本置于4 ℃保存。
1.5 引物设计及PCR扩增 按照文献[4]中的FTO基因rs9939609位点引物序列,由武汉生工公司合成。FTO基因上游引物序列:5′-TCCCACTCCATTT CTGACTGTTAC-3′,下游引物序列:5′-AATTCAAAA CTGGCTCTTGAATGA-3′,扩增片段长度为 226 bp。PCR 反应体系为 20 μL,包括 14.3 μL 无菌水,20 mmol/L Buffer 2.0 μL,2.5 mmol/L MgCl20.8 μL,2.5 mmol/L dNTP 0.4 μL,10 μmol/L 上、下游引物各 0.4 μL,5 U/μL Taq DNA 聚合酶 0.1 μL,模板DNA 1 μL。循环参数:94 ℃预变性 3 min;94 ℃1 min,55 ℃ 1 min,72 ℃ 1 min,共31 个循环;72 ℃延伸10 min。取5 μL PCR产物,经15 g/L琼脂糖凝胶电泳,取出现目的条带的 PCR 产物,利用ABI3730xl 基因测序仪进行基因型的判定。rs9939609位点存在3种基因型,即TT、TA、AA。扩增片段长度均为226 bp。
1.6 统计学分析 采用 SPSS 23.0 统计软件进行分析。检测结果用均数±标准差()表示,多组间均数比较采用单因素方差分析,计数资料采用频数、百分率(n,%)表示,率的比较采用 χ2检验。用χ2检验FTO rs9939609基因型分布是否符合Hardy-Weinherg平衡。二元Logistic回归分析用于肥胖人群基因多态性的风险分析,线性回归用于分析FTO基因多态性对血液学分析参数的影响。以P<0.05为差异有统计学意义。
2 结果
2.1 不同BMI血细胞分析参数的比较 如表1 所示,大部分血细胞参数在不同BMI分组间的差异具有统计学意义。白细胞参数的各分类细胞在4 个BMI分组间比较差异有显著的统计学意义(F 分别为10.931、9.946、4.412、8.980、4.584,P 均<0.01);红细胞参数中的红细胞及其衍生指标在不同分组间的比较差异明显(F 分别为 24.646、19.747、20.498、5.122、3.427,P 均<0.05);血小板参数中 PLT 组间差异最为显著(F =4.215,P<0.01)。见表 2。
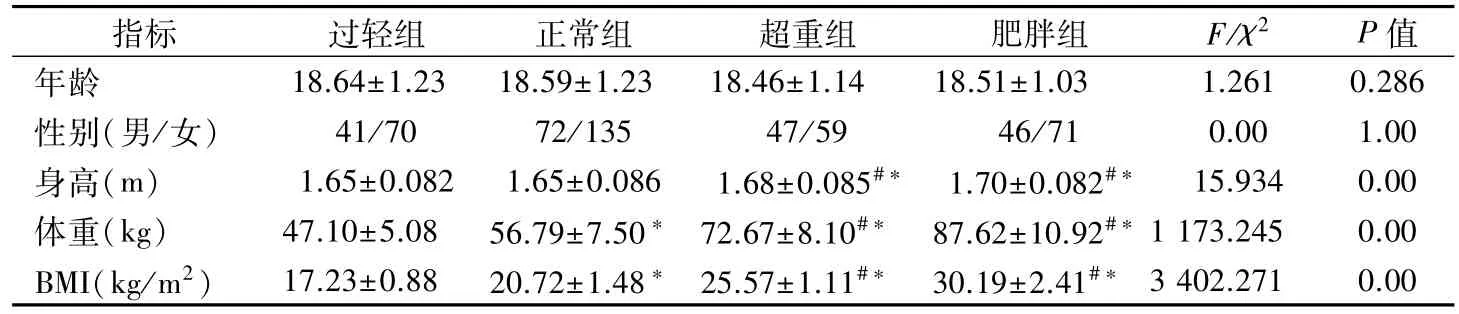
表1 不同BMI分组的一般特征比较
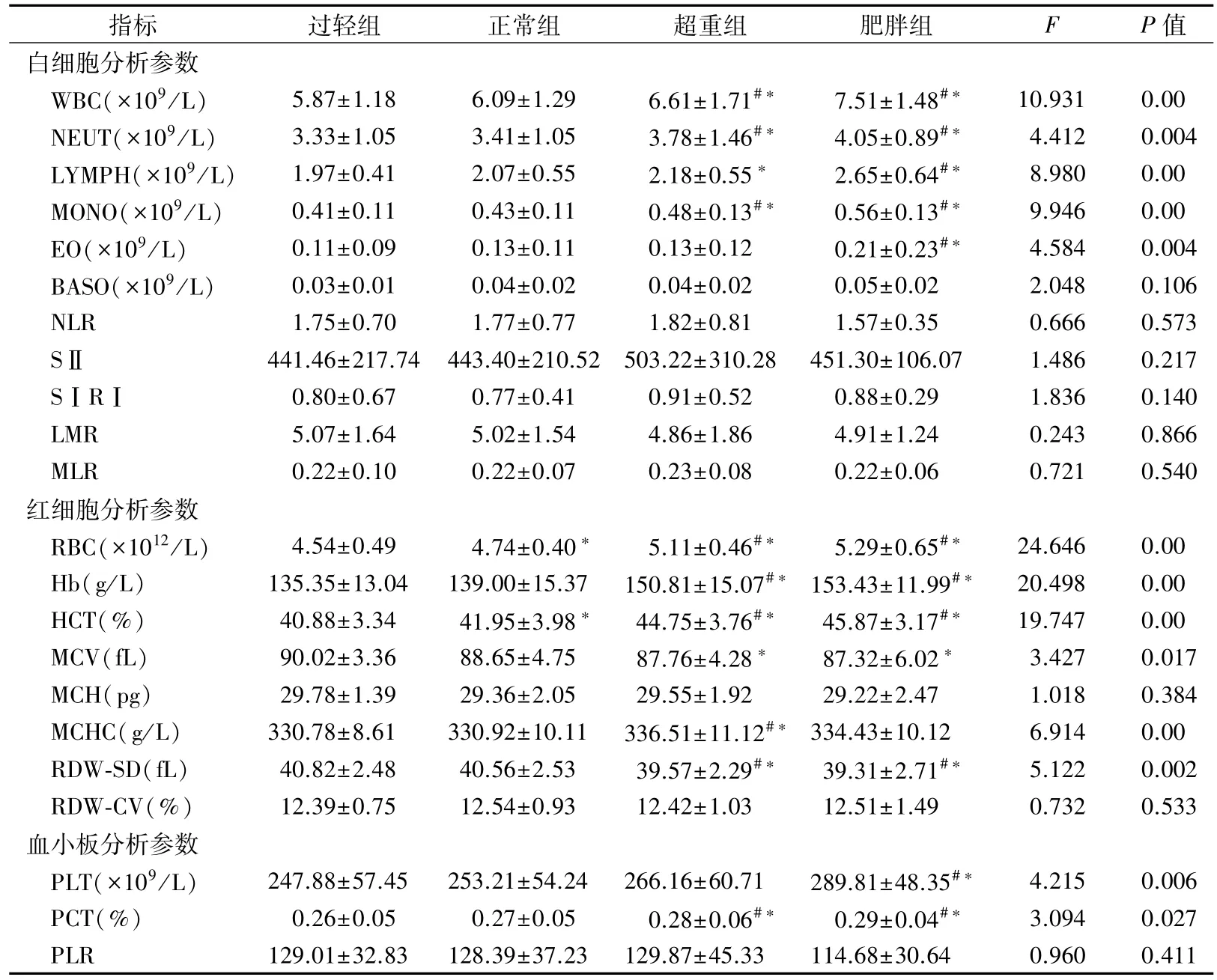
表2 不同BMI分组的血液学分析参数比较
2.2 各组等位基因频率的比较 FTO 基因rs9939609的3种基因型(TT、TA、AA)频率分别为65.43% (354/541)、29.39% (159/541)和 5.18%(28/541),符合 Hardy-Weinberg 平衡(χ2= 3.214,P =0.073)。TT、TA、AA 基因型频率在不同 BMI 分组间的差异具有统计学意义(χ2=28.870,P<0.01),其中,肥胖组AA 基因型频率显著高于正常组,TA和 TT 基因型频率显著低于正常组(χ2= 19.845,P =0.000)。不同BMI 分组间的等位基因频率无明显差异。见表3。
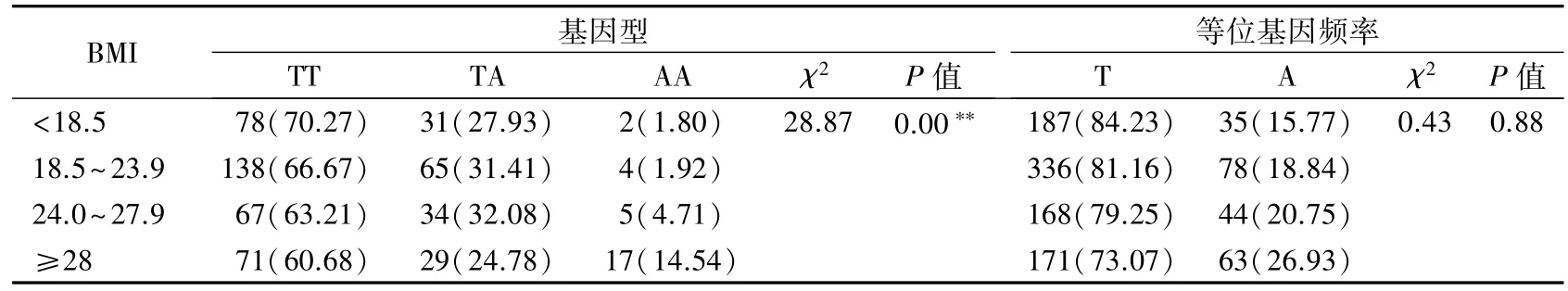
表3 不同BMI分组的基因型及等位基因频率[n(%)]
2.3 FTO基因rs9939609 多态性的肥胖风险分析以TT基因型作为对照,用二元Logistic回归分析得出,AA基因型携带者的肥胖风险是TT基因型携带者肥胖风险的 8.261 倍(χ2=19.34,P = 0.000),A等位基因的肥胖风险是T 等位基因的肥胖风险的1.721 倍(χ2= 7.603,P =0.006)。见表 4。
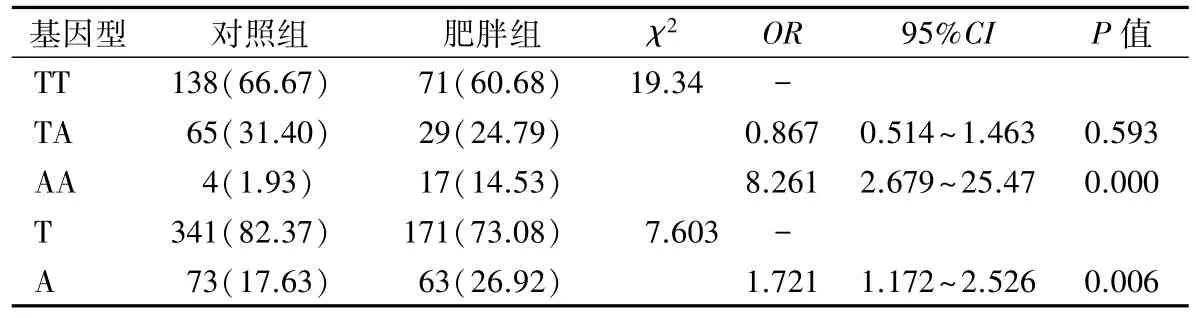
表4 肥胖人群FTO基因rs9939609多态性的风险分析[n(%)]
2.4 FTO 基因 rs9939609 不同基因型与 BMI 及血细胞分析参数的关系 AA基因型携带者的WBC、EO和PLT 数值均显著高于TA 和TT 基因型携带者(F 分别为 4.088、5.087、3.047,P 均<0.05)。见表5。AA 基因型在调整混杂因素前后均与EO 相关,FTO基因rs9939609位点AA基因型是影响EO数值的独立指标,调整前:OR(95%CI)= 0.110(0.039 ~ 0.181),t = 3.065,P = 0.002,调整后:OR(95%CI)= 0.092(0.020 ~ 0.165),t = 2.507,P =0.013。
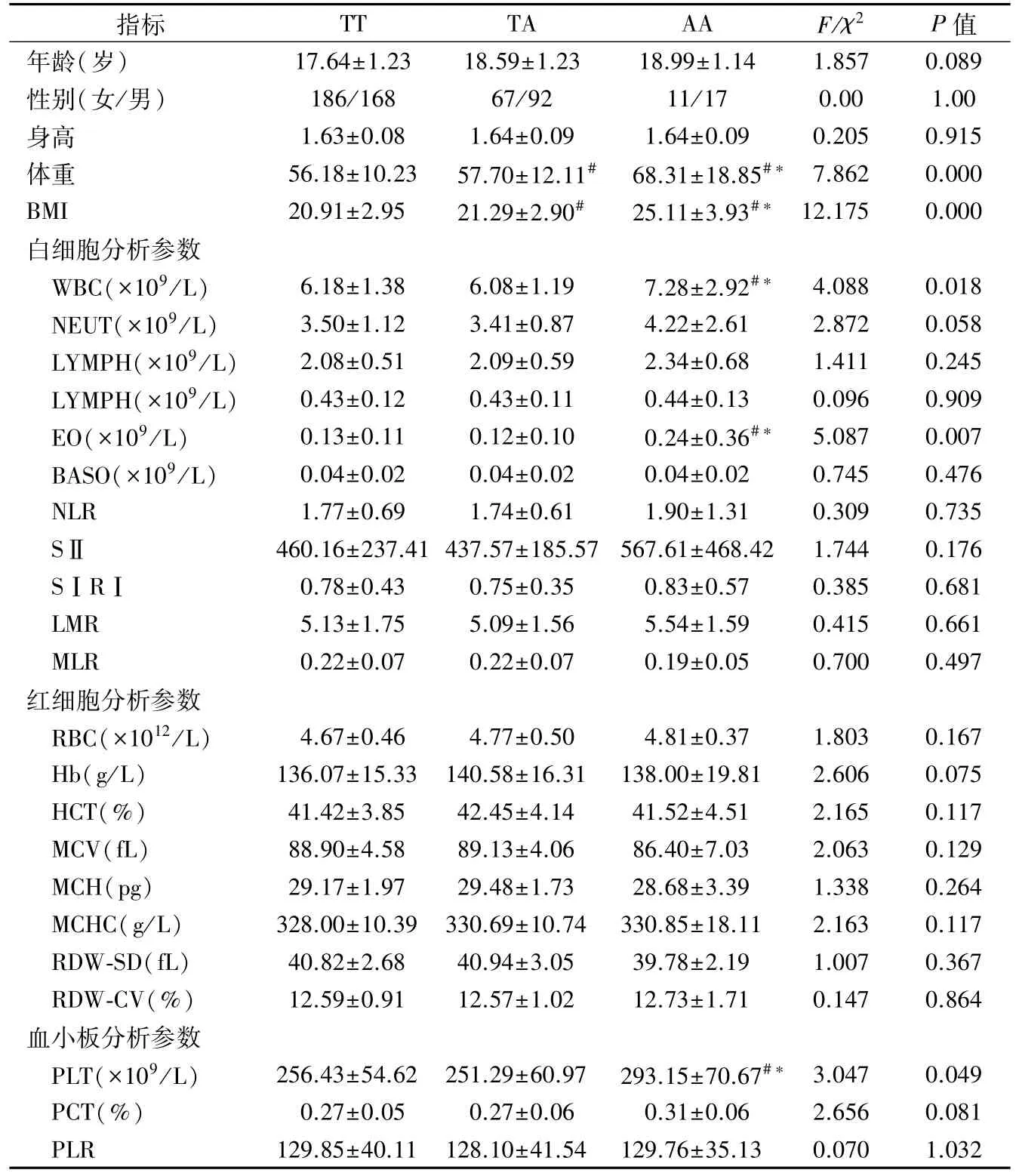
表5 不同基因型的血细胞分析参数比较
3 讨论
目前研究已证实,FTO rs9939609 基因多态性与肥胖相关[5]。本研究表明在中国汉族人群中rs9939609 AA 基因型个体的体重与BMI 显著高于其他基因型,该基因型个体发生肥胖的风险是TT基因型个体的8.261 倍,A 等位基因的肥胖风险是T 等位基因的 1.721 倍,再一次证实 FTO 基因rs9939609多态性与肥胖密切相关。最近一项关于中国台湾汉族人群GWAS研究中,通过对1 110 例肥胖患者和10 852例汉族人群对照检测结果确定了包括rs9939609在内的6个单核苷酸多态性(single nucleotide polymorphisms,SNPs)与肥胖相关[6]。尽管rs9939609是中国人群中较为常见的SNP,但它在欧洲人群中更普遍(41%)[7]。本研究结果中对照组A等位基因的频率仅为19.87%,与之前报道的中国汉族人群中的13.2%相近[6]。提示 FTO基因该位点频率存在种族和地理差异。
与此同时,一些研究证实肥胖会影响血细胞分析参数。有学者发现,BMI 的增加导致 WBC、LYMPH、RBC 和 PLT 计数的增加[8]。另有研究表明,肥胖与 WBC、PLT、PCT、NLR、SⅡ和 PLR 水平呈正相关[9-10]。与这些研究结果相似,本研究中,肥胖组的WBC 等白细胞参数水平明显高于超重组、正常组和过轻组,其中的 RBC、Hb、HCT、PLT 和PCT水平也随着BMI 增大而升高,而RDW-SD 水平随着BMI增大而降低,再次证实了肥胖对各项血细胞参数的影响。但笔者并未发现NLR、PLR等炎症标志物与肥胖之间存在显著相关性,这可能是因为肥胖组中 NEUT,LYMPH,MONO 和 PLT 水平均显著增加。
为此,本研究进一步探讨了FTO 基因多态性是否对血细胞分析参数产生影响。本次研究结果发现,FTO 基因 rs9939609 多态性与 EO 水平之间存在正相关,独立于性别年龄和BMI 等因素,表明FTO基因的变异可能使得EO 在人体内发生数量的变化,这与Fisher等[3]报道一致,说明 FTO 变异不仅增加脂肪组织,而且还可能增强脂肪组织的炎症状态,且与肥胖程度无关。然而Alipour 等[11]的研究结果表明,在2 型糖尿病患者中,FTO 基因rs9939609多态性导致的炎症依赖于肥胖。有新的证据也表明,FTO基因通过改变下丘脑核因子kappa B 信号通路影响代谢结果,而不受体重的影响[12]。上 述不 一 致的 结 论,表 明 FTO 基 因rs9939609多态性导致的炎症可能依赖于肥胖,或通过BMI调控影响FTO基因多态性对白细胞参数的作用,但该结论还需更多的机制研究阐明。
对于红细胞参数,本研究发现AA 基因携带者RBC和Hb水平更高,HCT和MCHC水平分别在A等位基因携带者中更高,但FTO 基因多态性对所有红细胞参数的影响均无统计学意义,这与Zou等[13]结果不同,原因可能与两项研究的设计方法不同有关,本研究单纯探讨FTO 基因多态性对血细胞分析参数的影响,而Zou 等[13]的研究涉及运动联合饮食的干预后,研究FTO基因rs9939609 多态性对红细胞参数的影响。鉴于目前关于FTO 基因多态性与红细胞参数的研究较少,二者关系究竟如何,还需要进一步实验验证。
对于血小板参数,本研究发现AA 基因型的PLT水平明显高于其他基因型携带者,表明血小板活化水平与 FTO 基因多态性密切相关。Kotani等[14]对日本人群 FTO 基因 rs1558902 多态性的研究结果显示,携带风险等位基因的个体PLT数值显著高于其他个体,表明FTO 基因多态性可以调节人体内PLT 水平。本研究对rs9939609 这一位点进行分析,发现两位点的基因多态性都与肥胖相关[15],但各位点对血液学分析参数的影响是否一致,FTO基因激活血小板的信号通路是否通过肥胖的炎症反应调控尚不清楚。
综上所述,本研究证实了中国人群中FTO 基因rs9939609多态性与肥胖密切相关,且肥胖会影响血细胞分析参数,同时新发现 FTO 基因rs9939609多态性对相关血细胞分析参数会产生一定影响,有助于临床对肥胖的诊疗及对血细胞参数影响因素的正确分析。但是,由于肥胖相关炎症反应是通过一个复杂的网络调控系统来实现信号传导和基因水平的特异性功能,参与调控脂肪组织炎症的众多炎症细胞在肥胖的发生发展过程中的作用机制还不清楚,因此,需要进一步对FTO 基因生物功能开展深入研究,以阐明FTO 基因对肥胖和血细胞分析参数影响的分子机制,为肥胖及其相关疾病的诊疗提供新靶点。
