外泌体在肝脏疾病进展及诊疗中作用研究进展*
2022-08-08杨苏丽张转马宇佳徐杨严永敏王亚南江苏大学医学院江苏镇江03苏州市立医院南京医科大学附属苏州医院检验科江苏苏州500
杨苏丽,张转,马宇佳,徐杨,严永敏,王亚南(.江苏大学医学院,江苏镇江 03;.苏州市立医院 &南京医科大学附属苏州医院检验科,江苏苏州 500)
外泌体是细胞分泌到细胞外直径为40~100 nm呈双凹圆盘状囊泡。在双层膜的包裹下,其内部含有DNA、mRNA、microRNA、胞质蛋白等多种物质[1]。外泌体可以通过其携带的生物分子介导细胞与细胞之间的通讯[2]。外泌体在细胞间传送信号的方式主要有3种:(1)直接与受体细胞膜融合,释放它们携带到受体细胞胞质的“货物”[3];(2)通过与靶细胞膜表面的受体结合,起到信号传导作用[4];(3)内吞进入受体细胞后,释放“货物”进入胞质[5]。外泌体参与多个生物学过程如抗原提呈、免疫应答、细胞分化、细胞迁移和肿瘤侵袭等,其在肝脏疾病的发生、发展中也起着重要的生物学作用。Povero等[6]发现肝细胞分泌的外泌体数量和内容物在不同的损伤条件下发生着显著变化,为肝病的诊治提供了实验依据。本文简要概述了肝细胞外泌体在肝脏疾病中的作用及其临床应用。
1 外泌体在肝脏疾病中的作用及应用
1.1 外泌体与酒精性脂肪肝 当男性每周饮酒超过14 杯或女性每周饮酒超过7 杯[7],并导致肝内脂肪占肝脏总重量超过5%时,即可诊断为酒精性脂肪肝病[8]。酒精可以促进外泌体的分泌,如在过量饮酒条件下,含有miRNA-122的肝细胞外泌体的数量增加。miRNA-122 通过靶向HO-1 修饰单核细胞的功能,增强单核细胞诱导的炎症反应[9]。过量饮酒也会影响TOLL样受体4(TLR4)通路,诱导肝脏细胞中的miR-155表达量增加。miR-155 进一步作用于过氧化物酶体增殖物激活受体α(PPARα),诱导弥漫性肺泡出血,miR-155还可以通过C/EBPβ调节巨噬细胞的极化,促进骨髓源性M1表型的巨噬细胞形成[10]。热休克蛋白(Hsp)在巨噬细胞的激活中也发挥了一定的作用:热休克蛋白是肽折叠和转运的关键蛋白,其还有防止细胞应激条件下蛋白质聚集的功能。肝脏细胞通过外泌体分泌Hsp40、Hsp70和Hsp90,在应激反应中介导细胞和组织之间的通信。Hsp70具有刺激单核细胞产生细胞因子的免疫功能。Hsp90 则可以激活 IκB激酶和TLR4通路,从而使核因子κB(NF-κB)激活,进一步导致脂肪变性和TNFα 分泌增加,诱发炎症反应[11]。此外,Ma 等[12]还发现金属硫蛋白 1 和 2(MT1/2)可以激活肝脏中激蛋白激酶凋亡信号调节激酶1(ASK1)和p38丝裂原活化蛋白激酶(P38)。在酒精诱导下,肝细胞会分泌大量富含线粒体DNA的外泌体,该外泌体通过其内部的ASK1/P38,加重炎症和肝损伤,促进酒精性脂肪肝炎的发生。另有研究表明,酒精会促进肝细胞外泌体的释放,富含DAMP 的外泌体会进一步通过 Toll 样受体9(TLR-9)激活肝巨噬细胞(HMS),加重肝损伤。同时HMS 还会上调IL-1β和IL-17,促进肝星状细胞激活,诱导肝纤维化的发生[13]。
外泌体促进着酒精性脂肪肝的发生、发展,因此阻断外泌体的释放可用于治疗酒精性脂肪肝疾病。Verma等[14]发现,半胱天冬酶-3(caspase-3)和 Rho 激酶(ROCK1)可以促进外泌体的释放。通过基因或药理学途径阻止caspase 和Rho激酶的激活可以减少外泌体的产生、酒精诱导的脂肪变性和体内炎症,从而阻止酒精性脂肪肝的形成。因此,阻断caspase-3和ROCK1 可作为酒精性脂肪肝诊疗的新思路。此外,Saha等[15-16]发现酒精使外泌体分泌增加,而外泌体中的 miR-27a 可以使原始单核细胞极化为 M2 巨噬细胞[16-17],因此,miR-27a也是一个治疗酒精性脂肪肝的潜在作用靶点。
1.2 外泌体与非酒精性脂肪肝(NAFLD) 非NAFLD 是一种常见的慢性肝病。在NAFLD 发展过程中,受损或应激的肝细胞会释放外泌体,其数量与肝细胞损伤程度密切相关[7]。研究表明,TRAIL死亡受体5(DR5)促凋亡信号介导脂毒诱导的外泌体的释放,DR5 诱导ROCK1 激活后,促炎肝细胞外泌体被大量释放。外泌体的释放还依赖于肿瘤坏死因子样凋亡诱导配体-受体2(TRAIL-r2)级联信号。肝细胞源性外泌体中含有TRAIL,通过与TRAIL-r2相互作用,进一步激活受体相互作用蛋白激酶(RIP1),最终导致促炎巨噬细胞信号通路的激活[17]。此外,棕榈酸盐也可以诱导外泌体的释放。在棕榈酸盐作用下,肌醇依赖酶1-α(IRE1-α)激活,然后通过X-盒结合蛋白1(XBP1)信号通路,增加外泌体释放。释放的外泌体可以通过C16:0神经酰胺和鞘氨醇磷酸一磷酸受体1(SIP1),介导巨噬细胞趋化,将巨噬细胞募集到肝脏,从而起到促进炎症的作用[18]。脂肪肝患者MLK3激活JNK,使CXCL10在肝细胞分泌的外泌体中富集,诱导巨噬细胞向损伤部位募集,促进炎症发生。另外,肝细胞源性循环外泌体中,线粒体 DNA(mtDNA)含量增加。mtDNA可激活核内体模式识别受体9(TLR9),上调IL-1受体拮抗剂(IL-1RA),从而诱发炎症[19]。
外泌体在NAFLD 的发生、发展中起着重要作用,并为诊断和治疗NAFLD提供了新思路。如高饱和脂肪、高果糖和高胆固醇饮食小鼠,分离的血清外泌体中细胞色素p4502E1(CYP2E1)水平升高。ROCK1 抑制剂法舒地尔(fasudil)可有效地阻断脂毒诱导的外泌体释放,降低外泌体中CYP2E1浓度及FFC饮食诱导的肝脏IL-1β mRNA 水平;法舒地尔还可以显著减轻纤维化,阻止NAFLD的形成[18]。因此,法舒地尔可用于NAFLD 未来药物的开发。外泌体释放后会进一步通过血管非炎性蛋白1(VNN-1)诱导血管生成,并通过内皮细胞介导其内化[20]。肝细胞来源的VNN-1 阳性外泌体是NAFLD治疗的潜在靶点,同时也是肝脏损伤的生物学标志物,可用于NAFLD的早期诊断。Liu 等[21]还发现,脂毒性损伤的肝细胞释放的外泌体中miR-192-5p 的表达量增高,且与肝巨噬细胞的激活以及肝脏炎症损伤有着密切关系。此外,NAFLD 患者肝脏炎症水平和miR-192-5p水平呈正比。因此,miR-192-5p也可以作为NAFLD 的分子标志物[21-22]。
1.3 外泌体与病毒性肝炎 病毒性肝炎尤其是甲、乙、丙型病毒性肝炎仍是全球重大的健康问题[22-23]。外泌体在病毒性肝炎的发生、发展过程中发挥着重要的作用,主要表现在2个方面:一方面外泌体能影响机体的免疫反应;另一方面,它增强了病毒的传播。
乙型肝炎病毒是一种双链DNA的肝特异性病毒。研究表明,HBV感染的肝细胞能释放含有病毒核酸的外泌体,通过信号转导通路,刺激巨噬细胞表达NK细胞活化性受体的配体,使得NK细胞活化,在病毒感染早期促进IFN-γ 的生成,从而诱发HBV 的进一步发展[24-25]。但亦有研究表明,慢性乙型肝炎患者的血清中存在内含HBV 病毒的外泌体,会损伤NK细胞,从而减少IFN-γ的生成,抑制NK细胞的增殖和存活,这可能是病毒摆脱宿主固有免疫的机制[21]。此外,在HBV病毒感染的肝细胞中,HBVmiR-3的表达量随着感染时间延长逐渐增加。HBVmiR-3 下调细胞因子信号转导抑制因子5(SOCS5),使Janus激酶(JAK)/信号转导和转录激活因子(STAT)信号通路激活,从而增强HBV病毒的效应。同时,外泌体中的HBVmiR-3 可以抑制SOCS5 介导的增强型表皮生长因子受体(EGFR)泛素化,促进IL-6 的分泌,以及诱导巨噬细胞M1 极化,从而促进炎症进一步发展[25-26]。
丙型肝炎病毒是RNA病毒,传播途径为血源传播,是引起晚期肝病的重要病因。HCV感染的肝细胞能分泌携带含有病毒核酸和蛋白质的外泌体,并将其内容物传递给其他肝细胞,这种传播方式在一定程度上会抑制抗病毒抗体的作用,增强病毒的传播[22]。Aydin 等[27]发现在持续感染HCV的细胞中,外泌体释放增加。外泌体能促进HCV 的复制,且能促进干扰素λ的分泌。此外,感染HCV的肝细胞分泌的外泌体中含有Ago2蛋白、Hsp90和miRNA-122,它们能够稳定外泌体中的丙肝病毒核酸,从而提高HCV传播稳定性和感染性[23]。而HCV 感染的肝细胞分泌的外泌体中Tim-3/gal-9的表达量也会增加,它会促进CD4(+)T细胞转化为 CD4+CD25+Foxp3+Treg 细胞,从而影响单核细胞的分化,继而抑制机体的免疫反应[24]。
肝炎病毒也能感染肝脏非实质细胞如肝窦内皮细胞(LSECs)、库普 ffer 细胞(KCs)、肝星状细胞(HSCs)等。尽管肝炎病毒并未在这些细胞中复制,但会刺激细胞分泌含有抗病毒分子的外泌体,从而阻断病毒的复制和传播[28]。因此,分析外泌体携带的抗病毒分子可以为诊疗病毒性肝炎提供新思路。
1.4 外泌体与肝纤维化和肝硬化 肝纤维化是一个病理生理过程,在多种因素引起肝脏慢性炎症,Ⅰ型胶原纤维等细胞外基质(ECM)过度沉积在肝细胞间形成纤维性瘢痕,在肝纤维化发展的晚期阶段会进一步发展为肝硬化[29]。在肝纤维化期间,受损肝细胞释放的外泌体能够通过多种途径促进纤维化的发展。Charrier 等[30]研究发现结缔组织生长因子(CTGF)在活化的肝星形细胞(HSCs)中的表达量增高。CTGF是一种在多种纤维化过程中起促进作用的多功能肝素结合糖蛋白,CTGF 经外泌体在HSCs 间转运并直接调节活化HSCs,促进其进行有丝分裂、趋化和纤维化等活动[31]。另外,miR-122 是肝脏特异性表达的一种miRNA,约占肝细胞表达miRNA的72%。miR-122 作为促进纤维化因子,能够调控肝细胞的生长周期、脂质和胆固醇代谢等重要生理功能,并通过外泌体携带参与HSCs 的活化[32]。丝裂原活化蛋白激酶 3(MAP3K3)是 HSCs 中与 miR-122 结合的靶点,MAP3K3与miR-122结合后会促进上皮细胞转化成为肌成纤维样细胞(MFC)。MFC 能分泌大量胶原,而胶原正是肝纤维化中细胞外基质的主要物质;同时MFC还能下调黏附分子、上调间充质,进一步促进肝纤维化[33]。对于慢性乙型肝炎患者,低水平的血清miR-122可能意味着严重的重度肝脏纤维化[34],这也提示了肝纤维化的病理改变与外周血中外泌体的释放有关。此外,在四氯化碳诱导的小鼠肝纤维化或肝硬化模型中,小鼠外周血中外泌体源性miRNAs表达量显著增高,这些miRNAs在HSCs的活化、增殖以及迁移过程中发挥了关键性作用[35]。外泌体源性miRNA 可诱导和促进肝纤维化及其他伴有门脉高压的肝脏疾病的发展[36]。
具有促增殖活性的外泌体可以逆转各种原因引起的肝损伤,并且可以成为未来肝损伤的新型疗法[37]。外泌体中miR-155与肝硬变的进程及预后有着密切关系,随着肝纤维化和肝硬化的程度的加重,miR-155 的表达量随之增加。因此,外泌体中的miR-155可作为肝纤维化诊断的生物学标志物[38]。此外,有学者发现,miR-124[39]和miR199a-5p[40-41]经外泌体在其邻近的肝细胞或HSCs间转运,可与CTGF2的3′-非编码区直接结合并抑制其表达,从而阻碍肝纤维化的发展。这种肝细胞或HSCs之间外泌体的相互传递过程,可能受到整合素αγβ3、整合素 α5β1 及硫酸乙酰肝素蛋白聚糖调节[41]。这些外泌体穿过细胞间隙,在不同肝细胞之间传递“治疗分子”,导致胶原酶活性升高,活化的肌成纤维细胞凋亡及促炎细胞因子和促纤维化细胞因子的减少,最终导致ECM产生减少和肝纤维化消退[39]。Tang等[42]还设计了携带靶向转录激活因子3(STAT3)的siRNA 或反义寡核苷酸的外泌体 (iExosiRNA-STAT3或iExomASO-STAT3)。iExosiRNA-STAT3或iExomASO-STAT3治疗可以有效抑制小鼠肝纤维化,减轻肝损伤,为肝纤维化提供了一种新策略。
1.5 外泌体与肝细胞癌 肝细胞癌(HCC)是最常见的原发性肝癌,也是癌症相关的第二大死亡原因[43-44]。其危险因素主要有病毒性肝炎、肝硬化、长期过量饮酒、家族史、化学污染等,近年来肥胖导致的非酒精性肝病和非酒精性脂肪性肝炎也日益成为肝细胞癌的重要病因之一[44]。外泌体在肝细胞癌的发展过程中发挥着重要作用。肝细胞癌细胞分泌的外泌体中含有多种miRNA,这些miRNA通过抑制转化生长因子β激活酶-1(Tak-1)的活性,促进肝细胞癌的发生、发展[42]。此外,肝细胞癌是一种高度依赖血管的肿瘤,血管能为其生长活动提供大量的营养物质。癌细胞分泌的外泌体则可以促进血管生成,从而促进肝细胞癌的发生、发展[2]。肝细胞癌细胞分泌的外泌体中还含有miR-103,其可作用于内皮细胞,增加血管的通透性,进而促进肝细胞癌的转移[2,45]。
肝细胞癌来源的外泌体携带特有的标志物,可将其作为肝细胞癌发生、发展和转归治愈的分子标志物,从而监测肝细胞癌发生、发展治疗的整个过程。Kogure 等[46]在Hep3B衍生的外泌体中发现了134个miRNAs,其中有11个miRNA(如 miR-584 和 miR-517c)为外泌体所特有,这些miRNA可作为监测的靶点。将含有特定生物分子或小分子药物的外泌体进行改造,再将其递送至靶细胞发挥生物效应,可起到治疗的作用。如Hsp 可提高肿瘤免疫原性并诱导NKT细胞的抗肿瘤反应,故而携带HSP 的外泌体可成为肝细胞癌免疫治疗的新策略[47]。在肝细胞癌患者中,外泌体内miR-638表达量增高,且miR-638与肿瘤复发有关。因此,miR-638可能成为肝细胞癌的一项预后指标[48]。此外,Yu等[49]发现外泌体中DEAD盒解旋酶55(DDX55)介导肝癌细胞与内皮细胞以及高、低DDX55水平的肝癌细胞之间的细胞交流,促进肝癌细胞血管的生成以及恶性表型的形成。因此,DDX55也可以作为HCC 的一个治疗靶点以及预后指标[49-50]。表1中为外泌体在肝脏疾病中的作用及其临床应用概括。
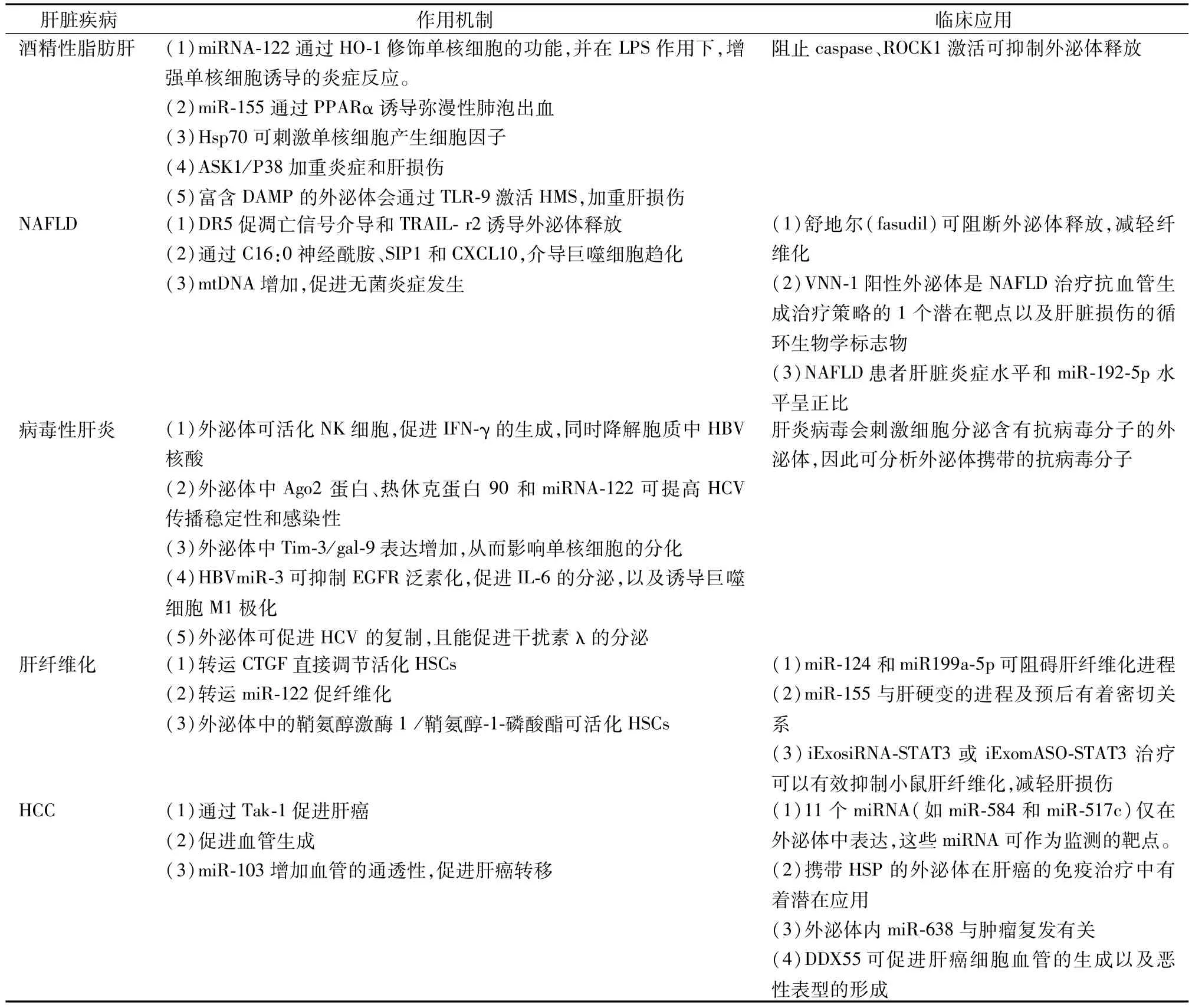
表1 外泌体在肝脏疾病中的作用及其临床应用
2 外泌体检测技术
2.1 微流体动力捕获装置 该装置结合了亲和力和被动微流控粒子捕获的方法来对外泌体进行定量检测。首先将直径为20 μm的微球用链霉亲和素和生物素化抗体激活,然后用抗原-抗体亲和结合的方法将外泌体固定在微球表面,最后再用具有捕获阵列的微流体装置捕获单珠,随后进行下一步分析。这种微流体装置可以对外泌体进行快速精准定量,很好地满足了临床快速定量检测外泌体的需求[50]。
2.2 CRISPR/Cas12a 系统 该方法基于 CD63 适配体和成簇的规则间隔短回文重复(CRISPR)/Cas12a 系统检测外泌体。CD63适配子作为一种适应性强的核酸链,负责将大量的外泌体转化为核酸进行检测;CRISPR/Cas12a负责高度特异性扩增核酸信号。该方法的检测范围为(3×103~6×107)粒子/μL。该方法的敏感性和特异性都较高,为外泌体的临床应用奠定了基础[51]。
2.3 纳米等离子体夹层免疫分析法 该方法用金-银核壳纳米金字塔和金纳米棒和外泌体形成三明治免疫复合物,随后进行免疫分析,产生独特的等离子体信号,从而快速、敏感地检测外泌体。该技术为外泌体的检测提供了一种新颖可行的方法,可以用于癌症的早期诊断[52]。
2.4 纳米磁珠检测法 该方法首先利用一种类似杨梅的磁珠,与适配体偶联,对外泌体进行捕获和回收。随后,通过三色探针识别表皮生长因子受体(EGFR)和上皮细胞黏附分子(EpCAM),或自动锚定到脂质双层,对外泌体蛋白(EGFR和EpCAM)和外泌体进行定量。该方法对EGFR的检出限为 0.96 pg/mL,EpCAM 的检出限为 0.19 pg/mL,外泌体的检出限为2.4×104个/μL,准确性较高。此外,该技术可用于分析血浆中的外泌体,以对癌症进行筛查,癌症诊断的准确率可达96.0%。该技术为外泌体分析和智能疾病诊断提供了新方法[53]。
2.5 全内反射成像椭圆偏振法 该方法使用传感表面来捕获外泌体,还可以通过全内反射成像椭圆偏振法(TIRIE)检测外泌体表面标志物。该方法检出限为0.4 μg/mL。该方法较之传统方法更为方便、快速、准确,为外泌体的临床检测提供了新手段[54]。
2.6 末端脱氧核苷酸转移酶介导的信号放大系统 1,2-二油酰基-3-三甲基铵-丙烷脂质体表面固定的适配体可以和靶外泌体膜蛋白高特异性地结合,末端脱氧核苷酸转移酶的聚合反应再将适体-外泌体复合物的信号放大,从而实现外泌体的高灵敏度检测。该方法与其他方法相比,可以精确识别外泌体亚群,且无需标记和分离,为精准治疗提供了新策略[55]。
2.7 基于纸张的ITP 技术 该技术整合了ITP 的聚焦能力和基于纸张的横向流的多重能力,可以精准地从外囊泡中分离得到靶外泌体并进行电动富集。该方法检测范围为(1.2~2.0)×106个/mL。该技术可以准确地识别靶外泌体亚群,还能多重检测目标外泌体的蛋白质生物标志物,为外泌体的临床应用提供了技术支持[56]。
2.8 铁基金属有机框架 该方法首先利用CD63蛋白适配体作为光学活性层和外泌体特异性识别元件,接着又构建了Fe-MOF生物界面,外泌体与CD63蛋白适配体特异性结合改变了Fe-MOF表面DNA配体的构象,导致Fe-MOF催化活性发生变化,最终颜色发生了显著变化。该方法检出限为 5.2×104
个/μL。此技术使外泌体检测可视化,并且经济、快速、方便,在临床上有很大应用价值[57]。外泌体的各种检测方法见表2。
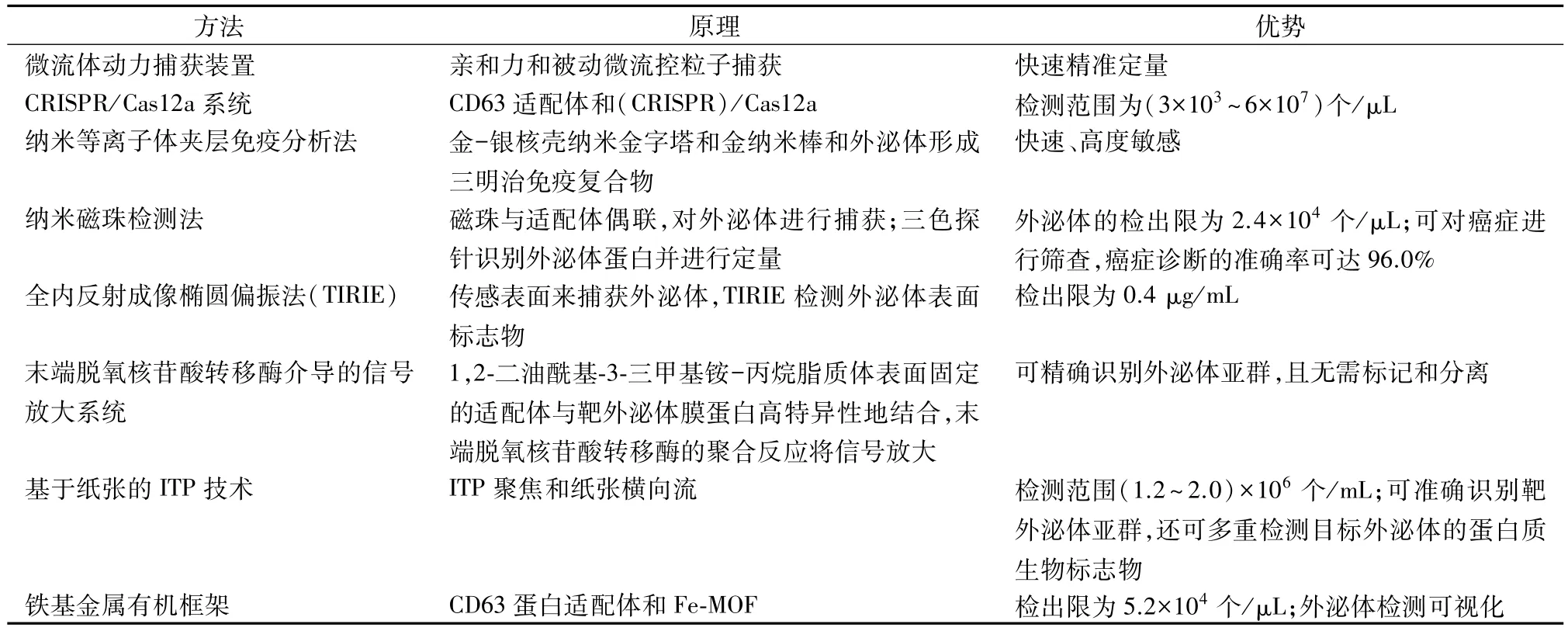
表2 外泌体的检测方法
3 外泌体内容物的检测
在双层膜的包裹下,外泌体其内部携带着蛋白质、DNA、mRNA和miRNA等生物分子,目前的检测技术主要针对蛋白质、核酸、脂质3个方面来对外泌体进行分析。
3.1 蛋白质检测 当饮酒过量诱发酒精性脂肪肝时,患者肝细胞通过外泌体分泌Hsp40、Hsp70以及Hsp90,诱导应激反应;有研究表明肝炎病毒感染的肝细胞能分泌携带含有病毒蛋白质的外泌体,如Ago2 蛋白、Hsp90 等,同时还能将这些病毒蛋白传递给其他肝细胞;在肝纤维化期间,结缔组织生长因子在活化的肝星形细胞中表达量增高。肝细胞源性外泌体中含有TRAIL,肝脏疾病在不同阶段,肝细胞来源的外泌体中所含的蛋白质不同,均可作为检测靶点,为诊断和治疗提供了新思路。
目前比较常见的外泌体蛋白质检测方法有蛋白免疫印迹、ELISA、流式细胞术、质谱法等。此外,Liu 等[58]研究出了纳米酶传感器阵列加上溶剂介导的信号放大法来分析外泌体蛋白质。该方法利用适体修饰的C3N4 纳米片(Apt/C3N4 NSs)和溶剂介导的信号放大构建了纳米酶传感器阵列,用于外泌体蛋白的比率荧光检测。该技术外泌体的检出限为 2.5×103粒子/mL。此外,通过算法学习,该技术可以分析不同患者血液中外泌体蛋白的差异。Di 等[59]研发了一种纳米酶辅助免疫吸附分析(NAISA)法,对外泌体蛋白进行快速的多重分析。这种NAISA系统是将类过氧化物酶纳米酶安装到外泌体的磷脂膜上,再使用纳米酶催化的比色法对外泌体蛋白通过测定,时间少于3 h,无需多步骤温育和洗涤操作。该技术可以分析来自不同细胞系和临床样本的外泌体蛋白,且检测快速方便,在癌症的早期诊断和鉴别方面有很大的应用价值。
3.2 核酸检测 肝细胞可以分泌外泌体,将核酸从其亲本细胞转移到目标受体细胞。外泌体中被高度认为是肝脏疾病生物学标志物的成分之一是核糖核酸,包括信使mRNA以及microRNA等。当过度饮酒时,含有miRNA-122的肝细胞外泌体的数量增加。同时,过量饮酒激活了TOLL样受体4(TLR4)通路,诱导肝细胞外泌体中miR-155 表达量也增加。此外,肝细胞源性循环外泌体中,mtDNA 含量增加,mtDNA会诱发炎症,导致疾病的加重。研究发现,病毒性肝炎患者的肝细胞分泌的外泌体含有病毒核酸,加重了机体的感染。肝脏疾病进展到晚期有很大的可能性会发展成为肝细胞癌,肝细胞癌细胞分泌的外泌体中含有多种miRNA,如miR-103,这些miRNA可以促进肝细胞癌的发生、发展以及恶性转移等。总之,不同肝脏疾病患者的肝细胞分泌的外泌体都携带特有的标志物,能够作为肝脏疾病发生、发展和转归治愈的分子标志物。
目前比较常见的外泌体核酸检测方法有荧光定量PCR、二代测序技术等。陈晨[60]提出了单分子定位显微镜(SMLM)外泌体超分辨成像技术。该技术优化了单分子定位显微镜成像时间与空间分辨率,可以追踪单个外泌体内部miRNA在细胞内的动态变化以及记录外泌体在受体细胞内释放miRNA的全过程。此外,该技术还可以通过算法学习,对外泌体表面肿瘤标志物的表达量进行分析。Jiang等[61]研究出了原位外泌体miRNA 的测定技术。该技术首先合成 5,5′-二硫代双(2-硝基苯甲酸,Au-DTNB),进入外泌体,与目标miRNAs 结合后诱导拉曼散射信号。接着加入Fe3O4-TiO2纳米粒子,通过TiO2外壳的亲和作用富集外泌体,进一步检测拉曼散射信号。该技术miRNA 的检出限为0.21 fmol/L。该方法不需要预处理且不需要捕获抗体,可作为一项无创液体活检技术应用于临床诊断。Zheng等[62]设计了DNase Ⅰ辅助2′-o-甲基分子信标(eMB)来定量检测外泌体miRNA。eMB可以抵抗DNase Ⅰ的酶消化,因此,该技术可以高度敏感地检测miRNA(检测限为2.5 pmol/L)。此外,Qian等[63]还设计了外泌体miRNA等温扩增和检测的便携式系统。该系统由2个连接的流动池组成,分别用于处理外泌体和检测miRNA。从外泌体中提取的miRNAs 通过芯片扩增然后进行定量检测。此外,其还搭建了便携式检测仪器,使用低成本微控制器进行核酸扩增,荧光图像,放大曲线等分析。该技术为外泌体miRNAs 的即时液体活检提供了实验依据。
3.3 脂质检测 大多数关于外泌体诊断价值的研究都集中于蛋白质和miRNA。外泌体外层的脂质双层膜结构使得外泌体在体内外均能保持稳定,外泌体中特定的脂质组合可以很好地成为早期检测肝脏疾病的生物学标志物。Benous等[64]利用超高效液相色谱-串联质谱对外泌体的脂质进行了分析。其使用超高效液相色谱-串联质谱分析了坏死的股骨头和健康人股骨头的外泌体脂质代谢差异,鉴定出18种差异脂质代谢产物,为外泌体代谢分析提供了新思路。与非HCC外泌体相比,HCC外泌体中富集了10种脂类。使用超高分辨率质谱法发现,外泌体鞘氨醇、双心磷脂、溶血磷脂酰丝氨酸和O-酰基-1-羟基脂肪酸的高丰度与HCC 密切相关[65]。目前比较常用的外泌体脂质检测方法有质谱法、荧光测定法等。
4 总结和展望
外泌体是细胞分泌到外环境的纳米级囊泡,所携带的疾病特异性蛋白质、核酸等均可作为检测靶点,为诊断和治疗提供了新方案。但是,要将外泌体应用于临床治疗还面临着很大的挑战。首先,我们对外泌体的合成机制及具体功能了解的还不够透彻;其次,现阶段缺乏经济有效的外泌体分离技术,而无法大规模工业化生产;最后,目前尚不能做到抑制外泌体中某个与疾病发生相关分子活性的同时,不影响外泌体的正常功能。虽然当前外泌体生物学仍然不够成熟,但随着越来越多研究者的加入,相信在不久的未来,外泌体可在临床上得以广泛应用,为患者带来福音。
