染色体微阵列分析在脉络丛囊肿胎儿产前诊断中的应用*
2022-08-08王森林王朝红李景然孙玉秀庞宇朱健生蔡昭方安徽医科大学附属安徽省妇幼保健院医学遗传中心妇产科合肥230000
王森林,王朝红,李景然,孙玉秀,庞宇,朱健生,蔡昭方(安徽医科大学附属安徽省妇幼保健院 .医学遗传中心,.妇产科,合肥 230000)
脉络丛囊肿(choroid plexus cysts,CPC)是指位于胎儿颅内一侧或双侧脉络丛内充满脑脊液的假性囊肿,是孕中期产前超声检查常见的软指标之一。研究证实,胎儿CPC 与染色体异常存在相关性,会导致不良的妊娠结局[1]。目前,传统的染色体显带核型分析是诊断染色体异常的金标准,可检测非整倍体、结构重排和片段较大的染色体畸变,但其分辨率较低,不能检测出<5 Mb的拷贝数变异(copy number variations,CNVs)[2]。染色体微阵列分析(chromosomal microarray analysis,CMA)是一种高分辨率、高通量的全基因组筛查技术,主要用于检测染色体微缺失和微重复,能够快速、准确地检测到基因组拷贝数的不平衡变异[3]。因此,本研究拟采用CMA技术和染色体核型分析技术对187例羊水样本进行分析,旨在探讨CMA 技术在CPC胎儿产前诊断中的应用价值,以期为产前遗传咨询及胎儿预后评估提供实验依据。
1 资料和方法
1.1 一般资料 选取2017年4月至2020年11月在安徽省妇幼保健院经超声诊断为胎儿CPC 的孕妇187例。年龄为19~44岁,中位年龄29岁,平均孕周(20.23±1.26)周。纳入标准[4]:单活胎,孕中期超声胎儿脉络丛内出现直径≥2 mm、边界清晰的无回声区。排除标准:多胎妊娠,孕妇感染急性期。本研究经安徽省妇幼保健院医学伦理委员会批准[批准文号:2016(09)],在检测前告知 CMA 和核型分析的优势和局限性,患者或家属知情同意且自愿选择后,同时进行羊水细胞核型分析和染色体微阵列分析。根据不同指标,将187例CPC胎儿分为3组:孤立性CPC 胎儿157 例,CPC 合并超声软指标18例和CPC合并超声结构异常12例。
1.2 试剂与仪器 原位载玻片培养盒(杭州宝荣公司),羊水细胞培养基(美国 Gibco 公司),DNA提取试剂盒(QIAamp DNA Blood Mini Kit,德国Qiagen公司),全基因组扩增试剂盒、Illumina Infinium HD assay 试剂盒(美国Illumina 公司)。染色体分散仪(美国 Thermotron 公司),GLS-120 全自动染色体核型扫描捕获系统(德国Leica 公司),杂交炉、洗涤工作站、芯片扫描仪(美国Affymetrix 公司),Nanodrop 2000 超微量分光光度计(美国NanoDrop公司)。
1.3 方法
1.3.1 样本的采集 孕妇于妊娠 18 ~ 26 周,由产前诊断中心在超声引导下行羊膜腔穿刺术,抽取孕妇胎儿羊水34 mL。其中24 mL经培养后进行传统染色体G显带核型分析,10 mL用于CMA检测。
1.3.2 核型分析 取上述 24 mL 羊水,经 258×g 室温离心10 min,弃上清,保留0.5 mL细胞悬液,加1 mL羊水培养基至离心管内,混匀后吸取悬液接种至原位培养盒,移至37 ℃、5% CO2培养箱预培养40~48 h,再加入3 mL 新鲜羊水培养基培养7 d后,从培养盒一侧轻吸培养液转移至培养瓶中进行传代培养。原培养盒中加入5 mL羊水培养基培养1 d 后,加入20 μg/mL 秋水仙素 0.1 mL,置37 ℃恒温箱培养30 min,弃上清,低渗处理(加入5 mL 预热的10 g/L柠檬酸钠,37 ℃恒温静置30 min),预固定(加入5 mL 5%冰醋酸,室温静置7 min),漂洗(加入5 mL 固定液),固定(加入5 mL 固定液,室温静置20 min),取出玻片至吸水纸上沥去多余的固定液,放入分散仪中晾干,再放入鼓风干燥箱中2 h,1.5 g/L 胰蛋白酶消化 14 ~18 s,生理盐水清洗后,Giemsa染色,冲洗晾干后,采用GSL-120自动扫描仪捕获羊水核型。使用Cytovision核型分析软件(德国Leica公司)计数20个中期细胞核型,并分析5个核型,如有异常核型,增加计数量。核型结果按照国际人类细胞遗传学命名系统(ISCN 2016)进行描述[5]。
1.3.3 样本 DNA 提取 取各孕妇羊水 10 mL,置于离心管中,580×g 离心10 min,弃上清液。按照QIAamp DNA Blood Mini Kit 说明书提取基因组DNA,Nanodrop 2000分光光度计检测DNA浓度,取吸光度(A260nm/A280nm)值为 1.8 ~ 2.0 的样本,置-20 ℃保存。
1.3.4 CMA 检测 按照美国 Affymetrix 公司提供的CytoScanTM750k 芯片的标准操作流程对孕妇羊水细胞DNA 进行检测,并应用Affymetrix Chromosome Analysis Suite(ChAS)2.0 软件对检测结果进行分析。通过检索 DGV (http:/ /dgv.tcag.ca/),DECIPHER(https:/ /decipher.sanger.ac.uk /),ISCA(http:/ /dbsearch.clinicalgenome.org/search/),Clin-Gen(https:/ /www.ncbi.nlm.nih.gov/projects/dbvar/clingen/),ClinVar(https:/ /www.ncbi.nlm.nih.gov/clinvar/),OMIM(https:/ /omim.org/),PubMed (https:/ /pubmed.ncbi.nlm.nih.gov/)等公共数据库,综合所得报道信息判读CNVs 的临床意义。根据美国医学遗传学与基因组学会指南[6],将CNVs分为三大类 5 级:(1)致病性 CNVs(pathogenic CNVs,pCNVs);(2)良性 CNVs(benign CNVs);(3)临床意义不明 CNVs(variants of unknown significance CNVs,VOUS CNVs);(4)可能致病性 CNVs(likely pathogenic CNVs);(5)可能良性 CNVs(likely benign CNVs)。
1.4 统计学分析 采用 SPSS 23.0 软件对数据结果进行统计学分析,计数资料以率(%)表示,率的比较采用 χ2检验,以 P <0.05 为差异有统计学意义。
2 结果
2.1 187 例CPC 胎儿常规染色体核型分析结果传统染色体核型分析技术检出染色体异常12 例,检出率为 6.42%(12/187),其中 18-三体 9 例、21-三体2例和性染色体异常 1 例(47,XXX)。见表1。
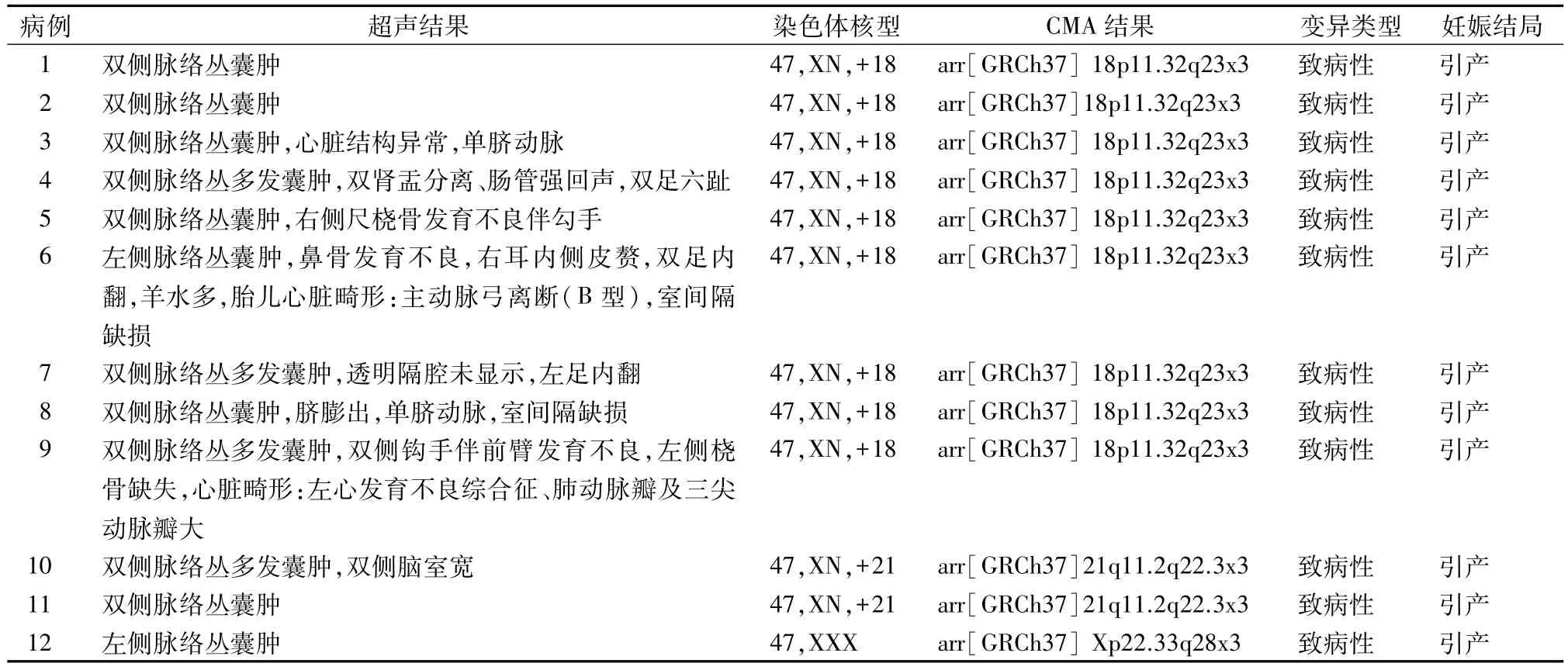
表1 12例CPC胎儿的异常核型分析结果
2.2 187 例 CPC 胎儿 CMA 结果 在 187 例 CPC胎儿中,CMA技术检出的12 例染色体非整倍体异常与传统核型分析结果一致。此外,CMA 技术还检出异常CNVs 16例,额外的检出率为8.56%(16/187)。16 例异常 CNVs 中,致病性 CNVs 5 例,VOUS CNVs 11 例。5 例致病性 CNVs 中,2 例1q21.1q21.2 区域存在片段缺失,大小分别为 1.80 Mb 和 1.89 Mb,1 例 17q12 区域存在 1.46 Mb 缺失,2 例 Xp22.31 区域存在 1.68 Mb 缺失。8 例 VOUS CNVs中,1例18p11.32区域存在512 Kb重复,1例2p15p14 区域存在 1.62 Mb 重复,1 例 7q31.32 区域存在 245 Kb 缺失,1 例 6q26 区域存在 1.21 Mb 重复,1 例 5q11.2 区域存在 514 Kb 重复,1 例 Xq26.1区域存在701 Kb重复,1例15q13.1q13.2区域存在1.40 Mb 重复,1 例 11q14.3 区域存在 1.23 Mb 重复,1 例2q13 区域存在1.71 Mb 重复,1例Xp22.31区域存在 1.38 Mb 重复,1 例 13q12.12 区域存在1.68 Mb重复。见表 2。
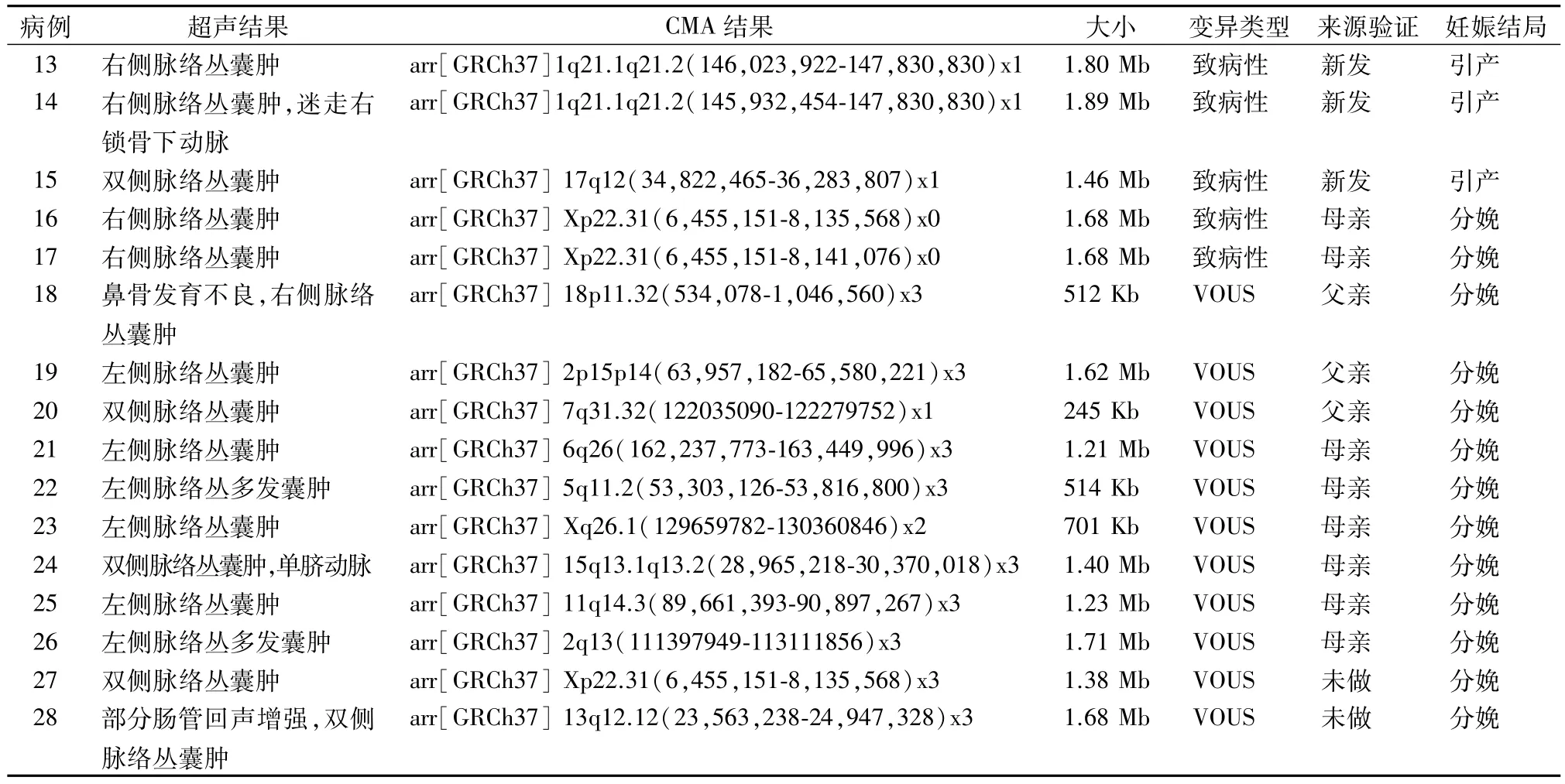
表2 16例核型正常CPC胎儿的异常CMA结果
2.3 不同类型CPC胎儿染色体异常的比较 孤立性CPC胎儿组157例,pCNVs 检出8 例,检出率为5.10%(8/157);CPC 合并超声软指标异常胎儿组18 例,pCNVs检出 2 例,检出率为 11.11%(2/18);CPC合并超声结构异常胎儿12 例,pCNVs 检出7例,检出率为 58.33%(7/12)。3 组检出率之间的差异有统计学意义(χ2=38.33,P =0.000)。
3 讨论
胎儿CPC 是妊娠中期重要的超声软指标之一,约有1%~2%的胎儿会检出CPC[7]。产前超声检查胎儿出现CPC 时,常提示其存在染色体异常的风险较高,尤其是18-三体[8]。目前染色体核型分析作为常用的产前诊断技术,仅能检出较大片段的染色体结构异常,无法为临床产前咨询和胎儿预后评估提供更全面更详细的信息。
本研究中187例CPC胎儿CMA共检出pCNVs 17 例,检出率为 9.09%,与 Cai 等[9]报道的10.95%接近;与齐艳等[1]报道的3.62%存在一定的差异,这种情况不排除由样本量不同而引起的偏差或与CPC胎儿合并其他超声异常有关。由此可见,除了染色体核型异常外,pCNVs 也是CPC 胎儿常见的染色体异常。2 例为 1q21.1q21.2 区域存在微缺失,均涉及 1q21.1 缺失综合征(1q21.1 deletion syndrome),主要表型包括智力低下、小头畸形、先天性心脏异常等[10],1 例为 17q12 区域存在微缺失,涉及肾囊肿与糖尿病综合征(renal cysts and diabetes)综合征,主要表型包括泌尿生殖系统异常(特别是肾囊肿、肾小球囊性肾病和肾发育不良)、糖尿病、自闭症、神经认知障碍和精神分裂症等[11];2 例为Xp22.31 区域存在 1.68 Mb 缺失,该区域中 STS(300747)基因的缺失与X连锁隐性遗传的鱼鳞病(recessive X-linked ichthyosis)有关,主要表现为皮肤干燥、脱屑为主的角化障碍性皮肤病[12]。这5例pCNVs表现出CPC,丰富了这些病例的临床表型。另外,17例pCNVs中有12例为染色体非整倍体异常,其中最常见的是18-三体,共有9例。孤立性CPC胎儿中出现2例18-三体,提示孤立性CPC胎儿发生18-三体的风险较高。CPC 胎儿出现2例21-三体和1例性染色体异常(47,XXX)。根据Bromley 等[13]的研究,21-三体胎儿也会出现 CPC,但其出现的频率与一般人群相近,即胎儿出现CPC不会增加21-三体的风险。目前没有相关研究显示胎儿CPC 与性染色体异常有相关性,本研究中出现的1例性染色体异常为偶发。
研究表明,VOUS CNVs 在所有检出病例中占比约为4%[14]。本研究中 CMA 检出 VOUS CNVs 11例,检出率为5.88%,与上述文献报道的结果接近。11例VOUS CNVs中,对病例18 ~26进行来源验证可知,其CNVs均来源其父母一方。病例27和28未进行来源验证,经随访婴儿未见明显表型异常。目前对人类基因组的研究和数据库的积累,仍然无法对所有CNVs的临床性质进行确切的判读。因此,对VOUS病例应进行更详尽的遗传咨询,必要时对胎儿父母进行CMA 来源验证,防止孕妇产生心理负担和造成不必要的引产。
本研究中12例CPC 胎儿的CMA 结果与常规核型分析结果一致,CMA 技术较核型分析技术额外检出16例异常CNVs,额外检出率为8.56%。因此,CMA技术在检测CPC 胎儿染色体异常方面更为敏感,是对传统核型分析技术的有益和必要补充。合并超声结构异常的CPC胎儿pCNVs检出率最高(58.33%),其次为孤立性 CPC 胎儿和合并超声软指标异常CPC胎儿,分别为5.10%和11.11%,3组之间比较的差异有统计学意义(P<0.05)。因此,CMA技术对于CPC 合并超声结构异常的胎儿是值得推荐的。然而由于本研究样本较少,仅额外检测出5个pCNVs。今后笔者将扩大样本量,进行进一步研究。
综上所述,CMA 技术对CPC 胎儿染色体异常具有更高的敏感性,可作为传统染色体核型分析技术的补充,提高对CPC 胎儿异常CNVs 的检出率,为临床医生进行产前遗传咨询和胎儿预后评估提供更详细和更全面的实验依据。
