氮、磷对根瘤菌液处理下甘草根瘤生长及固氮活力的影响
2022-08-08耿业业王桂荣张远帆白钰陈莹朱成豪吴繁琦侯俊玲孙志蓉北京中医药大学中药学院北京102488
耿业业,王桂荣,张远帆,白钰,陈莹,朱成豪,吴繁琦,侯俊玲,孙志蓉(北京中医药大学中药学院,北京 102488)
甘草(Glycyrrhiza uralensisFisch.)是豆科多年生草本植物,以根与根茎入药,具有补脾益气,清热解毒,祛痰止咳,缓急止痛,调和诸药之功效,有“十方九草”“国老”的美誉[1],在医药、食品、化工等领域应用广泛,市场需求量大。目前野生甘草资源逐渐减少,人工栽培甘草成为解决供需矛盾的有效途径。野生甘草具有根瘤固氮特性[2],是甘草植株氮营养的重要来源之一,但人工栽培甘草的水肥措施会减少甘草根部结瘤量[3],质量不及野生甘草[4]。豆科植物氮素来源有土壤供氮、肥料供氮和根瘤固氮三种。根瘤固氮在花生、大豆等豆科经济作物的生长中发挥着重要作用,郑永美等[5]研究表明,花生的根瘤固氮占总氮量的40%以上,最高可达50%。人工甘草栽培过程中接种根瘤菌剂,能提高10%~30%的产量[6]。根瘤菌剂施入土壤后,土壤中营养元素的形态和含量会对豆科植物结瘤固氮的效果产生影响[7],其中氮素和磷素对结瘤影响较大。已有的根瘤固氮研究多集中在大豆、花生、紫花苜蓿等豆科经济作物[8-9]。目前甘草根瘤固氮方面根瘤菌分离鉴定、遗传多样性分析及系统进化分析的研究较多[10],氮素、磷素对甘草结瘤以及固氮活力的影响还不清楚。本文以盆栽甘草为研究对象,考察不同浓度的氮素和磷素对施加根瘤菌剂的甘草结瘤量及根瘤固氮活力的影响,探讨营养元素对甘草根瘤固氮作用的影响,为甘草栽培措施选定提供参考。
1 材料
1.1 试药
甘草种子由中国中药有限公司提供,经北京中医药大学中药学院孙志蓉教授鉴定为豆科植物甘草Glycyrrhiza uralensisFisch.的种子。根瘤菌购自中国普通微生物菌种保藏管理中心,为天山中间根瘤菌(Mesorhizobium tianshanense.),菌株编号“1.2546”。酵母粉(Solarbio)、琼脂粉(北京奥博星生物技术有限责任公司);甘露醇(Beijing Lablead Biotech Co.,Ltd);硫酸铵(福晨化学试剂有限公司);磷酸二氢钾(天津市兴复科技发展有限公司);pH 6.8 磷酸缓冲液(国家化学试剂质检中心);牛血红蛋白(上海源叶生物科技有限公司);甘草酸(批号:P24J10F91300)、甘草苷(批号:Z10J8X39611)对照品(上海源叶生物科技有限公司,均供含量测定用);乙腈和磷酸(Fisher chemical 美国,均为色谱纯);乙醇(北京化工厂,分析纯);用水为娃哈哈纯净水。
1.2 仪器
SQP 型电子分析天平(赛多利斯科学仪器有限公司);立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);超净工作台(上海力辰邦西仪器科技有限公司);HZQ-QX 全温振荡器;BY-R20 医用离心机(北京白洋医疗器械有限公司);UV-2800 型紫外可见分光光度计(舜宇恒平);SP-742D 型高速粉碎机(广州市兆利电器实业有限公司);YCD-EL 260 电热鼓风干燥箱(上海一恒科学仪器有限公司);KQ-500DE 型数控超声清洗器(昆山市超声仪器有限公司);岛津LSM 780 型高效液相色谱仪。
2 方法
2.1 根瘤菌液培养
2.1.1 根瘤菌活化 将配制的YMA 固体培养基[11]放入灭菌锅内灭菌,在超净工作台中趁热分装,每皿25 mL,置于室温凝固,然后均匀涂布菌液,于常温培养箱内活化。
2.1.2 根瘤菌扩繁 将配好的YMA 液体培养基倒入锥形瓶中,每瓶200 mL,放入灭菌锅内灭菌,移至超净工作台中放至室温。将活化后的根瘤菌接至液体培养基中,在25℃、170 r·min-1摇床培养,当620 nm 下检测吸光度达0.6 时即得到根瘤菌液。
2.2 材料培养
采用圆形塑料盆(33 cm×22 cm×31 cm),每盆装混匀的河沙15 kg。课题组前期在探索根瘤固氮对甘草根部氮营养吸收的影响时,每盆施加了1.5 g 硫酸铵,结果表明此用量下甘草根瘤固氮占比高于土壤供氮占比,肥料供氮最低,说明在此用量下甘草可以正常结瘤固氮,据此设置低、中、高三个水平探索不同氮素水平对甘草根瘤生长及固氮活力的影响,1.5 g 硫酸铵换算得0.32 g N,以0.32 g 为N2 水平,其0.5 倍量为N1 水平,1.5 倍量为N3 水平;磷素用量参考金燕清[12]的“3414”试验,促进一年生甘草生物量和甘草酸、甘草苷含量积累的磷(P2O5)用量为9 g·m-2、18 g·m-2,花盆中装填基质表层直径测量为28 cm,根据圆形面积公式计算表面积,得到对应每盆施加P2O5量为0.54 g、1.08 g,以0.54 g 为P1水平,1.08 g 为P3 水平,P2 水平为P1 和P3 水平的均值。另设不加氮素及磷素的对照组(即0 水平组),不同水平氮素和磷素每盆施肥量见表1。在播种前,每盆施入对应量的硫酸铵和磷酸二氢钾,每盆再施入根瘤菌液90 mL,甘草种子处理后在根瘤菌液中浸泡30 min,于2021年4月25日播种,各重复3 次。当幼苗长至5 ~6 片真叶时间苗,每盆留苗10 株,于甘草出苗后每隔两周浇灌1000 mL Hogland 营养液(氮素处理去除氮,磷素处理去除磷),常规管理。

表1 氮素和磷素的水平Tab 1 N and P level
2.3 生长指标测定
于9月25日取样,将根部冲净,用滤纸吸干水分,测定根长、芦头下1 cm 粗度、根鲜重,结瘤数、根瘤鲜重,平行6 次。
2.4 豆血红蛋白含量测定
精密称取120.0 mg 牛血红蛋白,用去离子水溶解并移至10 mL 量瓶定容至刻度,配制成质量浓度为12.0 mg·mL-1的标准蛋白溶液。按照表2添加试剂,混合反应后,在540 nm 波长下测定吸光值,建立标准曲线。

表2 牛血红蛋白标准曲线制作方法Tab 2 Method for making standard curve of bovine hemoglobin
取0.2 g 的新鲜根瘤,用去离子水洗净,滤纸吸干后,加入5 mL pH 6.8 的磷酸缓冲液,在4℃的条件下研磨成匀浆,置于冷冻离心机中4℃、3000 r·min-1离心15 min,吸取上清液,4 ℃、10 000 r·min-1离心20 min,吸取上清液,紫外分光光度计下于540 nm 处测定吸光度,以pH 6.8的磷酸缓冲液作为空白对照,平行测定3 次。
2.5 甘草酸和甘草苷含量测定
2.5.1 甘草供试品溶液的制备 取甘草样品粉末(干燥,粉碎过40 目筛)约0.1 g,精密称定,置于50 mL 量瓶中,加入10 mL 70%乙醇,称重,密塞,100 Hz,40℃超声提取30 min,冷却至室温,用70%乙醇补足损失重量,摇匀,过滤,取续滤液过0.45 μm 微孔滤膜备用,即为供试品溶液。
2.5.2 对照品溶液的制备 精密称取1.94 mg 甘草酸、2.85 mg 甘草苷置于10 mL 量瓶中,用70%乙醇溶解并定容至刻度,摇匀,即得甘草酸质量浓度为0.194 mg·mL-1,甘草苷质量浓度为0.285 mg·mL-1的对照品储备液,各取2 mL 于10 mL 量瓶中,用70%乙醇溶解并定容至刻度,摇匀,得到混合对照品溶液。
2.5.3 测定条件 参照文献[13]的方法,以Diamonsil-C18(250 mm×4.6 mm,5 μm)为色谱柱,乙腈-磷酸水为流动相,流速0.6 mL·min-1,柱温30 ℃,按表3中的洗脱程序进行梯度洗脱,进样量为10 μL,于237 nm 下检测。

表3 流动相梯度条件Tab 3 Gradient elution
2.6 数据统计与分析
采用Excel 2019 软件进行数据处理,SPSS 25.0 软件进行统计分析。用S-N-K 法进行差异显著性分析。
3 结果与分析
3.1 氮素和磷素对甘草根系生长的影响
不同水平氮素、磷素处理下甘草的根长、根粗、根鲜重(不含根瘤,下同)测定结果见图1。随着氮、磷水平的增加,甘草各指标呈先升后降的趋势,处理组根鲜重显著高于对照组,各水平中以N2、P2处理各指标最高。N2 根长34 cm、根粗8.06 mm、根鲜重4.13 g,分别为对照组的1.25 倍、2.01 倍和4.73 倍;P2 根长33.6 cm、根粗7.24 mm、根鲜重4.11 g,分别为对照组的1.17 倍、1.85 倍和4.07 倍。

图1 氮、磷对甘草根系生长指标的影响Fig 1 Effect of N and P on roots growth indexes of Glycyrrhiza uralensis Fisch.
3.2 氮素和磷素对甘草结瘤量的影响
不同水平氮素、磷素处理下甘草的根瘤单重测定结果见图2。随着氮素、磷素水平的增加,根瘤单重呈先升后降的趋势,氮素各水平中以N1 处理组最高,根瘤单重0.05 g,为对照组的4.49 倍,N2、N3 处理组高于对照组,但N3 与对照组的差异无统计学意义;磷素各水平(P1、P2、P3)均显著高于对照组,其中P1 处理最高,根瘤单重0.04 g,为对照的5.43 倍。
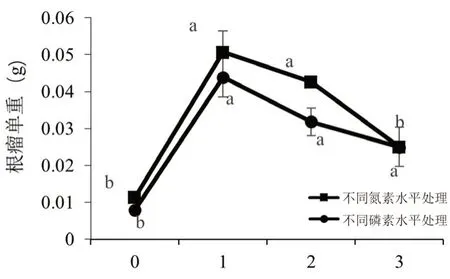
图2 氮磷对甘草根瘤单重的影响Fig 2 Effect of N and P on the weight of single nodule of Glycyrrhiza uralensis Fisch.
不同水平氮素、磷素处理下甘草的单株结瘤数量测定结果见图3。随着氮素、磷素水平的增加,单株结瘤数呈先升后降趋势,氮素各水平中以N2 处理最高,单株结瘤18 个,为对照组的5.35 倍,N1、N3 处理与对照组的差异无统计学意义;磷素各水平中以P2 处理最高,单株结瘤9 个,为对照组的2.14倍,P1、P3 处理与对照组的差异无统计学意义。

图3 氮磷对甘草单株结瘤数的影响Fig 3 Effect of N and P on the number of nodulations of Glycyrrhiza uralensis Fisch. per plant
3.3 氮素和磷素对甘草根瘤豆血红蛋白含量的影响
按“2.4”项下方法,以标准溶液中的牛血红蛋白质量(mg)为横坐标,以540 nm 下吸光度值为纵坐标绘制标准曲线,得线性回归方程:Y=0.1459X-0.0097(R2=0.9994),牛血红蛋白在0 ~3.6 mg 内与吸光度线性关系良好。
将不同氮素、磷素用量下测定的甘草根瘤的豆血红蛋白吸光度带入回归方程,得到对应的豆血红蛋白含量,结果见图4。随着氮素水平的升高,根瘤中豆血红蛋白含量呈先升后降趋势,N2 处理组最高,豆血红蛋白含量18.84 mg·g-1,为对照组的1.96 倍,N2、N3 处理与对照组差异无统计学意义;随磷肥水平的增加,根瘤中豆血红蛋白含量呈下降趋势,P2、P3 处理显著低于对照组。

图4 氮磷对甘草根瘤豆血红蛋白含量的影响Fig 4 Effect of N and P on hemoglobin content of nodules of Glycyrrhiza uralensis Fisch.
3.4 氮素和磷素对甘草酸和甘草苷含量的影响
取“2.5.2”项下混合对照品溶液,稀释成系列浓度,以峰面积为纵坐标(Y),以各对照品中甘草酸、甘草苷含量为橫坐标(X)绘制标准曲线,得到线性回归方程:甘草酸:Y=9.542×106X+1.422×104(R2=1.000),线性范围:0.001 94 ~0.031 04 mg·mL-1,甘草苷:Y=3.199×107X-3.511×103(R2=1.000),线性范围:0.002 85 ~0.0456 mg·mL-1。
不同水平氮素、磷素处理下甘草的甘草酸、甘草苷测定结果见图5。随着氮素浓度的升高,甘草酸、甘草苷含量呈先升后降趋势,N1、N2、N3 均显著高于对照组,其中N2 处理组最高,甘草酸含量为2.99 mg·g-1,甘草苷含量为1.27 mg·g-1,分别为对照组的7.77 倍、5.62 倍;随着磷素浓度的升高,甘草酸、甘草苷含量呈上升趋势,P1、P2、P3 均显著高于对照组,其中P3处理最高,但与P2 处理相比差异无统计学意义,甘草酸含量为2.19 mg·g-1,甘草苷含量为0.90 mg·g-1,分别为对照组的2.24 倍、2.64 倍。

图5 氮素(A)及磷素(B)对甘草中甘草酸、甘草苷含量的影响Fig 5 Effect of N(A)and P(B)on the content of glycyrrhizic acid and liquiritin in Glycyrrhiza uralensis Fisch.
4 讨论与结论
根瘤固氮为豆科植物提供生长所需氮素,豆科植物为根瘤菌提供碳源,两者互利共生。1947年Virtanen 证明了含有豆血红蛋白的根瘤具有固氮能力[14],近年来有研究[15-16]以乙炔还原法测定根瘤固氮酶活性,然后测定该根瘤中豆血红蛋白含量,研究结果表明不同植物和不同部位个体瘤中,瘤体的固氮酶活性与豆血红蛋白含量均成正相关。研究表明外源因素处理通过改变根瘤中豆血红蛋白含量来改变固氮酶活性[17-18],因此本文以根瘤中豆血红蛋白含量评价根瘤固氮活力,豆血红蛋白含量越高,结瘤数目越多,说明根瘤固氮能力越强。
在不外施根瘤菌剂的条件下,随着氮素浓度的增加,大豆、花生的生物量、结瘤量和固氮活性呈先上升后下降的单峰变化趋势[19-21],在伴施根瘤菌剂的基础上,紫花苜蓿的生物量、结瘤数量和根瘤重随氮肥施用量的增加先上升后下降[22],说明外源施加根瘤菌不会改变氮素浓度对豆科植物的生长和结瘤趋势,但根瘤菌对氮素、磷素敏感,高浓度的氮素、磷素会抑制结瘤[23],所以在外源施加根瘤菌液,增强植株固氮能力的同时,选择适合根瘤菌存活及侵染的氮素、磷素浓度至关重要。本文在施加根瘤菌液的基础上,施用不同水平的氮素、磷素,发现在施加根瘤菌剂的基础上,施用氮素、磷素能够促进甘草根部生物量积累,提高根部结瘤数量,增加根瘤单重,以N2、P2 处理组最好,说明适量氮素、磷素会为甘草植株生长提供养分,促进甘草生长,进而为根瘤提供养分,促进结瘤。豆血红蛋白中血红素的部分由根瘤菌合成,而球蛋白的部分则是由寄主(豆科植物)所合成[24],在本试验条件下,豆血红蛋白含量随氮素施用水平的增加先升后降,与甘草生物量和根瘤数目的变化趋势一致;随磷素施用水平的增加而下降,可能与磷素降低植株根部全铁含量有关[25]。随氮素、磷素水平的增加,甘草酸、甘草苷含量呈上升趋势,说明在试验条件下的氮素、磷素浓度不会抑制甘草酸、甘草苷的积累。基于本研究结果,可以为后续研究甘草施加根瘤菌剂与肥料提供参考,优选施肥用量,既能节省成本,又能提高甘草固氮能力,促进甘草生长和活性成分积累。
综上所述,在试验条件下,甘草生物量、根瘤单重和结瘤数目随氮素、磷素施用水平的增加先上升后下降,豆血红蛋白含量、甘草酸和甘草苷含量随氮素施用水平的增加先上升后下降,随磷素施用水平的增加豆血红蛋白含量呈下降的趋势,甘草酸和甘草苷含量呈上升的趋势。在施加根瘤菌剂基础上,每15 kg 河沙施0.32 g N、0.81 g P2O5有利于甘草生物量和活性成分甘草酸、甘草苷的积累,促进结瘤,可为后续研究外源营养对甘草根瘤固氮的影响提供参考。
