细胞焦亡在妇科恶性肿瘤中的研究进展*
2022-08-06徐汉杰张丹娅
徐汉杰,张丹娅,李 飞,魏 睿,周 颖,奚 玲
(华中科技大学同济医学院附属同济医院妇产科,武汉 430030)
细胞死亡方式可分为坏死(necrosis)和程序化细胞死亡(programmed cell death,PCD),后者主要分为凋亡(apotosis)、坏死性凋亡(necroptosis)、自噬(autophagy)和焦亡(pyroptosis)[1]。细胞焦亡不同于凋亡、坏死等其他细胞死亡方式,其最具特征的表现为触发炎症反应,并与炎症性疾病、肿瘤等多种疾病密切相关[1]。随着对细胞焦亡研究的不断深入,其在子宫颈癌、子宫内膜癌和卵巢癌等妇科恶性肿瘤中的相关作用以及抗肿瘤治疗效应也逐渐被发现。本文拟对细胞焦亡在妇科恶性肿瘤发生发展过程中的作用及其抗肿瘤效应进行综述,以期为妇科恶性肿瘤的治疗提供新的策略。
1 细胞焦亡的发现
细胞焦亡(pyrotosis)是希腊语“pyro”(意为fire)和“ptosis”的结合,是一种新定义的炎性程序性细胞死亡[2]。早在1990s,科学家已经发现福氏志贺氏菌或沙门氏菌感染能够引起小鼠或人巨噬细胞的死亡[3-4]。1997年,Arturo Zychlinsky实验室发现,福氏志贺氏菌可激活宿主细胞的caspase-1,2年后,该实验室发现敲除caspase-1可阻断福氏志贺氏菌诱导的细胞死亡[5-6]。2001年,Brad Cookson实验室阐明这种细菌感染引起的细胞死亡方式是一种不同于细胞凋亡的死亡方式,并将此caspase-1依赖的程序化死亡方式命名为细胞焦亡[2]。在细胞焦亡被正式定义之前,人们对细胞焦亡这一复杂通路了解唯一清楚的是caspase-1激活后可活化白细胞介素-1β(interleukin-1β,IL-1β),并引起细胞死亡,而对于引起caspase-1激活的上游通路以及caspase-1激活后引起细胞焦亡的下游通路均不清楚。
2002年,Martinon等首次提出炎症小体(inflammasome)这一概念,他们发现胞内受体核苷酸结合寡聚化结构域样受体蛋白-1(nucleotide-binding oligomerization domain-like receptor family pyrin domain-containing 1,NLRP1)与凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)和caspase-1可组成复合体(即炎症小体),参与caspase激活,此后,不同受体组成的经典炎症小体相继被发现[7]。2015年,邵峰课题组发现gasdermin-D(GSDMD)蛋白在正常微环境处于自抑制状态,经caspase-1剪切后产生N端和C端两个肽段,N端肽段在细胞膜形成质膜孔,至此明确GSDMD蛋白为细胞焦亡的执行蛋白[8]。GSDM家族的其他成员,包括GSDMA、GSDMB、GSDMC、DFNA5/GSDME以及DFNB59,也具有膜穿孔活性,能在细胞膜上形成质膜孔,诱导细胞焦亡的发生,尤其2017年发现caspase-3剪切GSDME诱导细胞焦亡,是细胞焦亡研究的又一里程碑(图1)[9-10]。
2 细胞焦亡的机制
2.1 焦亡的经典途径 细胞焦亡的经典途径由caspase-1炎症小体激活。当细胞感知外源性的病原体或内源性损伤(细菌感染、病毒、毒素等),NOD样受体(NOD-like receptor,NLR)、ASC和caspase-1组成多蛋白复合物(即炎症小体),该炎症小体通过caspase-1的自我剪切激活caspase-1,此步骤为细胞焦亡进程的关键步骤,激活的caspase-1直接剪切GSDMD产生GSDMD-NT(N端片段的GSDMD)和GSDMD-CT(C端片段的GSDMD),前者插入细胞膜脂质形成大小约18nm的质膜孔,该质膜孔致使炎性因子和危险相关分子模式(damage associated molecular patterns,DAMPs)的释放,并导致细胞内渗透压增加,致使细胞肿胀、裂解,杀伤细胞同时扩大免疫炎性反应;激活的caspase-1同时促进IL-1β和白细胞介素-18(interleukin-18,IL-18)的成熟,并通过质膜孔释放到细胞外,发挥免疫调节作用(图2)[11]。
2.2 焦亡的非经典途径 与经典途径不同的是,非经典途径的关键步骤是caspase-4/5/11的激活,此步骤不需要炎症小体而是在脂多糖(lipopolysaccharide,LPS)等炎性因素的刺激下被直接激活,激活的caspase-4/5/11剪切GSDMD,剪切后产生的GSDMD-NT形成质膜孔,致使细胞肿胀、破裂死亡(图2)[11]。有研究提示,caspase-11还可通过非典型炎症小体激活NLRP3,诱导IL-1β和IL-18的成熟[12]。
顺铂、阿霉素等多种化疗药物可激活caspase-3,通过激活的caspase-3剪切GSDME,诱导细胞焦亡的发生(图2)[10]。Caspase-3介导的GSDME焦亡路径并不需要炎症小体,但GSDME-NT的产生可激活经典的炎症小体通路,促进IL-1β和IL-18的成熟、释放[10,13]。由此不难看出,caspase-3并不是细胞凋亡独有的蛋白酶,在GSDME蛋白存在的情况下,caspase-3可诱导细胞凋亡向细胞焦亡转换。
最近有研究表明,颗粒酶也可通过引起特定GSDM家族成员的剪切,诱导细胞焦亡。颗粒酶A(granzyme A,GZMA)、颗粒酶B(granzyme B,GZMB)分别引起GSDMB和GSDME的裂解,剪切后的GSDM蛋白N端,在细胞膜上形成质膜孔,引起细胞焦亡[14-15]。
3 细胞焦亡与妇科恶性肿瘤
细胞焦亡在恶性肿瘤的发生发展过程中扮演着双重角色:一方面,可激活某些信号通路或释放炎性介质促进肿瘤发展以及增加肿瘤对化疗药物的耐药性;另一方面,作为一种程序化细胞死亡方式,诱导肿瘤细胞的死亡,发挥抗肿瘤效应[11]。
3.1 细胞焦亡与子宫颈癌 Zhou等自TCGA和UCSC Xena数据库获得子宫颈癌数据,分析发现黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)、CASP3、GSDMB、GSDMC、GZMB等多种细胞焦亡相关基因在子宫颈癌中高表达。进一步进行生存分析发现,低表达IL-1β和高表达PRKACA患者的预后较好,并鉴定出子宫颈癌细胞焦亡的关键基因GZMB,预测通过GZMB/miR-378a/TRIM52-AS1信号通路促进子宫颈癌的进展,但该研究结果缺乏实验数据验证[16]。
众所周知,高危型HPV持续感染与子宫颈癌的发生发展密切相关。研究证实,HPV E7蛋白可通过促进E3泛素连接酶三结构域蛋白21(TRIM21)介导的γ-干扰素诱导蛋白16 (interferon-gamma inducible protein 16,IFI16)炎症小体的泛素化及降解,抑制细胞焦亡的发生,引起HPV的免疫逃逸,促进子宫颈癌的进展。这一研究结果证实,细胞焦亡参与调控HPV感染免疫逃逸机制[17]。另一方面,AIM2作为分子识别受体识别到HPV dsDNA后,与ASC及caspase-1形成超分子炎症小体,激活细胞焦亡经典途径,诱导焦亡的发生,抑制子宫颈癌进展[18]。HPV感染的子宫颈癌乙酰化酶1 (sirtuin 1,SIRT1)高表达,SIRT1可通过调控核转录因子 NF-κB(nuclear transcription factor-κB,NF-κB)的基因转录功能,干扰AIM2 mRNA的表达,抑制AIM2炎症小体及其介导的细胞焦亡,促进子宫颈癌的进展[19]。
3.2 细胞焦亡与卵巢癌 自GTEx和TCGA数据库获取88个正常卵巢上皮组织以及379个卵巢癌组织的RNA表达数据,分析33个细胞焦亡相关基因的表达,发现31个基因表达具有差异性,PRKACA、GSDMB等13个基因表达下调,caspase-3、GSDMA等18个基因表达上调,进一步通过Cox回归分析,筛选出AIM2、caspase-3以及GSDMA等7个细胞焦亡相关基因,建立卵巢癌预后风险预测模型,结果显示细胞焦亡相关基因在卵巢癌进展过程中发挥重要作用,能够用来预测卵巢癌患者的预后[20]。
caspase-1、IL-1β以及IL-18在卵巢癌组织中的表达明显高于正常卵巢组织[21]。在另一研究中发现长链非编码RNA生长停滞特异性转录本5(long non-coding RNA growth arrest-specific transcript 5,lncRNA GAS5)在卵巢癌细胞中低表达,而高表达lncRNA GAS5诱导炎症小体的形成,继而介导卵巢癌细胞发生焦亡[22]。这些研究结果表明,细胞焦亡与卵巢癌进展密切相关。
3.3 细胞焦亡与子宫内膜癌 Zhang等通过TCGA数据库分析发现,细胞焦亡相关基因ELANE、GPX4、GSDMD及TIRAP参与肿瘤免疫微环境形成,且与子宫内膜癌患者的预后密切相关[23]。已有研究提示,lncRNAs通过细胞焦亡参与子宫内膜癌的进展,并成功鉴别出AC087491.1、 AL353622.1等9个细胞焦亡相关的lncRNAs,据此能预测子宫内膜癌患者的预后及免疫治疗疗效[24]。已有研究结果显示,NLRP3、GSDMD、caspase-1及IL-1β等细胞焦亡相关因子在子宫内膜癌组织中的表达高于正常子宫内膜组织,进一步研究发现,NLRP3、GSDMD、caspase-1表达与子宫内膜癌患者的预后密切相关,提示细胞焦亡参与子宫内膜癌的进展过程[25]。
4 细胞焦亡在妇科恶性肿瘤治疗中的作用
细胞焦亡与妇科恶性肿瘤的发生发展密切相关,且利用其抗肿瘤的作用机制取得了极大进展。在传统手术、放疗、化疗等无法取得满意疗效的情况下,细胞焦亡具有双重抗肿瘤作用:一方面,直接诱导肿瘤细胞死亡;另一方面,肿瘤细胞发生焦亡过程中,释放多种炎性介质、ATP以及肿瘤相关抗原等,诱导机体产生较强的抗肿瘤免疫作用,使其成为治疗恶性肿瘤的有效策略[26]。见表1。
4.1 细胞焦亡在子宫颈癌中的治疗 已有研究表明,顺铂、阿霉素等多种化疗药物,通过激活caspase-3剪切GSDME致使子宫颈癌HeLa细胞焦亡,发挥抗肿瘤效应[10]。第三代铂类抗肿瘤药物洛铂,同样可激活caspase-3,剪切GSDME,促使子宫颈癌细胞发生焦亡[27]。从丹参中提取的丹参酮ⅡA,具有抗炎、抗肿瘤、抗菌等多种生物活性[28]。Tong等研究发现,丹参酮ⅡA可抑制子宫颈癌HeLa细胞的增殖、促进细胞凋亡,进一步研究发现,丹参酮ⅡA可通过调控miR-145/GSDMD信号通路,诱导HeLa细胞发生细胞焦亡,发挥抗肿瘤作用[29]。
4.2 细胞焦亡在卵巢癌中的治疗 α-NETA是一种稳定的、非竞争性的乙酰胆碱转移酶抑制剂,其半抑制浓度IC50为9μmol/L[30]。使用a-NETA 处理Ho8910、A2780等卵巢癌细胞系,发现细胞出现质膜出泡等焦亡特征,且Werstern blot结果显示caspase-4、GSDMD表达升高,而敲除caspase-4或GSDMD能抑制α-NETA诱导卵巢癌发生细胞焦亡的能力,提示α-NETA通过GSDMD/caspase-4通路诱导焦亡,发挥抗肿瘤作用,动物实验也进一步证实了α-NETA对卵巢癌的治疗疗效[31]。Nobiletin 是一种来自柑橘皮的聚甲氧基黄酮。已有大量文献证实,nobiletin具有抗肿瘤、抗氧化等多种生物活性[32]。Liao 等使用nobiletin对A2780、OVCAR3卵巢癌细胞进行处理,处理后的肿瘤细胞发生细胞焦亡现象,继续进行机制研究发现,nobiletin通过诱导活性氧(reactive oxygen species,ROS)的产生及调节细胞自噬,引起GSDMD、GSDME发生剪切,诱导细胞焦亡[33]。蛇床子素(osthole)是一种天然抗组胺药替代试剂,也可通过介导细胞焦亡执行蛋白GSDME,诱导A2780、OVCAR3卵巢癌细胞发生细胞焦亡[34]。
4.3 细胞焦亡在子宫内膜癌中的治疗 已有研究结果显示,在HEC1A 、AN3CA等子宫内膜癌细胞系中,氢可提高细胞内ROS水平,促进NLRP3炎症小体的形成,激活caspase-1,剪切GSDMD蛋白,继而介导细胞焦亡,敲除GSDMD,可抑制氢介导的细胞焦亡,在小鼠子宫内膜癌皮下瘤肿瘤模型也证实氢可诱导子宫内膜癌焦亡,发挥抗肿瘤作用,这一发现为子宫内膜癌的临床治疗提供了新方向[25]。
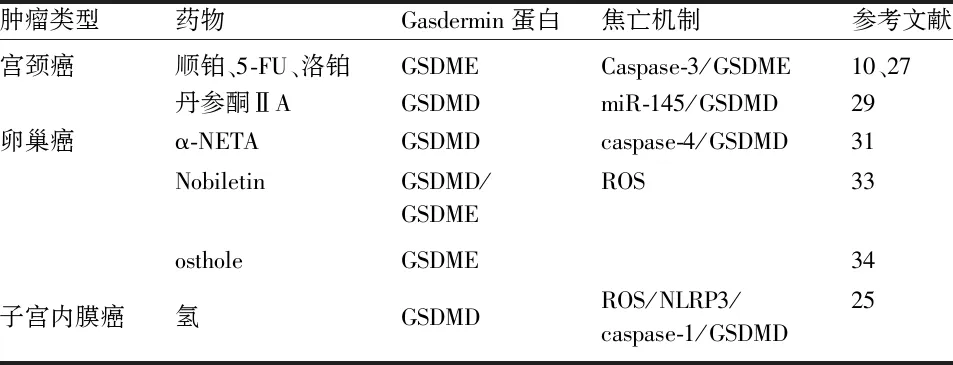
表1 细胞焦亡在妇科恶性肿瘤中的治疗
5 展望
细胞焦亡在妇科肿瘤的发生发展过程中起着重要作用,其对妇科恶性肿瘤的治疗作用也已得到研究证实,未来极有可能被运用到妇科恶性肿瘤的临床治疗中。但此前仍有许多问题亟需解决,如顺铂、阿霉素等常用的化疗药物通过caspase-3/GSDME非经典途径诱导细胞焦亡,发挥抗肿瘤作用,但大部分肿瘤细胞由于DFNA5基因甲基化致使GSDME蛋白表达水平低于正常细胞,以GSDME为焦亡执行蛋白诱导细胞焦亡,可能存在诱导肿瘤细胞焦亡能力弱及较强的化疗副反应等问题,这些都需要我们继续深入研究进行解决。同时,以细胞焦亡相关的炎症小体、caspase家族蛋白、GSDM家族蛋白及相关信号通路为基础,积极寻找可靠有效的治疗靶点,也可为妇科肿瘤的治疗提供新的治疗方法。
细胞焦亡在恶性肿瘤的治疗中具有广泛的应用前景,将给妇科恶性肿瘤的治疗带来突破性的进展,鉴于细胞焦亡的炎性特征,其与免疫检查点抑制剂等其他免疫治疗手段联合应用,也将会为妇科恶性肿瘤的治疗带来更优策略。
