诊断性刮宫诊断子宫内膜不典型增生术后病理升级的相关因素分析*
2022-08-06聂祥琳万一聪马小玲程文俊
钟 艺,袁 琳,张 林,杨 静,聂祥琳,万一聪,马小玲,程文俊
(南京医科大学第一附属医院妇科,南京 210029)
子宫内膜不典型增生(atypical endometrial hyperplasia,AEH)是子宫内膜腺癌(endometrial cancer,EC)的癌前病变[1],临床上主要表现为月经紊乱、不孕、绝经后阴道不规则流血等,可在各年龄层发病[2]。AEH与EC的治疗方案不同,EC患者首选手术治疗,标准术式为全子宫+双附件切除+必要时淋巴结切除术[3-4]。AEH的患者通常更为年轻,有更多的机会选择药物保守治疗或创伤较小的手术治疗方案[5],术前对AEH进行病理诊断的准确性十分关键。病理诊断依赖子宫内膜的全面活检,目前临床上常用的内膜活检方法包括诊断性刮宫术、宫腔镜检查、微量子宫内膜取样等多种方案。诊断性刮宫术具有一定的漏诊率[6],但操作简单,且无须特殊设备支持,因此仍是获取子宫内膜病理样本最常用的方法,特别是在基层医院,其应用更加广泛。因此,探讨诊断性刮宫术后病理升级的危险因素仍具有一定的临床价值。经阴道超声检查是一种无创且便捷的检查,常作为子宫内膜病变的首选方法[7]。通过分析患者的临床特征及超声特点来预测病理升级是一种较为方便、经济的方法。对病理升级风险高的患者进行预测,接受进一步的评估,以制定更合理的治疗方案。本研究通过回顾分析初诊为AEH的患者的临床资料,旨在探讨预测AEH术后病理升级的风险因素。
1 资料与方法
1.1 一般资料 选取2010年1月至2019年12月在江苏省人民医院妇科因AEH初始治疗选择全子宫切除术的104例患者。入选标准:(1)均为诊断性刮宫来获得组织样本,其病理诊断均为AEH;(2)诊断性刮宫术后未接受任何治疗;(3)术前行经阴道彩色多普勒超声检查。排除标准:(1)合并其他生殖道恶性肿瘤;(2)诊断性刮宫术后已行激素治疗者;(3)临床病史及病历资料不完整。
1.2 研究方法 根据术后病理诊断,升级为EC的患者为子宫内膜癌组,仅为AEH的患者为非子宫内膜癌组。比较两组患者的临床基线资料(年龄、月经婚育史、家族史、既往史、绝经状态、内科合并症及BMI),分析两组间经阴道彩色多普勒超声检查结果和病理资料,探索预测AEH术后病理升级的相关影响因素。对患者肥胖评估使用中华人民共和国卫生行业标准——成人体重判定[8]。经阴道超声检查(TV-CDS)由本中心两位经验丰富的超声医师进行判读,结果有争议时,由第三位专家加入进行充分讨论后得出最终结论。超声检查按标准经阴道超声检查流程进行[9],超声采集内膜病灶厚度、宫腔形态、血流信号等指标进行后续分析。

2 结 果
2.1 一般情况 104例患者中,术后病理升级为子宫内膜癌34例(32.69%),未升级70例。104例患者中,32例为绝经患者。患者育次(1.26±0.71)次(0~4次),96例经产,8例不孕。平均BMI(24.96±3.85)kg/m2(14.06~39.90kg/m2)。经阴道B超示平均子宫内膜厚度(1.31±0.64)cm,45例有异常回声,12例有血流信号。合并糖尿病7例,合并高血压30例。104例患者中,行全子宫+双输卵管切除术48例,全子宫+双附件切除术66例,其中有6例同时行淋巴结评估,有2例病理升级为癌后补切淋巴结,均阴性。子宫内膜癌组中高分化癌9例(26.47%),高-中分化13例(38.24%),中分化癌2例(0.06%),低分化0例,分化不详10例(29.41%);Ia期30例(88.24%),其中局限于黏膜内17例(56.67%),浅肌层浸润13例(43.33%),Ib期4例(11.76%),1例Ib期有脉管内癌栓。子宫内膜癌组中,超过I级血流信号的患者仅有20.6%,但87.5%(7/8)超过I级血流信号的患者术后病理合并癌。两组患者在有无肿瘤家族史、孕次、育次、高血压、糖尿病、内膜厚度及是否存在宫腔异常回声团方面比较,差异无统计学意义(P≥0.05);而是否绝经及超过I级血流信号比较,差异有统计学意义(P<0.05)。见表1。

表1 患者临床特点单因素分析
2.2 子宫内膜不典型增生合并子宫内膜癌的多因素分析 多因素logistic回归分析示,患者TV-CDS检查显示血流信号丰富是子宫内膜不典型增生合并内膜癌的高危因素(表2)。
2.3 术前TV-CDS对病灶血供分级评估与术后病理的关系 Ia、Ib期患者血流信号显示率分别为13.33%和75.00%,术前TV-CDS示病灶血供丰富程度与肌层浸润程度呈正相关(r=0.548,P=0.001),见表3。
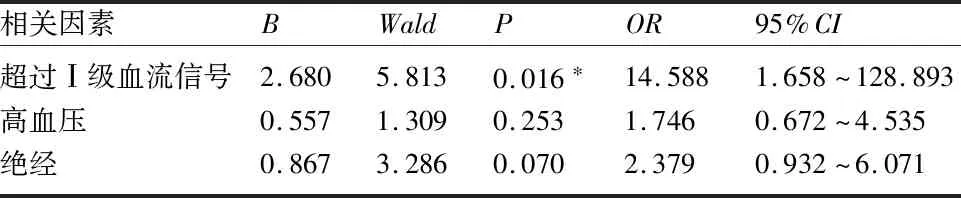
表2 子宫内膜不典型增生合并子宫内膜癌的多因素分析
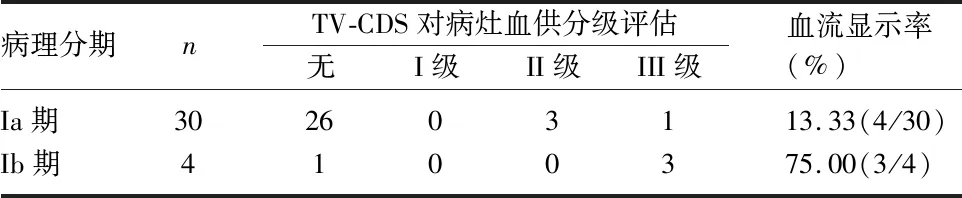
表3 术前TV-CDS对病灶血供分级评估与术后病理的关系
3 讨 论
目前,子宫内膜活检的方法包括子宫内膜取样器、诊断性刮宫及宫腔镜下活检等。杨秋平等[10]研究认为,子宫内膜取样器的取样满意度及诊断准确性与诊断性刮宫相比无明显统计学差异。另有研究表明,微量子宫内膜取样器活检的标本合格率为75.3%,显著低于分段性诊刮(90.5%),该活检方法更适用于年龄较小(<50岁)、子宫内膜较厚(≥5mm)的子宫内膜癌及癌前病变患者的筛查[11]。目前我国对于子宫内膜取样器尚未广泛普及[12],其可行性无足够的大样本数据支持,还需进一步深入研究其临床应用价值。诊断性刮宫是一种方便的子宫内膜取材方式,但由于其取材并不充分,因此可能导致患者术后病理升级。本研究发现,诊断性刮宫与最终病理诊断符合率为67.3%,与以往研究结果相似[3]。王迪等[13]对纳入的11篇RCT进行meta分析发现,宫腔镜诊刮组AEH及EC诊断率均高于传统诊刮组,同时发现引入宫腔镜检查后,EC术后腹水细胞学阳性率高于传统诊刮组。早期子宫内膜癌多呈局部灶性分布,位于宫角的小病灶刮取困难。对于取材困难的患者,由高年资、操作熟练者进行取样,可提高准确性[14]。此外,本研究表明AEH病理升级的患者全部为I期子宫内膜样癌,这与Rajadurai等[15]报道相似。这表明AEH是子宫内膜样癌的癌前病变,而不是其他病理类型,这提示子宫内膜腺癌与其他病理类型的子宫内膜癌具有不同的起源及发病机制。
AEH是EC的癌前病变,由子宫内膜增生发展到癌是一个连续的病理过程。AEH进展到EC时间较长,并发肿瘤的患者年龄可能更高,年龄是子宫内膜癌的危险因素[6,16],但是研究所得出的年龄最佳界值却不一致。任王静、李玲等[2,14]研究显示,年龄并不是子宫内膜不典型增生术后病理为子宫内膜癌的危险因素。研究[2,14]认为,绝经是AEH术后病理升级的危险因素。虽然绝经在多变量模型中无统计学意义,但其P值接近0.05,这可能由于本中心样本量较小导致未达到统计学差异。肥胖、高血压和糖尿病称为子宫内膜癌三联征[17],但本研究中肥胖、糖尿病和高血压不是AEH合并癌症的危险因素,这可能是由于本研究中合并有肥胖、高血压及糖尿病的患者较少,整体样本量偏小有关。
既往研究表明,子宫内膜厚度是并发癌的独立危险因素[6]。张莹等[6]研究认为,子宫内膜厚度在鉴别子宫内膜增生和EC上差异无统计学意义,子宫内膜回声改变伴血流信号增加是EC区别于子宫内膜增生的特征性表现。本研究同样认为,子宫内膜厚度与AEH术后病理升级无关。这可能是因本研究术前病理为AEH而非其他良性子宫内膜病变,导致两组间的子宫内膜厚度无显著差异。由此可见,仅凭子宫内膜厚度来预测术后合并癌存在一定局限性,应配合超声的血流信号或异常回声加以判断。子宫内膜癌的内膜血流信号检出率明显高于非子宫内膜癌患者,但检出率波动较大[7,18],原因可能是仪器、技术或对异常血流定义的不同。AEH患者的超声提示血流信号较丰富时,升级为EC的风险增加,应谨慎处理。本研究发现,子宫内膜癌血流信号丰富程度与肌层浸润程度相关,肌层浸润越深,血供越丰富,这与既往的研究一致[19]。
本研究纳入的样本均为接受诊断性刮宫术后的患者,TV-CDS提示超过I级血流信号是病理升级的风险因素,本结果可能对诊刮术后的患者具有价值,如果进一步将本结论外推,如宫腔镜取样的患者,则需慎重。此外,本研究为单中心回顾性研究,可能存在选择偏倚的固有风险;样本量较小,可能会因有效性不足而导致第二类统计误差。
总之,对于诊断性刮宫诊断为AEH,超声提示超过I级血流信号的患者,应充分考虑存在病理升级的可能性。
