间充质干细胞外囊泡中microRNA-4488通过靶向ABHD8抑制卵巢癌进展*
2022-08-06周俊英张伟卫董世亮
周俊英,常 蕾,张伟卫,董世亮,秦 波
(郑州大学第一附属医院 a.妇产科;b.放射治疗部;c.医学转化中心,郑州 450052)
卵巢癌是威胁全球女性健康的生殖系统恶性肿瘤,具有很高的死亡率和复发率[1]。卵巢癌引起的死亡占女性癌症死亡人数的5%[2]。手术和化疗等治疗手段可提高患者的生存率,但其5年生存率仍保持在45%[3]。由于缺乏有效的检测和治疗策略,卵巢癌患者通常在晚期被诊断出,并常出现预后不良相关的转移[4-5]。因此,探究卵巢癌转移的机制及相关靶点,对卵巢癌患者的早期诊断和治疗具有重要的意义[6]。近年来,细胞外囊泡(extracellular vesicle,EV)在卵巢癌中的研究得到广泛关注。研究报道,间充质干细胞(mesenchymal stem cell,MSC)在卵巢癌的侵袭中发挥抑制作用[7]。有研究表明,MSC能产生EVs,通过旁分泌活动修复受损组织[8]。此外,MSC可作为肿瘤靶向治疗的基因递送载体,这种修饰的MSC已用于不同的肿瘤类型模型,如乳腺癌[9]。外泌体是纳米大小的细胞外囊泡,可被大多数细胞分泌[10]。外泌体含各种功能性小RNA、mRNA和功能蛋白,可传递特定的分子信息,改变受体细胞的生物学功能[11]。研究表明,乳腺癌血清中外泌体miR-4488可促进其转移[12]。本研究发现,含α/β-水解酶结构域8(α/β-hydrolase domain-containing 8,ABHD8)是miR-4488的下游靶标。既往有研究表明,卵巢癌中ABHD8表达升高[13],但具体作用机制尚不清楚。本研究深入探究了MSCs-EVs通过分泌miR-4488下调ABHD8调控卵巢癌细胞的作用机制,为卵巢癌的临床治疗提供新思路。
1 材料与方法
1.1 资料来源 选取郑州大学第一附属医院病理科于2015至2016年间存档的石蜡样本,其中60例卵巢癌组织,40例正常卵巢组织(来源于靠近卵巢囊肿或浆液性囊腺瘤的正常卵巢组织)。卵巢癌患者严格按美国国家综合癌症网络(NCCN)卵巢癌指南进行手术治疗。患者术前均未接受化疗或放疗。本研究经医院伦理委员会批准,获得了患者的书面知情同意书。动物实验按《实验动物护理和使用指南》中的建议进行,动物实验方案经医院机构动物护理和使用委员会批准。
1.2 生物信息学分析 ABHD8的正向miRNA由TargetScan数据库(http://www.targetscan.org/vert_71/)、miRDB数据库(http://mirdb.org/index.html)和miRSearch数据库(https://www.exiqon.com/miRSearch)预测。来自间充质干细胞的细胞外囊泡中miRNA的信息通过EV miRNA数据库(http://bioinfo.life.hust.edu.cn/EVmiRNA#!/)获得。
1.3 实验材料 人卵巢癌相关细胞系Caov-3、SKOV3、OVCAR-3和人卵巢表面上皮细胞系IOSE-80购自American Type Culture Collection Cell Bank(美国)。6~8周龄健康雌性裸鼠购自维通利华(中国,武汉)。RPMI 1640培养基、0.25%胰蛋白酶-EDTA、胎牛血清购自Gibco公司(美国,纽约)。质粒(pcDNA3.1-ABHD8、pLKO.1-shABHD8、pX459-ABHD8-sgRNA)来自美国国家生物技术信息中心(NCBI)。MTT Kit购自Sigma(美国,旧金山),Matrige购自上海翊圣生物科技有限公司(中国,上海)。Trizol购自赛默飞公司(美国,加利福尼亚)。逆转录试剂盒(美国,加利福尼亚)。实时荧光定量试剂盒购自Takara公司(中国,辽宁)。ABHD8抗体(HPA037658,瑞士),Bax抗体(ab32503,Abcam,美国),B-cell lymphoma 2抗体(ab32124,Abcam,美国),Cleaved-caspase 3(ab4051,Abcam,美国),CyclinD1(ab134175,Abcam,美国)和GADPH(ab3716,Abcam,美国)。山羊抗兔IgG抗体二抗(SA00001-2,中国,武汉)。
1.4 实验方法
1.4.1 细胞转染 应用美国国家生物技术信息中心(NCBI)的ABHD8和miR-4488序列构建过表达质粒(pcDNA3.1-ABHD8)、敲低质粒(pLKO.1-shABHD8)和敲除质粒(pX459-ABHD8-sgRNA)。分别用shRNA阴性对照(NC)、pLKO.1-shABHD8,NC-mimic、miR-4488模拟物、NC-抑制剂、miR-4488抑制剂,pcDNA 3.1-NC、pcDNA3.1-ABHD8、pLKO.1-shABHD8、pX459-ABHD8-sgRNA,EVs-miR-4488、EVs-NC模拟物、二甲基亚砜(DMSO)和GW4869抑制剂(EVs抑制)质粒转染细胞。
1.4.2 双荧光素酶报告分析 利用生物信息学预测网站(http://www.rna-society.org/raid/index.html和http://www.microrna.org/microrna/home)对ABHD8和miR-4488的靶基因进行预测分析。
1.4.3 3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide(MTT)测定 收集转染后呈对数生长的卵巢癌细胞,分离成细胞悬液,调整至4×103细胞/孔。将各实验组的预混细胞(50μL)接种至96孔板,在37℃、5%CO2培养箱中培养。根据购买说明书,使用MTT连续2天测量细胞增殖情况。
1.4.4 Transwell试验 转染后细胞在无血清培养基中饥饿24h后分离,用1×PBS洗涤3次,用含10g/L牛血清白蛋白的Opti-MEM重悬,将细胞密度调整为2.5×104细胞/mL。将Transwell小室置于24孔板,Transwell小室底膜的上室表面加1∶8稀释的Matrigel(0111ES08,Yeasen Biotech Co.,Ltd,Shanghai,China),孵育1h使其凝固。常规消化后,细胞用1×PBS洗涤两次,重悬于RPMI 1640培养基中并调整细胞密度为1×105细胞/mL。将细胞悬液(100μL)加入带有Matrigel凝胶的Transwell小室的上室,同时下室中加600μL含20%胎牛血清(FBS)的RPMI 1640培养基,37℃、5%CO2培养箱中培养24h。取出Transwell小室,用棉签擦拭上室内侧的细胞,用4%多聚甲醛固定15min,用甲醇制成配制的0.5%结晶紫溶液染色15min,用PBS洗涤3次。倒置显微镜下随机选择5个视野进行拍摄。计数跨膜细胞,重复3次取平均值。
1.4.5 划痕实验 收集转染后的卵巢癌细胞和人卵巢表面上皮细胞,按1×105细胞/孔接种于6孔板。当细胞汇合度达到90%时,使用200μL无菌枪头在每孔底部均匀划4道横竖划痕。除去原培养液,每孔加2mL含10%血清的培养液,置于培养箱。倒置显微镜下,于0h和24h拍摄照片。每个样品取5个视野中细胞计数的平均值,并测量多个划痕点的宽度,计算各组的划痕愈合率[(0h处的划痕宽度-24h处的划痕宽度)/0h处的划痕宽度×100%]。重复3次取平均值,比较各组细胞迁移能力。
1.4.6 流式细胞术 转染48h后用2mL PBS溶液轻轻冲洗培养皿中的细胞,并用0.5mL 0.25%胰蛋白酶消化,直至在显微镜下观察到细胞开始从培养皿壁上脱落。连续吹打至细胞完全脱落。将细胞轻轻重悬于培养基,调整细胞密度约为1×106细胞/mL。将细胞悬液(0.5mL)转移至干净的离心管。将细胞染色,用0.5mL预冷的1×结合缓冲液重新悬浮,加5μL膜联蛋白V-异硫氰酸荧光素(FITC)和10μL碘化丙啶(PI),避光条件下孵育15min。随后,通过流式细胞仪对细胞进行测定和分析。
1.4.7 逆转录定量聚合酶链反应(RT-qPCR) 转染24h后,用Trizol提取总RNA。ABHD8和miR-4488引物由Invitrogen公司设计合成。将RNA逆转录成cDNA。以GAPDH和U6为内参,使用qPCR试剂盒检测。最终数据采用2-ΔΔCt法进行分析。
1.4.8 细胞外囊泡的制备与鉴定 卵巢癌细胞Caov-3培养后,用无血清培养基洗涤细胞并用无血清培养基孵育24h。在去除培养基的同时,通过四次离心(360g 10min,2000g 10min,10000g 30min和1000000g 70min)培养上清。将分离出的细胞外囊泡用50μL PBS重悬,-80℃保存。二辛可宁酸(BCA)方法用于测量细胞外囊泡的蛋白质含量,在10%十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶上分离10μg EV蛋白质。蛋白印记分析方法验证CD63蛋白表达。按制造商的说明制备EV透射电子显微镜(TEM)样品并观察。
1.4.9 蛋白印迹分析 提取细胞总蛋白并用BCA蛋白浓度测定试剂盒测定蛋白浓度。共用40μg蛋白上样量,用10%SDS-聚丙烯酰胺凝胶电泳分离,转移至聚偏二氟乙烯(PVDF)膜,室温下用含5% BSA的Tween 20(TBST)溶液封闭。分别用稀释的抗体ABHD8(1∶200),Bax(1∶2000),B-cell lymphoma 2(Bcl-2)(1∶2000),Cleaved-caspase 3(1∶100),CyclinD1(1∶2000)和GADPH(1∶3000)在4℃孵育过夜。用山羊抗兔IgG抗体二抗(1∶5000)在室温下重新孵育2h,用TBST洗涤三次后,通过增强化学发光(ECL)显影。
1.4.10 RNA pull down实验 用生物素标记的miR-4488(每个50nmol/L)处理野生型(WT)-ABHD8和突变型(MUT)-ABHD8转染的卵巢癌细胞。转染48h后,收集的细胞用PBS洗涤并用特定的细胞裂解液裂解10min。共分装50mL样品细胞裂解液。将残留的裂解物与M-280链霉亲和素磁珠预包被的无RNase和酵母tRNA在4℃下孵育3h,用冷裂解液洗涤两次,用低盐缓冲液洗涤3次,用高盐缓冲液洗涤一次。以拮抗剂ABHD8探针为阴性对照组。Trizol提取总RNA,RT-qPCR检测miR-4488表达。
1.4.11 裸鼠异种移植瘤 共使用24只6~8周龄健康雌性裸鼠分别饲养在无特定病原体(SPF)动物实验室的笼子中(湿度60%~65%,温度22~25℃)。在12h光照和12h黑暗循环下为裸鼠提供食物和水。实验在适应性喂养后1周开始。实验前观察裸鼠健康状况。裸鼠皮下注射构建的载体-NC、ABHD8-载体、sh-ABHD8和sh-NC(1×109pfu/100μL)质粒。为了研究MSC-EV-miR-4488对裸鼠肿瘤形成的影响,皮下注射EV-NC模拟物和EV-miR-4488模拟物。喂养6周后,将小鼠安乐死,并测量肿瘤的大小和重量。

2 结 果
2.1 ABHD8、miR-4488在卵巢癌组织和细胞中的表达 免疫组化检测结果表明,卵巢癌组织中ABHD8阳性表达率高于正常卵巢组织(图1A、B)(P<0.05)。RT-qPCR检测发现,与正常卵巢组织相比,卵巢癌组织中ABHD8呈高表达,而miR-4488呈低表达(图1C)(P<0.05)。RT-qPCR测定结果显示,人正常卵巢上皮细胞IOSE-80及卵巢癌细胞系Caov-3、SKOV3和OVCAR-3中,ABHD8表达上调,miR-4488表达下调(图1D)。
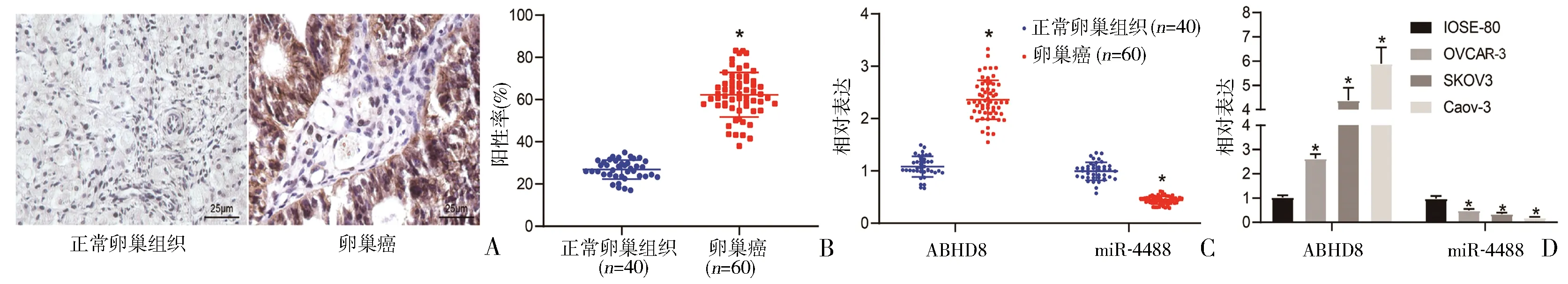
图1 ABHD8、miR-4488在卵巢癌组织和细胞中的表达A、B:ABHD8在卵巢癌和正常卵巢组织中的表达(400×);C:RT-qPCR检测ABHD8和miR-4488在卵巢癌和正常卵巢组织中的相对表达;D:RT-qPCR检测ABHD8和miR-4488在卵巢癌细胞系Caov-3、SKOV3和OVCAR-3以及人卵巢表面上皮细胞IOSE-80中的相对表达。*P<0.05
2.2 MSC-EV-miR-4488与ABHD8在卵巢癌中的潜在靶向关系 通过TargetScan等数据库预测调节ABHD8的正向miRNA(图2A)。同时通过EV-miRNA数据库获取MSC-EVs的miRNA信息,由EV-miRNA和预测结果引起的交集只有miR-4488(图2B)。因此,推测MSC-EVs中miR-4488可能参与ABHD8对卵巢癌进展的调控。
2.3 ABHD8对卵巢癌增殖、凋亡、侵袭和转移功能的影响 流式细胞术和MTT结果表明,过表达ABHD8导致Caov-3细胞凋亡降低且增殖能力增强,而敲低ABHD8则出现了相反的趋势(图3A、C)(P<0.05)。Western blot法检测结果显示,过表达ABHD8导致Bax和Cleaved-caspase 3蛋白表达降低,但Bcl-2和Cyclin D1蛋白表达升高,敲低ABHD8则出现了相反的趋势(图3B)(P<0.05)。划痕实验和Transwell实验表明,过表达ABHD8使Caov-3细胞的迁移和侵袭能力增强,而敲低ABHD8质粒则出现相反的趋势(图3D、E)(P<0.05)。表明ABHD8高表达显著增强卵巢癌细胞的增殖、迁移和侵袭能力,并抑制细胞凋亡,进而促进了卵巢癌的进展。
2.4 MSC-EV-miR-4488靶向ABHD8并抑制其表达 通过软件分析,ABHD8基因与miR-4488序列之间存在特异性结合区,即ABHD8是miR-4488的靶向RNA(图4B)。TEM检测表明,球形EVs是从MSC-EVs中分离出来的,并且蛋白质印迹分析证实了MSC-EVs中存在跨膜蛋白(CD63),且不表达Calnexin,表明EV被成功提取出(图4A)。同时转染miR-4488模拟物的Caov-3细胞较对照(转染了NC模拟质粒)细胞,miR-4488表达显著升高而ABHD8表达显著降低(P<0.01)(图4C),进一步表明miR-4488可调控ABHD8在卵巢癌细胞上的表达。双荧光素酶报告基因实验检测发现,MSC-EV-miR-4488能与ABHD8结合,但不能与ABHD8-MUT结合(图4D)。以上结果表明MSC-EV-miR-4488可能通过竞争性地与ABDH8结合,调控其表达。
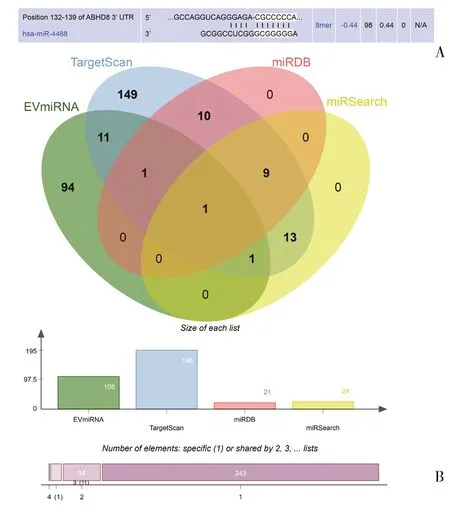
图2 MSC-EV-miR-4488特异性靶向卵巢癌中的ABHD8A:ABHD8和miR-4488的结合位点;B:数据库预测结果与EV-miRNA的交集(椭圆:一个数据库的预测结果;中间部分:四组数据的交集)
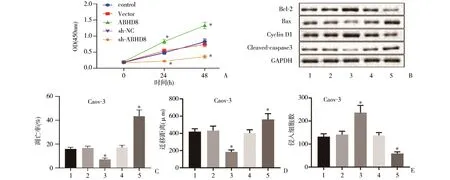
图3 ABHD8下调抑制卵巢癌细胞增殖、侵袭和迁移,促进其凋亡A:MTT法检测Caov-3细胞0、24h和48h OD值;B:Western blot法检测Bax,Cleaved-caspase 3,Bcl-2和Cyclin D1表达;C:流式细胞术检测不同质粒转染Caov-3细胞的凋亡情况;D、E:Transwell实验检测Caov-3细胞迁移和侵袭情况(400×);1:control;2:Vector;3:ABHD8;4:sh-NC;5:sh-ABHD8;*P<0.05
2.5 MSC-EV-miR-4488通过靶向ABHD8来抑制卵巢癌细胞的增殖、迁移和侵袭 流式细胞术和MTT试验表明,Caov-3细胞中高表达miR-4488(转染miR-4488 mimic或miR-4488-EVs)或敲低ABHD8(转染sh-ABHD8),细胞凋亡增加,细胞增殖降低。相反,使用miR-4488抑制剂或外泌体抑制剂(GW4869)则导致相反的趋势(P<0.05)(图5A、C)。蛋白印记实验也表明,miR-4488过表达或敲低ABHD8调控了凋亡相关的蛋白表达水平(图5B)。划痕试验和Transwell表明,Caov-3细胞中高表达miR-4488或敲低ABHD8降低细胞迁移和侵袭能力(图5D、E)。MSC-EV-miR-4488靶向ABHD8,介导的卵巢癌增殖、凋亡、侵袭和转移功能。
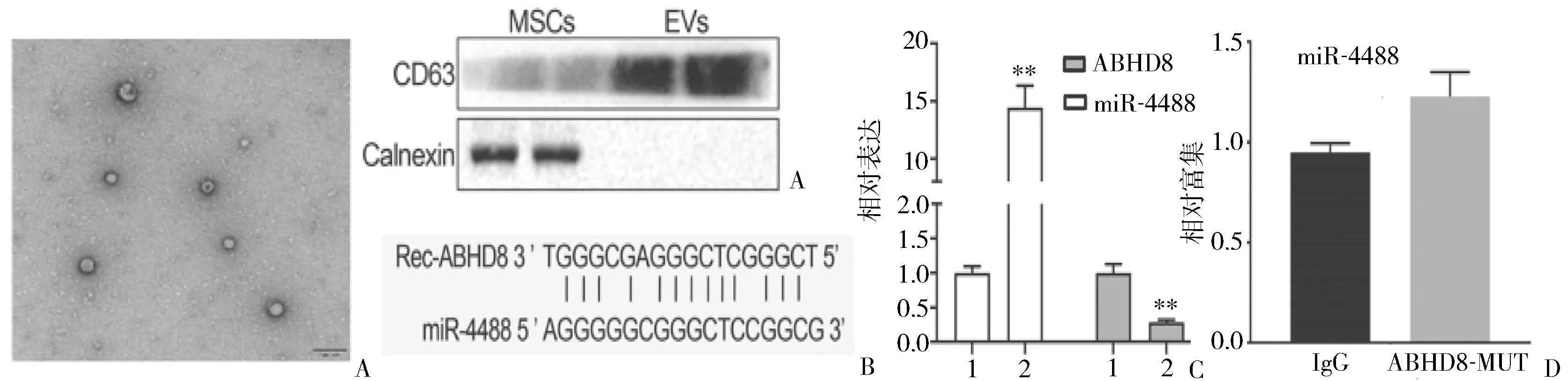
图4 MSC-EV-miR-4488与ABHD8相互作用A:由TEM确定球形EV与MSC-EV的分离以及通过蛋白质印迹分析测试的MSC-EV中CD63和Calnexin的存在;B:在线软件预测的ABHD8和miR-4488的结合位点;C:转染miR-4488-mimic后Caov-3细胞中miR-4488和ABHD8表达;D:双荧光素酶报告基因实验检测到EVs-miR-4488与ABHD8、ABHD8-MUT的结合;1:NC mimic;2:miR-4488 mimic;**P<0.01
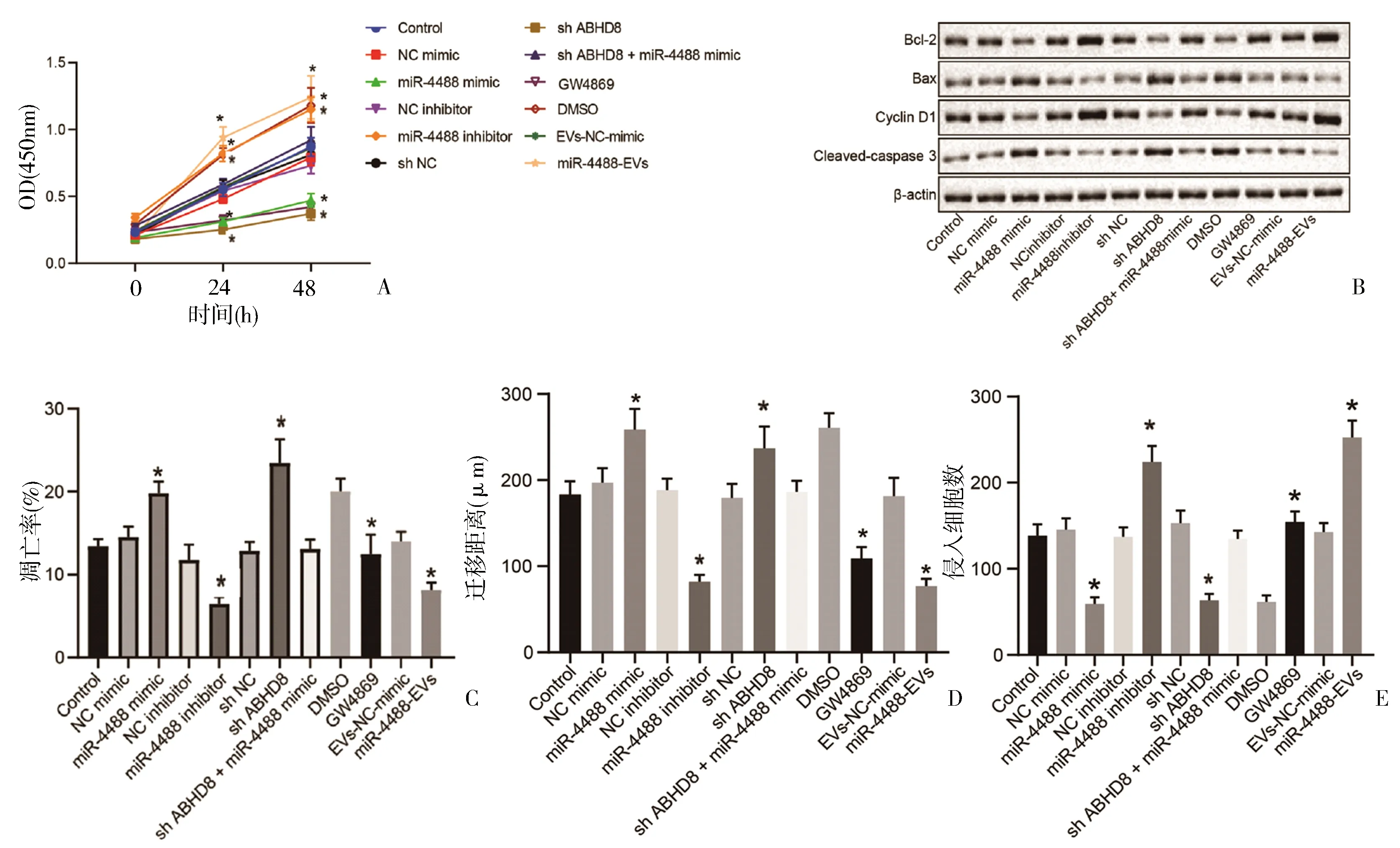
图5 MSC-EV-miR-4488通过特异性靶向卵巢癌中的ABHD8抑制癌细胞增殖并促进细胞凋亡、抑制细胞侵袭和迁移A:MTT法测量Caov-3细胞在0h、24h和48h时的OD值;B:Western blot检测不同质粒转染的Caov-3细胞中Bcl-2、Cyclin D1、Cleaved-caspase 3和Bax蛋白表达;C:流式细胞术检测不同质粒转染Caov-3细胞的凋亡情况;D:划痕愈合试验检测转染不同质粒的Caov-3细胞的迁移;E:Transwell实验检测不同质粒转染的Caov-3细胞的侵袭。*P<0.05,实验重复3次
2.6 MSC-EV-miR-4488通过下调ABHD8抑制体内卵巢癌细胞的肿瘤进展 与sh-NC组相比,敲低ABHD8组小鼠肿瘤生长速度和肿瘤重量均有所下降,但miR-4488表达无变化(图6);与vector对照组相比,过表达ABHD8的小鼠皮下肿瘤生长速度加快,肿瘤重量增加;对小鼠进行EVs注射处理后,与注射EV-NC对照质粒的裸鼠相比,注射EV-miR-4488模拟质粒的裸鼠中miR-4488表达增加而ABHD8表达降低,小鼠的体积和重量均降低(图6)。这些结果表明,降低ABHD8表达可抑制小鼠卵巢癌肿瘤形成,并且MSC-EVs中的miR-4488下调ABHD8表达。
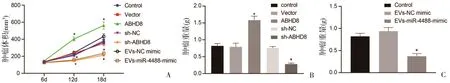
图6 MSC-EV-miR-4488通过下调ABHD8抑制卵巢癌细胞的肿瘤发生A:ABHD8表达和MSC-EV-miR-4488处理后肿瘤的生长曲线;B、C:用ABHD8过表达和MSC-EV-miR-4488治疗后的肿瘤重量;*P<0.05
3 讨 论
EVs作为细胞间通讯的工具,在癌症的进展中发挥着重要作用。已经发现几种EVs分泌的非编码RNA参与卵巢癌的调节。如外泌体衍生的miR-205通过促进血管生成来增强卵巢癌细胞的转移[14]。本研究发现,与正常卵巢组织相比,miR-4488在卵巢癌细胞和组织中显著下调;ABHD8是miR-4488的下游靶标,且ABHD8在卵巢癌中表达上调。本研究结果显示,通过体内体外的实验证明,MSC分泌的EVs-miR-4488通过下调抑制ABHD8表达来抑制卵巢癌细胞的增殖、侵袭和迁移,进而影响到卵巢癌的进展。本研究揭示了MSC-EV-miR-4488与ABHD8在卵巢癌中的联合调控作用机制。
本研究为EVs在卵巢癌治疗中的应用提供了新的思路,但miR-4488能否成为潜在的治疗靶点还需进一步研究。目前EVs的检测分析技术尚未成熟,其应用于卵巢癌的临床诊断和治疗还存在着许多挑战。
