山竹壳多糖提取工艺优化及其生物活性研究
2022-08-05姚欣孙宁云陈鑫范丽霞杨安平朱峰刘辉
姚欣,孙宁云,陈鑫,范丽霞,杨安平,朱峰,刘辉,*
(1.佛山科学技术学院食品科学与工程学院,广东 佛山 528225;2.佛山科学技术学院医学院,广东 佛山 528000;3.佛山科学技术学院环境与化学工程学院,广东 佛山 528000)
山竹(Garcinia mangostana L.)是藤黄科(Guttiferae)藤黄属热带常绿乔木,又名山竹子、倒捻子等,原产于马来西亚,现主要分布于泰国、越南等东南亚国家,我国广西、海南等地也有引种[1]。山竹果实中含有丰富的蛋白质、维生素和矿物质,有“水果皇后”之称[2]。
山竹的果皮作为药材治疗疾病已有几百年历史。山竹果皮晒干后被磨成粉末,能作为抗菌药和抗寄生虫药来治疗创伤、痢疾和慢性溃疡[3-4]。山竹壳中主要含有氧杂蒽酮类、黄酮类、多酚类和多糖等成分[5]。其中氧杂蒽酮类是山竹壳的特征性成分,并且该类化合物具有显著的抗氧化、抗菌、抗炎、细胞毒作用[6]。此外,山竹壳富含的黄酮类、多酚类化合物在抗氧化、抗菌等方面具有较好的作用[7],而对其多糖的提取及生物活性研究涉及较少。
近年来,多糖在免疫调节、抗氧化、降血脂等方面显示出较好的作用,多糖也成为研究的热点。Li等[8]研究了海金沙草多糖的抗菌效果,结果表明其具有广谱抗菌作用,尤其对酵母菌有着较高的抑制作用。宫海全[9]的研究结果表明蜜环菌多糖能提高糖尿病小鼠肝脏的自噬水平,减少脂肪堆积,提高胰岛素敏感性且能保护糖尿病小鼠的胰岛,改善受损的功能,达到降血糖的功效。在细胞实验中,800 mg/L的枸杞多糖可通过诱导细胞凋亡和阻滞细胞周期来发挥抗肿瘤活性,可以抑制人膀胱癌细胞系BIU87的生长,诱导BIU87细胞凋亡[10]。
山竹多糖的研究多集中在果肉中,李娥等[11]测定了山竹提取物有效成分,并分析了多糖组成,结果表明,山竹果肉中富含多糖,主要有葡萄糖、葡萄糖醛酸、果糖、木糖、阿拉伯糖、鼠李糖、半乳糖。对果壳多糖的研究较少,Gan等[12]采用响应面试验优化山竹壳果胶多糖的提取工艺条件,从而获得具有高糖醛酸含量和抗氧化活性的高抗氧化果胶多糖。为了更好地利用山竹果壳,提高山竹壳的开发利用价值,本文采用正交试验,对超声辅助提取山竹壳多糖的工艺进行优化,并对其抗氧化活性、抗菌活性以及抗肿瘤活性进行研究,为山竹壳在食品等方面的进一步开发利用提供科学依据及数据参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
山竹壳:市售;菌种(大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌):广东省微生物菌种保藏中心;人乳腺癌细胞(MCF-7)、人结肠癌细胞(DLD-1)、人黑色素瘤细胞(A375)、小鼠黑色素瘤细胞(B16):中国科学院上海细胞中心。葡萄糖、苯酚、DPPH、ABTS、二甲基亚砜(均为分析纯):上海麦克林生化科技有限公司;过硫酸钾(分析纯):福晨(天津)化学试剂有限公司;细胞计数试剂盒(cell counting kit-8,CCK-8):亚科因(武汉)生物技术有限公司;LB培养基:青岛高科技工业园海博生物技术有限公司;DMEM培养基、胎牛血清、胰酶、磷酸缓冲盐溶液(phosphate buffered saline,PBS):美国 Gibco 公司;青霉素、链霉素:上海抚生有限公司。
1.1.2 试验仪器
超声波清洗器(060ST):深圳市华策科技有限公司;台式高速离心机(TG16-WS):湖南湘仪实验室仪器开发有限公司;旋转蒸发器(RE-2000A):郑州特尔仪器设备有限公司;紫外分光光度计(UV-2700):岛津企业管理(中国)有限公司;全波长酶标仪(EPOCH):美国BioTek公司;智能生化培养箱(LRH-150):郑州生元仪器有限公司;二氧化碳培养箱(BB 5060)、立式自动压力蒸汽灭菌器(GR60DA):致微(厦门)仪器有限公司;倒置荧光显微镜(IMC-900TFL):广州科适特科学仪器有限公司。
1.2 试验方法
1.2.1 材料处理
取山竹壳于60℃烘箱中干燥至恒重,然后用粉碎机粉碎,过60目筛获取山竹壳样品备用[13]。
1.2.2 葡萄糖标准曲线的绘制
首先准确称量10 mg已充分干燥至恒重的葡萄糖粉末,在烧杯中加入适量去离子水搅拌使葡萄糖完全溶解,然后将其定容到100 mL容量瓶中,即得到0.100 0 mg/mL葡萄糖标准溶液。
分别准确移取上述葡萄糖溶液 0、0.20、0.40、0.60、0.80 mL,然后用去离子水补至1 mL,配制浓度分别为0、20.00、40.00、60.00、80.00 μg/mL 葡萄糖待测液。分别移取1.00 mL上述各个浓度葡萄糖待测液到试管中,接着依次加入5.0%苯酚溶液1.0 mL,充分混匀,然后立即加入98%浓硫酸5 mL,混匀后静置5 min,于37℃水浴加热20 min,待其温度降到室温25℃后于488 nm波长下测定吸光度[14-15]。以吸光度Y对浓度X进行线性回归,得回归方程:Y=0.009 4X+0.092 8,R2=0.993,线性范围为 0~80 μg/mL。
1.2.3 山竹壳多糖的提取及提取率测定
准确称取1.000 g的山竹壳粉末,与一定体积的去离子水依次加入到锥形瓶中。然后将锥形瓶放置于超声机内,设定超声功率、超声时间、提取温度等参数,共提取3次,合并滤液,浓缩至25 mL,采用Sevag法[16]脱蛋白,即得多糖提取液[17-18]。按照1.2.2中的方法测定多糖提取液的吸光度,通过回归方程计算多糖浓度,并按照公式计算多糖提取率。
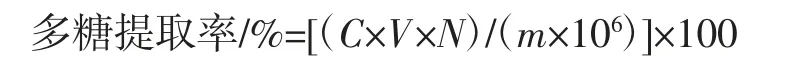
式中:C为提取液多糖浓度,μg/mL;V为提取液体积,mL;N为稀释倍数;m为山竹壳粉末质量,g。
1.2.4 单因素试验
以1.000g山竹壳粉末为基准,固定超声功率216W、超声时间30 min和提取温度45℃,考察料液比[1∶20、1 ∶30、1 ∶40、1 ∶50、1 ∶60(g/mL)]对山竹壳多糖提取率的影响;固定料液比1∶40(g/mL)、超声时间30 min和超声功率216 W,考察提取温度(35、45、55、65、75℃)对山竹壳多糖提取率的影响;固定料液比1∶40(g/mL)、超声功率216 W和提取温度45℃,考察超声时间(10、20、30、40、50 min)对山竹壳多糖提取率的影响;固定料液比1∶40(g/mL)、超声时间30 min和提取温度45℃,考察超声功率(200、240、280、320、360 W)对山竹壳多糖提取率的影响[19]。
1.2.5 正交试验
在单因素试验结果基础之上,以相关因素为自变量、多糖提取率为评价指标,设计L9(33)正交试验优化山竹壳多糖的提取工艺,水平及因素见表1。
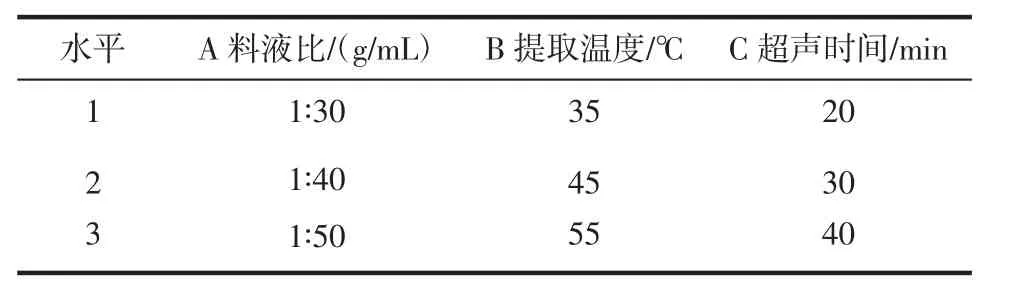
表1 正交试验因素水平设计Table 1 Factors and levels in orthogonal experiment
1.2.6 多糖体外抗氧化活性测定
1.2.6.1 对DPPH自由基清除效果的测定
首先用蒸馏水将山竹壳多糖配制成1、0.5、0.25、0.125、0.0625、0.03125、0.015625 mg/mL 7 个浓度,分别取50 μL不同浓度的山竹壳多糖溶液于96孔板中,分别加入0.1 mmoL/L的DPPH溶液150 μL,室温25℃下避光静置30 min后,在酶标仪517 nm处测定吸光度Ai,VC做阳性对照;对照组用无水乙醇代替DPPH,测定吸光度Aj;空白组以蒸馏水代替多糖溶液,测定吸光度A0。试验重复3次取平均值[20-21]。DPPH自由基清除率计算公式如下。

1.2.6.2 对羟基自由基清除效果的测定
在 96 孔板中加入 50 μL 不同浓度(1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 mg/mL)的山竹壳多糖溶液、50 μL 9 mmol/L 的 FeSO4和 50 μL 9 mmol/L 的水杨酸-乙醇,振荡10 min后加入50 μL 8.8 mmol/L的H2O2,VC做阳性对照,以蒸馏水代替水杨酸作为阴性对照,以蒸馏水代替多糖溶液作为空白对照,室温25℃下避光静置反应30 min后,在酶标仪510 nm处测定吸光度,试验重复3次[22]。羟基自由基清除率计算公式如下。

式中:Ai为样品溶液吸光度;Aj为不含水杨酸-乙醇溶液吸光度;A0为不含样品溶液吸光度。
1.2.6.3 对ABTS+自由基清除效果的测定
称取0.038 14 g ABTS粉末,定容至10 mL,配制成7 mmol/L的溶液;称取0.013 4 g过硫酸钾K2S2O8,定容至10 mL,配制成4.95 mmol/L溶液。将两溶液等体积混匀,接着将其放于阴暗处静置12 h,形成ABTS+储备液,然后按体积比 1 ∶20 用 PBS(0.01 mol/L、pH 7.4)稀释储备液,使其在734 nm波长下的吸光度为0.70±0.02。
取 50 μL 不同浓度(1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 mg/mL)的山竹壳多糖溶液于96孔板中,分别加入150 μL ABTS+溶液,室温25℃下避光静置反应30 min后,在酶标仪734 nm处测定吸光度Ai,VC做阳性对照;阴性对照组用蒸馏水代替ABTS+溶液,测定吸光度Aj;空白组以蒸馏水代替多糖溶液,测定吸光度A0。试验重复3次取平均值[23]。ABTS+自由基清除率计算公式如下。

1.2.7 多糖抗菌活性的测定
采用微量肉汤稀释法测定山竹壳多糖对供试菌的最小抑菌浓度(minimuminhibitory concentration,MIC)。首先配制50 mg/mL的山竹壳多糖溶液,用倍半法稀释多糖溶液,形成 50、25、12.5、6.25、3.125、1.563、0.781、0.391、0.193、0.096 6 mg/mL 10个浓度梯度。将大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌均接种于牛肉膏蛋白胨培养基中,在37℃条件下培养24 h,得到105cfu/mL的菌悬液。在96孔板中进行样品接种,1~11每孔均加入100 μL的营养肉汤,第12孔加入200 μL的营养肉汤;取100 μL不同浓度(50、25、12.5、6.25、3.125、1.563、0.781、0.391、0.193、0.096 6 mg/mL)的山竹壳多糖溶液依次加入1~10孔,1~11孔均加入菌液100 μL;37℃条件下孵育16 h~18 h。在酶标仪600 nm处测吸光度,并确定MIC[24]。
1.2.8 多糖抗肿瘤活性的测定
首先用DMEM培养基将山竹壳多糖配制成0、3.125、6.25、12.5、25、50、100 μg/mL 7 个浓度。在 37 ℃饱和湿度、5% CO2条件下培养 MCF-7、DLD-1、A375和B16细胞。取对数生长期的细胞,分装到96孔板中,调整细胞浓度使每孔约5 000个细胞,在CO2培养箱中培养 24 h。取不同浓度(0、3.125、6.25、12.5、25、50、100 μg/mL)的多糖溶液,从低浓度到高浓度依次加入到96孔板中,每孔100 μL,在37℃培养箱中培养48 h。吸出孔内培养液,然后向每孔内加入100 μL含10%CCK-8试剂的基础培养基,37℃培养箱内培养1 h~2 h,用酶标仪在450 nm处测吸光度[25]。

式中:A0为具有培养基和CCK-8溶液而没有细胞的孔吸光度;A1为具有细胞、CCK-8溶液和多糖样品溶液的孔吸光度;A2为具有细胞、CCK-8溶液而不含多糖样品溶液的孔吸光度。
1.3 数据处理
本试验使用GraphPad Prism 8.0.2和SPSS 23.0等软件对数据进行整理和统计分析,每个试验平行测定3次,取平均值。
2 结果与分析
2.1 山竹壳多糖单因素试验结果与分析
2.1.1 料液比对山竹壳多糖提取率的影响
料液比对山竹壳多糖提取率的影响见图1。

图1 料液比对多糖提取率的影响Fig.1 Effect of solid-liquid ratio on the extraction rate of polysaccharides
由图1可以看出,当料液比从1∶20(g/mL)变化到1∶60(g/mL)时,山竹壳多糖提取率先升高后下降,当料液比为1∶40(g/mL)时,山竹壳多糖提取率最高,为8.75%,由此可推测在一定范围内,水用量的增加促进了多糖从山竹壳中浸出扩散到溶液中,而溶剂添加量过高时,会影响浸提体系的传热和传质,不利于多糖的提取[26]。因此,山竹壳多糖提取的最佳料液比为 1 ∶40(g/mL)。
2.1.2 提取温度对山竹壳多糖提取率的影响
提取温度对山竹壳多糖提取率的影响见图2。
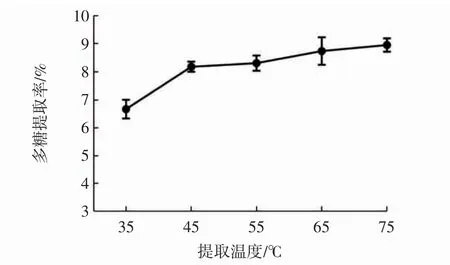
图2 提取温度对多糖提取率的影响Fig.2 Effect of extraction temperature on the extraction rate of polysaccharides
由图2可知,随着温度的升高,山竹壳多糖提取率逐渐增大。当温度从35℃升至45℃时,多糖提取率上升较快。当温度超过45℃,提取率增长缓慢。这可能是温度适当升高,使分子运动速率加快,多糖溶出率上升[27],但温度过高,多糖的分子结构在高温环境中易被破坏,因考虑到实际意义,节约能源,选择山竹壳多糖提取的最佳提取温度为45℃。
2.1.3 超声时间对山竹壳多糖提取率的影响
超声时间对山竹壳多糖提取率的影响见图3。
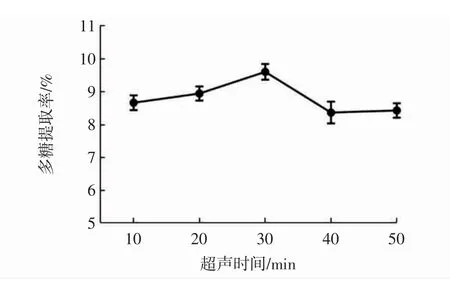
图3 超声时间对多糖提取率的影响Fig.3 Effect of ultrasonic time on the extraction rate of polysaccharides
由图3可知,当超声时间从10 min延长到50 min时,山竹壳多糖提取率整体呈先升高后下降趋势,当超声时间为30min时,山竹壳多糖提取率最高,为9.61%,可推测随着超声时间的延长,细胞壁被充分破碎,多糖分子被充分溶出,提取率随之上升,但随着超声时间的延长,多糖提取率下降,这可能是由于此时多糖已充分溶出,延长的超声时间不会增加多糖的溶出而会导致多糖结构的破坏,从而降低了提取率。因此,山竹壳多糖提取的最佳超声时间为30 min。
2.1.4 超声功率对山竹壳多糖提取率的影响
超声功率对山竹壳多糖提取率的影响如图4。

图4 超声功率对多糖提取率的影响Fig.4 Effect of ultrasonic power on the extraction rate of polysaccharides
由图4可知,超声功率为240 W时,山竹壳多糖提取率最高,为9.54%。超声功率小于240 W时,多糖提取率随着超声功率增大而上升;当超声功率大于240 W时,多糖提取率随着功率增大而缓慢减小。其原因可能是由于功率适当增大,有助于破碎细胞结构,但功率过大时,多糖结构受到破坏,多糖提取率些许下降,但从整体可以看出,超声功率对山竹壳多糖的提取率影响不显著。综上所述,山竹壳多糖提取的最佳超声功率为240 W。
2.2 正交试验结果与分析
分析山竹壳多糖提取的单因素试验结果可知,超声功率变动对多糖提取率的影响不显著,为考察因素中的次要因素。因此,固定超声功率为240 W,研究料液比、提取温度和超声时间3个因素对山竹壳多糖提取的影响,以山竹壳多糖提取率为评价指标,进行L9(33)正交试验。正交试验结果见表2,方差分析结果见表3。
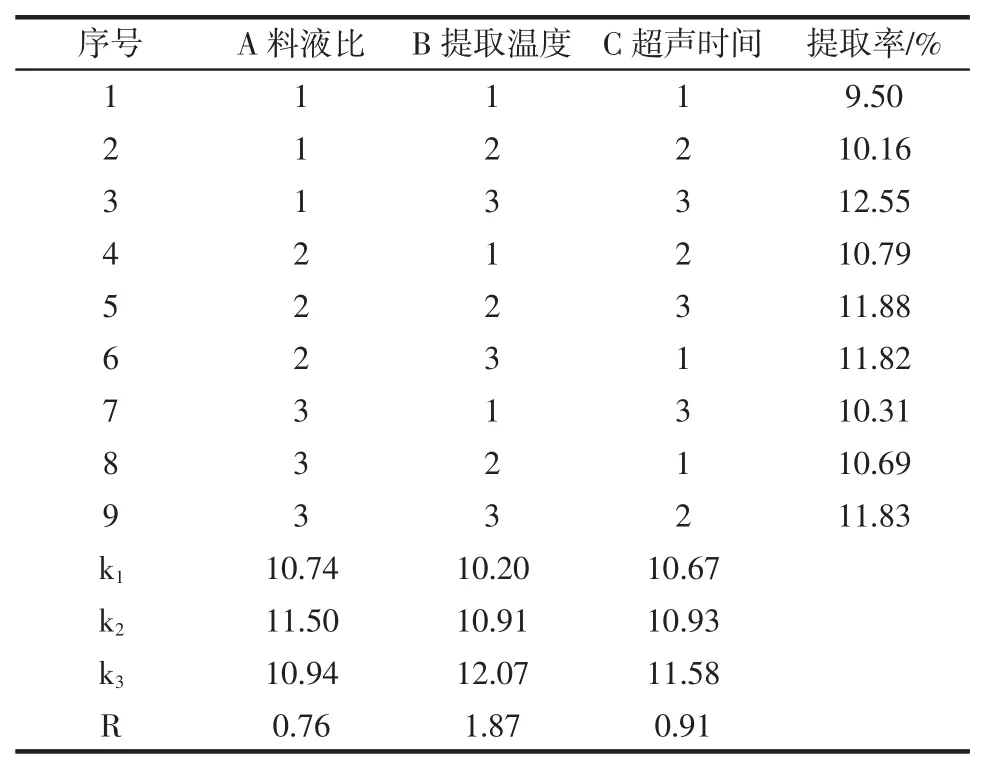
表2 提取工艺条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for extraction conditions optimization
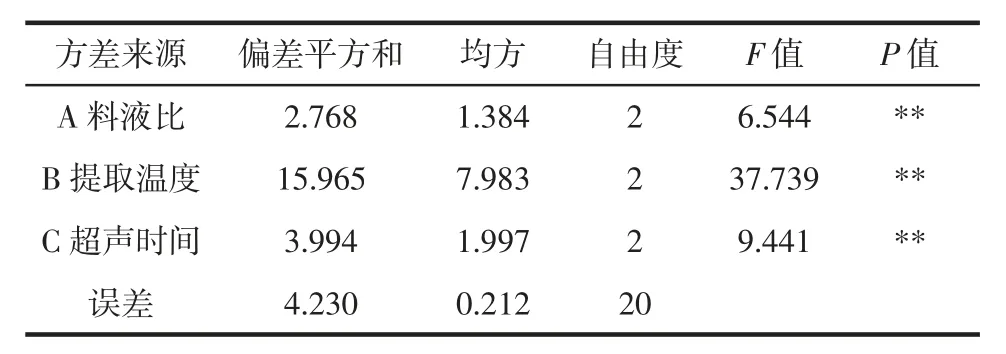
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experimental results
通过表2中多糖提取率的极差分析结果可知,影响提取率的各因素主次顺序为提取温度(B)>超声时间(C)>料液比(A);通过 k 值比较可知,kA2>kA3>kA1,kB3>kB2>kB1,kC3>kC2>kC1,即山竹壳多糖提取的最优组合为A2B3C3。由表3方差分析结果可知,料液比、提取温度和超声时间对山竹壳多糖提取率有极显著影响(P<0.01),故山竹壳多糖提取的最优工艺条件为料液比1∶40(g/mL)、提取温度 55℃、超声时间 40 min。按照此工艺参数提取3次,多糖提取率分别为13.56%、12.69%、12.73%,平均值为12.99%,高于正交试验每组的结果,相对标准偏差(relative standard deviation,RSD)为3.70%,说明工艺稳定可靠。
2.3 山竹壳多糖体外抗氧化活性的测定
2.3.1 山竹壳多糖对DPPH自由基清除效果的测定
山竹壳多糖对DPPH自由基的清除效果见图5。

图5 多糖对DPPH自由基清除效果的测定Fig.5 The scavenging effect of polysaccharides on DPPH radical
由图5可知,在15.625 μg/mL~250 μg/mL浓度范围内,DPPH自由基清除率随着多糖浓度的增加而升高。当多糖浓度大于250 μg/mL时,山竹壳多糖对DPPH自由基清除率基本保持不变,当多糖浓度为250 μg/mL时,其对DPPH自由基清除率可达95.3%,与同浓度VC清除DPPH自由基能力相当,山竹壳多糖清除DPPH自由基的IC50为69.25 μg/mL。因此,山竹壳多糖对DPPH自由基具有较强的清除能力。
2.3.2 山竹壳多糖对羟基自由基清除效果的测定
山竹壳多糖对羟基自由基的清除效果见图6。
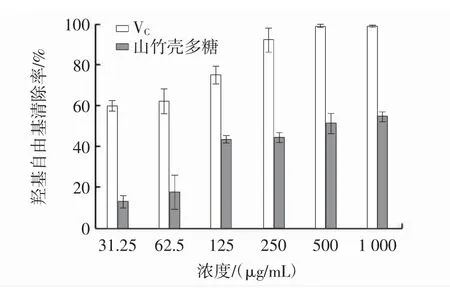
图6 多糖对羟基自由基清除效果的测定Fig.6 The scavenging effect of polysaccharides on OH radical
由图6可知,在所研究的多糖浓度范围内,羟基自由基清除率随多糖浓度的增加而增强。当多糖浓度为1 000 μg/mL时,山竹壳多糖的羟基自由基清除率达55.21%,高于同浓度VC对羟基自由基清除率的一半,山竹壳多糖清除羟基自由基的IC50为462.50 μg/mL。因此,山竹壳多糖对羟基自由基具有较好的清除效果。
2.3.3 山竹壳多糖对ABTS+自由基清除效果的测定
山竹壳多糖对ABTS+自由基的清除效果见图7。
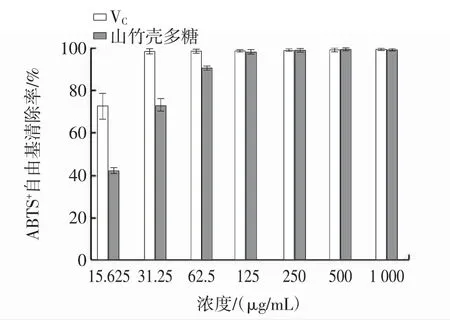
图7 多糖对ABTS+自由基清除效果的测定Fig.7 The scavenging effect of polysaccharides on ABTS+radical
由图7可知,在 15.625 μg/mL~125 μg/mL 范围内,ABTS+自由基清除率随着多糖浓度的增加而提高。当多糖浓度大于125 μg/mL时,山竹壳多糖对ABTS+自由基清除率基本保持不变,当多糖浓度为125 μg/mL时,其对ABTS+自由基清除率可达99.16%,与同浓度VC清除ABTS+自由基的能力相当,山竹壳多糖清除ABTS+自由基的IC50为18.39 μg/mL。因此,山竹壳多糖对ABTS+自由基具有很强的清除能力。
2.4 山竹壳多糖抗菌活性的测定
不同浓度山竹壳多糖对5种供试菌的抑菌效果结果如表4。

表4 多糖对供试菌的抑菌效果Table 4 Antibacterial effect of polysaccharides on test bacteria
由表4可知,山竹壳多糖对5种菌种的MIC顺序为鲍曼不动杆菌>铜绿假单胞菌>大肠杆菌=肺炎克雷伯菌>金黄色葡萄球菌,山竹壳多糖对鲍曼不动杆菌的MIC相对较高,为25 mg/mL,对铜绿假单胞菌的MIC为6.25 mg/mL,对大肠杆菌和肺炎克雷伯菌的MIC相同,均为3.125 mg/mL,对金黄色葡萄球菌的MIC为0.391 mg/mL。由此可见,山竹壳多糖对金黄色葡萄球菌抑制作用最强,对大肠杆菌、肺炎克雷伯菌和铜绿假单胞菌的抑制效果次之,对鲍曼不动杆菌的抑制效果最差。
2.5 山竹壳多糖抗肿瘤活性的测定
山竹壳多糖抗肿瘤活性的测定结果见图8。

图8 多糖对4种不同肿瘤细胞细胞活力的影响Fig.8 Effects of polysaccharides on cell viability of tumor cells
由图8可知,B16和MCF-7细胞对山竹壳多糖不敏感,随着多糖浓度的增加,其细胞活力基本保持不变;在 3.125 μg/mL~100 μg/mL 的浓度范围内,A375和DLD-1细胞对山竹壳多糖较为敏感,随着多糖浓度的增加,A375和人DLD-1细胞的细胞活力呈下降趋势。浓度为12.5 μg/mL时,A375细胞增殖抑制作用与对照组比较具有统计学意义上的差异(P<0.05),而DLD-1细胞增殖抑制作用与对照组比较差异极显著(P<0.01),且多糖作用于DLD-1和A375细胞的IC50分别为76.66 μg/mL和127.70 μg/mL。综上所述,山竹壳多糖对A375和DLD-1细胞具有一定的抑制效果,对B16和MCF-7细胞无抑制作用。
3 结论
将单因素试验和正交试验相结合得出山竹壳多糖最优提取工艺为料液比1∶40(g/mL),提取温度55℃,超声时间40 min,超声功率固定为240 W,此时山竹壳多糖提取率为12.99%。山竹壳多糖对DPPH自由基、羟基自由基和ABTS+自由基均具有较好的清除效果,其清除DPPH自由基、羟基自由基以及ABTS+自由基的IC50值分别为69.25、462.50 μg/mL 和 18.39μg/mL,表明山竹壳多糖具有良好的抗氧化性。山竹壳多糖具有一定的抑菌效果。其中,山竹壳多糖对金黄色葡萄球菌的抑制作用最强(MIC为0.391 mg/mL),对大肠杆菌、肺炎克雷伯菌和铜绿假单胞菌抑制效果次之(MIC分别为 3.125、3.125、6.25 mg/mL),对鲍曼不动杆菌的抑制效果最差(MIC为25 mg/mL)。山竹壳多糖对人乳腺癌细胞(MCF-7)和小鼠黑色素瘤细胞(B16)的无增殖抑制作用,对人结肠癌细胞(DLD-1)和人黑色素瘤细胞(A375)的具有一定的增殖抑制效果,其作用于人结肠癌细胞(DLD-1)和人黑色素瘤细胞(A375)的IC50分别为 76.66 μg/mL 和 127.70 μg/mL。本研究为山竹壳多糖的工业化生产和天然抗氧化剂、抑菌剂、抗肿瘤活性成分的开发提供了试验依据,然而抗氧化、抗菌和抗肿瘤机制有待进一步研究。
