迷迭香提取物延长雌性果蝇寿命研究
2022-08-05沈彬王懿椿张瑜尚逢实杜晓梅王晓丹王华丽王浩
沈彬,王懿椿,张瑜,尚逢实,杜晓梅,王晓丹,王华丽,王浩*
(1.中科兰丁(天津)自然医学研究院,天津 300308;2.天津科技大学食品科学与工程学院,天津 300457;3.国家风险评估中心,北京 100022)
衰老是一种不可避免的生理现象,它会导致人类器官功能逐渐下降。“衰老的自由基理论”得到了许多研究的支持[1]。据报道,活性氧(reactive oxygen species,ROS)是导致衰老的主要因素之一[2]。在生物体中,维持适当水平的ROS 是维持氧化还原稳态的关键。在一个健康的状态下,自由基被用来清除衰老的细胞,清理或控制突变的细胞,从而使身体处于一个和谐有序的状态[3]。然而,过量的过氧化物和自由基引起的氧化应激可导致细胞凋亡或坏死,导致许多疾病发生,从而加速衰老。随着年龄的增长,内源性抗氧化酶活性降低,导致抗氧化防御系统的功能降低,自由基损伤增加,进而衰老[4]。
迷迭香是唇形科迷迭香属植物,产地在地中海沿岸,具有长远的发展历史[5]。迷迭香提取物(rosemary extract,RE)具有良好的抗氧化、抗炎、抗菌、调节免疫功能和改善脂质代谢等多种生物学功能,是替代抗生素的潜在产品[6]。许多报道显示RE 中有鼠尾草酸、鼠尾草酚、迷迭香酸等多种活性物质[7]。前期试验也发现1.5 mg/mL RE 对雌雄果蝇都有一定的抗氧化作用,并且可以有效延缓高脂导致的氧化损伤从而进一步延缓衰老[8-10]。黑腹果蝇作为一种经典的模式生物,其衰老基因与代谢途径与人类非常相似[11]。研究发现雌性果蝇的雌激素含量高,而且肠道发育的敏感性要比雄性果蝇强[12],所以选择雌性果蝇作为模型研究肠道。
在分子水平上,人体的衰老与胰岛素通路密切相关,胰岛素途径是一个高度保守的转导途径,调控生命周期[13]。Akt 作为胰岛素通路和雷帕霉素通路之间的枢纽,被胰岛素生长因子激活,抑制mTOR 负调控因子TSC2 的活性和TSC1 的活性,从而减少自噬调控,加速衰老[14]。近年来,有研究发现自噬可以调节肠道干细胞(intestinal stem cells,ISCs)的增殖以及肠道屏障功能障碍,以维持肠道稳态,减少由肠道失衡引起的疾病[15]。
近年来,RE 的抗氧化活性已被广泛报道,但其在mTOR 和自噬通路中调控寿命的机制研究较少。因此,本论文研究了RE 对雌性果蝇的抗氧化作用,及其对雌性果蝇衰老过程肠道功能的调节作用和潜在的分子机制,为RE 产品的开发和进一步探索提供参考。
1 材料与方法
1.1 材料与试剂
RE:天津尖峰天然产物研究开发有限公司;野生型果蝇W1118:天津科技大学食品添加剂与营养调控研究室提供;Esg-Gal4 UAS-GFP 转基因型果蝇(该品系果蝇特异性的携带标记果蝇肠道前体细胞绿色荧光蛋白):东北林业大学生命科学学院提供;过氧化氢、非消化染料(FD&C blue NO.1)、Trizol 试剂、SYBR Green染料、Lyso-Tracker Red 荧光探针:美国Sigma 公司。
cDNA(complementary DNA)反转录试剂盒:美国Sigma 公司;总超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、铜锌超氧化物歧化酶(Cu/Zn-superoxide dismutase,Cu/Zn-SOD)、锰超氧化物歧化酶(Mn-superoxide dismutase,Mn-SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒:南京建成试剂公司。乳酸杆菌琼脂、胰蛋白胨、酵母浸粉、氯化钠、葡萄糖、琼脂、甘露醇、营养琼脂(均为分析纯):北京鼎国昌盛生物技术公司。所需基因引物由北京鼎国昌盛生物技术公司设计。
1.2 仪器与设备
OLYMPUSU-RFLT50 型荧光显微镜:日本Olympus公司;G:box 凝胶图像采集分析系统:英国Syngene 公司;BIO-RAD 实时定量聚合酶链式反应(polymerase chain reaction,PCR)仪:北京元业伯乐科技发展有限公司;Thermo Finnigan Surveyor 液相色谱-质谱联用仪(liquid chromatograph mass spectrometer,LC-MS):美国Thermo Finnigan公司;SMZ-140 酶标仪:麦克奥迪(厦门)电气股份有限公司;玻璃匀浆器:安徽韦斯实验设备有限公司。
1.3 RE 的成分分析
采用Thermo Finnigan Surveyor LC-MS 系统,配备光电二极管阵列检测器和Venusil XBP C18柱(2.1 mm×150 mm)对迷迭香提取物中的成分进行测定。流速0.2 mL/min、检测波长280 nm、烘箱温度30 ℃。流动相为0.1%A 相(甲酸)和B 相(乙腈)。梯度洗脱程序:10%B 0~5 min;20%B 40 min~45 min;90%B:45 min~55 min;最后用10%B 浸泡55.1 min~60.0 min。采用电喷雾电离源(electron spray ionization,ESI)进行正电离模式下的质谱分析。ESI 喷雾电压为4.5 kV,毛细管电压为-10 V,毛细管温度为275 ℃,氮气(N2)流量为30 arb,辅助气流量为5 arb。全扫描模式下分子量范围为100~500 m/z。
1.4 果蝇培养基的配制
果蝇基础培养基(750 mL):蒸馏水(750 mL)、玉米粉(72 g)、无水葡萄糖(72 g)、酵母粉(10 g)、琼脂粉(6 g)、防腐剂(40 mL)(1%对羟基苯甲酸乙酯)[16]。果蝇实验培养基由基础培养基添加RE(0.2、0.5、1.5 mg/mL)配制而成。
1.5 寿命实验
2 d 未交配的野生型果蝇W1118被分为4 组,每组各200 只。一组基础饮食为对照组,另3 组分别为0.2、0.5、1.5 mg/mL RE 实验组。每3 d 更换一次培养基,并记录存活只数。最大寿命计算为10%最长存活时间[17]。
1.6 摄食量和体重实验
收集羽化后2 d 的野生型果蝇W1118,随机分成4组,每组200 只,果蝇培养如1.5 果蝇寿命培养方法。摄食量测定实验:培养4 d,先转移到含有用蒸馏水浸湿的滤纸条的空管中,饥饿2 h,然后转移到含有0.2%罗丹明B 磺酸钠盐的饮食中2 h。采用双盲法主观评分0(无色腹部)到5(完全红色腹部)测量红色腹部的程度,以红色程度作为每只果蝇的食物摄入量指标[17]。体重实验:体重变化也被认为是食物摄入量的一个指标。在饲养第20 天,用CO2麻醉果蝇,然后称量并计算果蝇平均体重[18]。
1.7 攀爬实验
用RE(0.2、0.5、1.5 mg/mL)或对照处理的黑腹果蝇在0、15、30、45 d 转移到空管中,计时统计20 s 内爬升超过7 cm 的果蝇的数量。实验平行测定3 次[18]。
1.8 应激损伤实验
收集羽化后2 d 的野生型果蝇W1118,随机分成4 组,每组200 只。RE(0.2、0.5、1.5 mg/mL)或对照处理至25 d 时将果蝇饥饿2 h,然后转移到新的小瓶中,其中含浸有1 mL 饱和30%过氧化氢(H2O2)或含20 mmol/L百草枯的6%葡萄糖溶液的滤纸条。每2 h 计数一次存活只数,直到果蝇全部死亡,每个独立实验重复3 次[9]。
1.9 “蓝精灵”实验
收集羽化后2 d 的野生型果蝇W1118,随机分成4组,每组200 只,果蝇培养如1.5 果蝇寿命培养方法。第20 天和第50 天,对照组果蝇在不添加RE 且含有2.5%蓝色染料的培养基中喂养,实验组果蝇在添加不同浓度RE 且含有2.5%蓝色染料的培养基中喂养。饥饿2 h 后,喂食蓝色染料9 h,之后用CO2迷晕,并在显微镜下观察其腹部状态,统计“蓝精灵”的数量[17]。每个独立实验重复3 次。
1.10 肠道菌落总数测定
乳酸杆菌(Lactobacilli,LMRS)选择性培养基:70 g/L 乳酸杆菌琼脂;肠杆菌(Enterobacteria,ENT)选择性培养基:10 g/L 胰蛋白胨、1.5 g/L 酵母浸粉、10 g/L葡萄糖、5 g/L 氯化钠、12 g/L 琼脂;醋酸杆菌(Acetobacteria,ACE)选择性培养基:25 g/L 甘露醇、5 g/L 酵母浸粉、3 g/L 胰蛋白胨、15 g/L 琼脂;营养培养基(nutrient rich medium,NR):23 g/L 营养琼脂。
收集羽化后2 d 的野生型果蝇W1118,随机分成4组,每组200 只,果蝇培养如1.5 果蝇寿命培养方法。饲养到20、50 d 时,禁食2 h,用CO2麻醉后,在显微镜下用解剖针取出中肠(n=10),置于1 mL 磷酸盐缓冲液(pH6)中,然后用玻璃匀浆器研磨并稀释,取0.1 mL稀释液,分别涂布在肠杆菌(ENT)、乳酸菌(LMRS)、醋酸杆菌(ACE)的选择培养基和营养培养基(NR),采用平板菌落计数法计算肠道菌落总数[16]。每个独立实验重复3 次。
1.11 荧光染色和荧光显微镜观察
Esg-Gal UAS-GFP 果蝇以RE(0.2、0.5、1.5 mg/mL)或对照饲料培养20 d 或50 d 后,解剖出中肠,在倒置荧光显微镜下观察荧光点。在荧光染色实验中,RE 或普通饲料喂养果蝇20 d 后,在磷酸盐缓冲液中解剖取肠道,用1μmol/L Lyso-Tracker Red 荧光染色液染色3min;用磷酸盐缓冲液(pH6)清洗,4%甲醛溶液固定30 min,之后用70%甘油封片。使用倒置荧光显微镜进行观察[19]。每个独立实验重复3 次。
1.12 抗氧化酶活性和脂质过氧化物含量测定
收集羽化后2 d 的野生型果蝇W111(8n=200),按照1.5 中的果蝇寿命培养方法培养。将果蝇连续培养45 d,饥饿2 h,称重,按体重与生理盐水1 ∶9(mg/mL)匀浆并稀释,取上清液,按照SOD、CAT、MDA 试剂盒方法测定SOD、CAT 的酶活性和MDA 的含量[20]。
1.13 实时荧光定量聚合酶链式反应实验
用RE(0.2、0.5、1.5 mg/mL)或对照饮食喂食果蝇45 d,在液氮中研磨。总RNA 采用TRizol 提取,采用cDNA 反转录试剂盒构建cDNA。根据循环阈值(cycle threshold,CT)值计算基因表达量。每个基因扩增的引物信息见表1(以RP49 为内参基因)。

表1 引物检测果蝇基因PCR 引物Table 1 PCR primers used for the measurement of genes mRNA expression in Drosophila melanogaster
1.14 统计分析
使用Origin 2021 进行统计分析,结果以平均值±标准差表示。生存实验采用SPSS 17.0 软件的Kaplan-Meier 分析,采用log-rank 检验分析组间显著差异。采用单因素方差分析法评估均数间差异的显著性。采用ImageJ 软件分析荧光水平。P<0.05 表示差异显著,而P<0.01 表示差异极显著。
2 结果与分析
2.1 RE 的组成
采用LC-MS 分析鉴定RE 中的活性成分,结果见表2。

表2 RE 中的主要活性成分Table 2 Main active ingredients in RE
通过液相色谱质谱联用仪共分离鉴定出5 种不同的化合物,如表2 所示,分别为鼠尾草酚、鼠尾草酸、迷迭香酚、迷迭香酸、鼠尾草酸甲酯。
2.2 RE 对果蝇寿命的影响
RE 对雌性果蝇寿命的影响见表3。
表3 RE 对雌性果蝇平均寿命和最大寿命的影响(±s)Table 3 Effects of RE on average lifespan and maximum lifespan of female drosophila(±s)
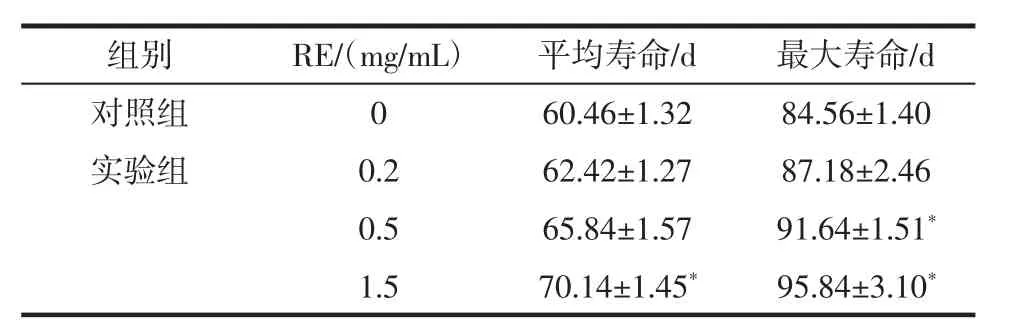
表3 RE 对雌性果蝇平均寿命和最大寿命的影响(±s)Table 3 Effects of RE on average lifespan and maximum lifespan of female drosophila(±s)
注:*表示和对照组相比差异显著(P<0.05)。
组别 RE/(mg/mL) 平均寿命/d 最大寿命/d对照组 0 60.46±1.32 84.56±1.40实验组 0.2 62.42±1.27 87.18±2.46 0.5 65.84±1.57 91.64±1.51*1.5 70.14±1.45* 95.84±3.10*
随着身体的自我调节能力和功能的降低[21],衰老过程中往往伴随着机体对外部压力适应性或抵抗力的降低[3]。如表3 所示,与对照组相比,1.5 mg/mL RE 组平均寿命从60 d 延长到70 d,延长了16.67%(P<0.05);1.5 mg/mL RE 组最大寿命从84 d 延长到95 d,延长了13.10%(P<0.05)。RE 对雌性果蝇的寿命延长有剂量依赖效应关系。因此,认为RE 具有延缓衰老的效果。
2.3 RE 对果蝇进食量和体重的影响
RE 对雌性果蝇摄食量和体重的影响见图1 和表4。
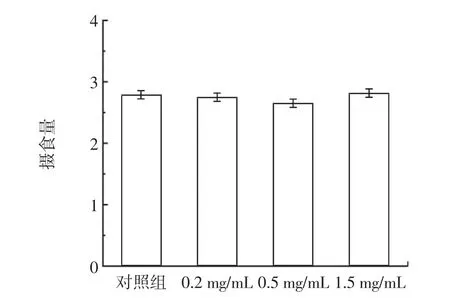
图1 RE 对雌性果蝇摄食量的影响Fig.1 Effect of RE on food intake of female drosophila
表4 RE 对雌性果蝇体重的影响(±s)Table 4 Effects of RE on body weight of female drosophila(±s)

表4 RE 对雌性果蝇体重的影响(±s)Table 4 Effects of RE on body weight of female drosophila(±s)
组别 RE/(mg/mL) 体重/μg对照组 0 1 124.83±11.19实验组 0.2 1 119.47±25.21 0.5 1 123.45±23.25 1.5 1 117.01±25.35
饮食限制在之前的报道中被认为有延长寿命的效果[22],本研究为了排除饮食限制对寿命的影响,根据1.6 描述的方法测量了果蝇的体重和摄食量。由表4 可知,雌性果蝇喂食RE 之后,平均体重与对照组相比,无明显差异;通过测量摄食量发现,实验组与对照组雌性果蝇的摄食量无明显差异(图1)。
2.4 RE 对果蝇爬行能力的影响
随着机体的衰老,生理功能和自我调节能力逐渐减弱,爬行能力间接反映了机体的健康状况和衰老程度[19]。RE 对雌性果蝇爬行能力的影响见图2。

图2 RE 对雌性果蝇爬行能力的影响Fig.2 Effects of RE on the crawling ability of female drosophila
由图2 可知,添加RE 的果蝇爬行能力以剂量依赖的方式增加,1.5 mg/mL RE 处理组的平均爬行百分比比对照组显著增加了18.25%(P<0.05)。在给予RE之后,果蝇的爬行能力明显被改善,在第30 天和第45 天时,1.5 mg/mL RE 组的平均爬行百分比分别提高了33%和28%。以上结果显示,RE 可以改善果蝇的爬行能力、增强机体调节能力。
2.5 RE 对果蝇抵抗氧化应激能力的影响
RE 对雌性果蝇百草枯和过氧化氢应激的影响见图3。

图3 RE 对雌性果蝇百草枯和过氧化氢应激的影响Fig.3 Effects of RE on paraquat and H2O2 stress in female drosophila
在不同的生物模型中,寿命与压力耐受性的增加密切相关[23]。正常代谢或环境应激下的氧化还原反应产生ROS,打破细胞内的氧化还原平衡,加速衰老。细胞内内源性抗氧化酶如SOD 和CAT,可以维持ROS的平衡。由图3 A 可知,0.5、1.5 mg/mL RE 可延长果蝇的最大寿命。与对照组相比,1.5 mg/mL RE 平均寿命显著增加了26.32%(P<0.05)。由图3 B 可知,与对照组相比,0.5 mg/mL 和1.5 mg/mL RE 处理组分别延长最大寿命20.01%和50.20%(P<0.05)。以上结果表明,RE 对H2O2和百草枯诱导的氧化损伤具有保护作用。
2.6 RE 对肠道微生物的影响
RE 对雌性果蝇肠道微生物的影响见图4。
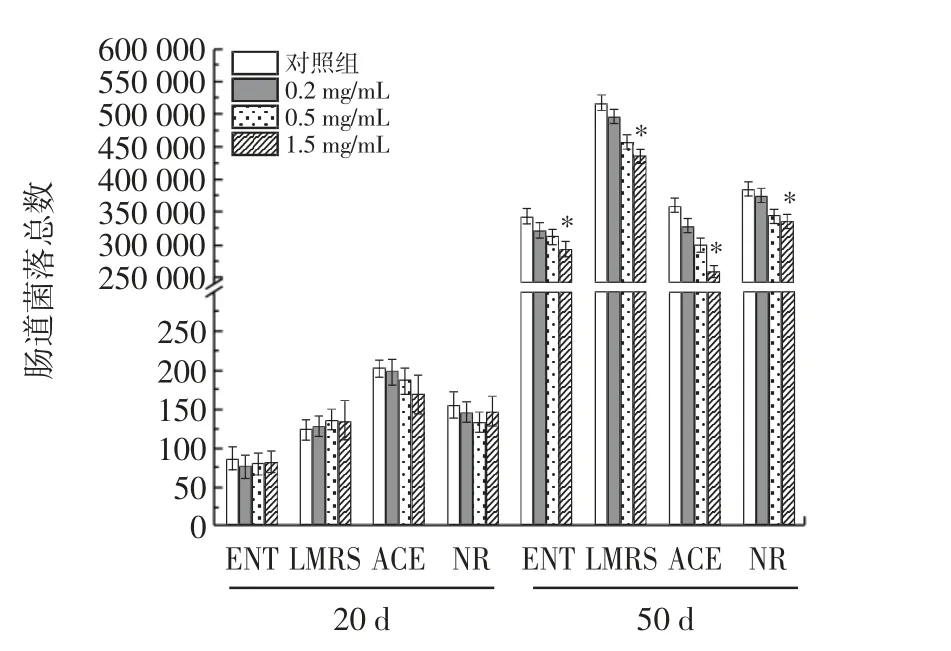
图4 RE 对雌性果蝇肠道微生物的影响Fig.4 Effects of RE on intestinal microbiota of female Drosophila melanogaster
随着机体年龄的增长,调节能力减弱,肠道微生物群结构不平衡,发生肠道屏障功能障碍,自由基积累[24]。近年来,肠道稳态被证明在决定果蝇的寿命方面起着重要作用[25]。由图4 可知,饲喂RE 20 d 后,与对照组相比,RE 组的LMRS、ENT、ACE、NR 均无明显差异。给予RE 50 d 后,与对照组相比,肠道内微生物数量显著减少(P<0.05)。其中雌性果蝇干预RE 的浓度为1.5 mg/mL 时,与对照组比较,LMRS、ENT、ACE、NR 分别下调了15.56%、14.62%、28.31%和13.27%(P<0.05)。结果表明,RE 能够维持年老雌性果蝇肠道微生物平衡,抑制衰老导致的肠道微生物异常增殖。
RE 对果蝇肠道屏障功能的影响见图5。

图5 RE 对果蝇肠道屏障功能的影响Fig.5 Effects of RE on intestinal barrier function in Drosophila melanogaster
在衰老过程中,生理调节功能的下降会导致屏障功能的降低、肠道完整性的降低和通透性的增加。肠道稳态是决定果蝇寿命的因素之一。用一种非消化染料(FD&C blue NO.1)喂养果蝇,以观察肠道组织的老化情况。如图5 A 所示,20 d 龄的果蝇喂食蓝色染料后,染料仅存在于前列腺和消化道。然而,50 d 龄的果蝇中蓝色染料在全身清晰可见。这种全身蓝色的果蝇即为“蓝精灵”,通过计数“蓝精灵”在整体样本中所占的比例来反映果蝇的肠道老化程度,进一步反映其衰老程度。在图5 B 中,随着年龄的增长,对照组的“蓝精灵”百分比增加,然而在50 d,与对照组相比,RE 处理的实验组中蓝精灵数量在减少,1.5 mg/mL RE 组减少了22.86%(P<0.05)。因此,RE 可通过改善果蝇的肠道通透性而保护肠道完整性。
2.7 RE 对ISCs 增殖的影响
RE 对雌性果蝇肠道干细胞增殖的影响见图6 和图7。

图6 RE 对雌性果蝇20 d 和50 d 时肠道干细胞增殖的影响Fig.6 Effect of RE on intestinal stem cell proliferation of female drosophila at day 20 and 50
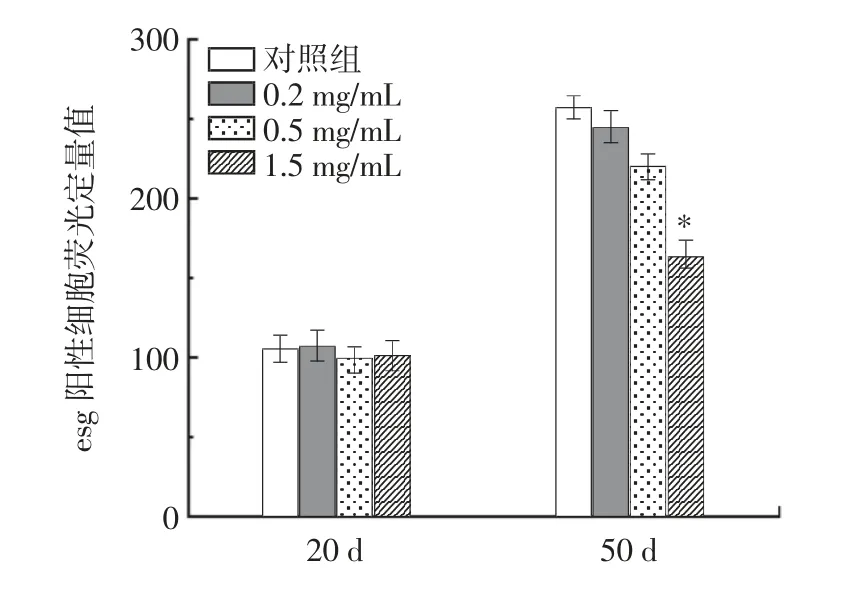
图7 果蝇肠道干细胞荧光强度定量图Fig.7 Quantitative fluorescence intensity of intestinal stem cells in drosophila
逐渐衰老果蝇的肠道屏障功能的丧失已被发现与果蝇的基因型和环境条件相关。在果蝇中肠组织稳态由沿着基底膜分布的多能ISCs 维持[26]。随着果蝇的衰老,果蝇中肠上皮细胞会启动再生机制,加速干细胞增殖,来维持受损细胞,但也会进一步导致干细胞异常增殖[27]。GFP 阳性细胞可以显示ISCs 的增殖率,因为esg 在ISCs 和肠细胞中特异性表达[28]。因此,本文检测了果蝇中肠中esg 的表达情况。图7 显示20d 时对照组和RE 组的增殖均保持正常,无显著性差异(P >0.05)。随着年龄的增长,ISCs 的增殖显著增加。由图7 可知,在老年果蝇(50 d)中,与对照组相比,1.5 mg/mL RE 处理组的esg 阳性细胞数量显著减少了35.89%(P <0.05)。
2.8 RE 对果蝇抗氧化参数的影响
RE 对总SOD、Cu-Zn-SOD、CAT 活力和MDA 含量的影响见表5。RE 对果蝇抗氧化基因表达量的影响见图8。
表5 RE 对总SOD、Cu-Zn-SOD、CAT 活性和MDA 含量的影响(±s)Table 5 Effects of RE on total SOD,Cu-Zn-SOD,CAT activity and MDA content(±s)

表5 RE 对总SOD、Cu-Zn-SOD、CAT 活性和MDA 含量的影响(±s)Table 5 Effects of RE on total SOD,Cu-Zn-SOD,CAT activity and MDA content(±s)
注:*表示与对照组相比差异显著(P<0.05)。
MDA/(nmol/mg pro)对照组 0 205.53±12.35 92.50±9.48 41.24±3.54 1.17±0.05实验组 0.2 213.99±12.20 96.14±9.68 42.57±4.02 0.87±0.07 0.5 234.35±11.25 103.21±8.52 48.25±3.93* 0.65±0.02*1.5 241.94±15.24* 106.98±8.81* 53.29±4.25* 0.58±0.07*组别 RE/(mg/mL)Cu-Zn-SOD/(U/mg pro)Mn-SOD/(U/mg pro)CAT/(U/mg pro)
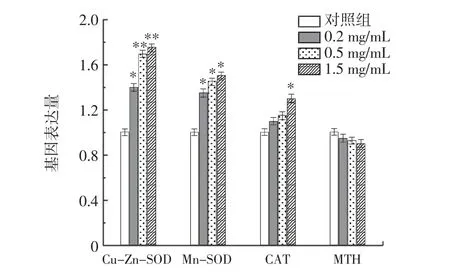
图8 RE 对果蝇抗氧化基因表达量的影响Fig.8 Effects of RE on the expression of antioxidant genes in Drosophila melanogaster
由 表5 可 知,0.5 mg/mL RE 组Cu-Zn-SOD 和Mn-SOD 活性分别提高了14.02%和11.57%(P<0.05),1.5 mg/mL RE 组Cu-Zn-SOD 和Mn-SOD 活性分别提高了和17.71%和15.65%(P<0.05)。同样,与对照组相比,RE 组的CAT 活性分别增加了3.22%、16.99%和29.22%。此外,0.5、1.5 mg/mL RE 组果蝇的MDA 含量分别显著降低44.44%和50.42%(P<0.05)。如图8 所示,RE 组的Cu-Zn-SOD(P<0.05)和Mn-SOD(P<0.05)的mRNA 表达水平高于对照组。与对照组相比,1.5 mg/mL 组的CAT 基因表达显著增加(P<0.05)。同时,1.5 mg/mLRE组MTH 基因表达有所降低。结果表明,RE 不仅能增加与衰老相关的抗氧化酶的活性,而且能提高其mRNA的表达水平。
2.9 分子机制
RE 对雌性果蝇溶酶体荧光强度的影响及定量结果见图9,RE 对胰岛素通路和自噬基因的影响见图10。

图9 RE 对雌性果蝇溶酶体荧光强度的影响及定量结果Fig.9 Effect of RE on fluorescence intensity of lysosome and the number of lysosomes in female drosophila

图10 RE 对胰岛素通路和自噬基因的影响Fig.10 Effects of RE on insulin pathway and autophagy gene
自噬是代谢稳态的强大启动子,通过降解脂质过氧化、受损细胞器和病原体来维持稳态并防止退行性疾病[29]。自噬可调节肠道屏障防御、防止肠道菌群失衡,并在维持肠道稳态中发挥特定的作用[30]。为了研究RE 延长果蝇寿命的作用是否与激活自噬有关,通过溶酶体染色分析了RE 处理是否会导致自噬体和溶酶体的增加。研究发现,RE 处理之后肠道中自噬小体以剂量依赖性的方式增加(图9)。Real-time PCR 结果显示,1.5 mg/mL RE 处 理 后,Atg-1、Atg-5、Atg-8a 和Atg-8b 等自噬相关基因分别增加了67.21%、43.16%、53.23%(P<0.01)和45.07%(P<0.05)(图10)。因此,以上结果表明RE 激活了自噬途径。
在线虫、果蝇和哺乳动物中,抑制胰岛素途径中与衰老密切相关的关键基因或蛋白可以有效延长寿命[31]。如图10 所示,用1.5 mg/mL RE 处理果蝇后,PI3k、Akt-1 和mTOR 的mRNA 表达水平分别降低了16.04%、52.14%和40.07%,表明RE 可能通过胰岛素信号通路调控寿命。
3 结论
添加一定剂量的RE 可以显著延长雌性果蝇寿命,减缓因衰老导致的运动能力的下降,增强抗应激能力,减少了衰老引起的肠道屏障功能障碍和肠道菌群失衡,抑制肠道前体细胞的异常增殖,维持肠道稳态。RE 治疗延长生命的可能机制是通过抑制胰岛素通路和激活雷帕霉素通路因子mTOR 来激活自噬通路,改善抗氧化能力和肠道失衡。研究结果为迷迭香功能产品的后续开发和应用提供了理论基础,但其确切机制尚不清楚,有待进一步探索。
