玉米角质和粉质胚乳的异木聚糖结构及酶解特性的研究
2022-08-05董晓慧李贺王可答王翠玲姜辉单大鹏金振国
董晓慧,李贺,王可答,王翠玲,姜辉,单大鹏,金振国
(1.黑龙江省农业科学院绥化分院,黑龙江 绥化 152000;2.绥化学院农业与水利工程学院,黑龙江 绥化 152000;3.黑龙江省农业科学院农产品质量安全研究所,黑龙江 哈尔滨 150000;4.黑龙江省农业科学院克山分院,黑龙江 齐齐哈尔 161000)
玉米作为世界上种植最广泛的谷物之一,每年生产量超10 亿吨。玉米籽粒品种可根据成熟时籽粒的外观主要分为硬粒型和马齿型。玉米籽粒因质地不同其用途也会有所不同。玉米除作为世界范围内广泛消费的主食外,其另一个主要用途是生产淀粉和淀粉衍生产品,例如葡萄糖浆和乙醇(生物燃料),同时作为动物饲料被广泛使用[1-3]。玉米籽粒主要由三部分组成:果皮、胚和胚乳。其中,玉米的经济价值和营养价值主要来自于胚乳,它也是玉米籽粒最主要的组成部分,占干重的80%~85%[4-5]。谷物中细胞壁多糖(cell wall polysaccharides,CWP)仅占5%~10%。CWP 在数量、组成和结构上具有很大的多样性。例如谷物果皮中富含细胞壁,而胚乳只含有少量的细胞壁,胚乳中CWP 含量较低,但因其水溶性、黏度和凝胶特性等功能较好,所以CWP 对食品加工、人类健康和动物营养的研究均具有较大的影响。在玉米籽粒中,多数关于CWP 的研究都集中在果皮,它在碾磨副产品(麸皮、玉米纤维胶)或玉米蒸煮废水中大量存在。这些副产物的主要成分是复杂的木聚糖,并且其中主链的木糖单元被侧链高度取代,这些侧链主要由阿拉伯糖组成,也含有木糖、半乳糖和葡萄糖醛酸。因此,副产物统称为异木聚糖(heteroxylans,HX)[6-9]。
目前,与关于水稻和小麦等谷物中CWP 的研究相比,玉米胚乳的CWP 很少受到关注。在玉米籽粒湿磨过程中,会分离出两种纤维,即粗纤维和细纤维。其中,粗纤维主要来自于果皮,而细纤维主要来自于胚乳。从细纤维组分中分离出具有复杂分支结构的HX,证实了玉米胚乳HX 的特性[10-13]。近几十年来,细胞壁降解酶被用于改善谷物的性能,主要用于小麦、大麦或黑麦。这些酶制剂的特点是木聚糖酶活性高,尽管玉米中CWP 含量较低,但同样能改善玉米的性能。因此,更好地了解玉米籽粒中的HX,对于了解酶解特性并使其在玉米营养应用中的合理化使用至关重要。已有的研究表明[14-16],玉米角质和粉质部分的蛋白质组成存在一定关系,这可能表明其他晶粒组分,特别是CWP 的组成也可能存在异质性。因此,为了更好地了解玉米中的细胞壁多糖,本文将从角质胚乳和粉质胚乳中分离出细胞壁组分,并分析其异木聚糖的结构表征,进而揭示细胞壁降解酶在玉米酶解中的作用。
1 材料与方法
1.1 材料与试剂
供试玉米:黑龙江省农业科学院绥化分院提供;角质胚乳:将玉米颗粒通过处理去除胚芽和麸皮,并将角质胚乳与其他部分分离,收集备用;粉质胚乳:其作为粗粒生产线的副产品采集备用。
1.2 仪器与设备
Millipore-Q 密理博超纯水仪:美国MILLIPORE 公司;VBF 型玉米脱胚机:佐竹机械(苏州)有限公司;AZ100M 尼康多功能变焦显微镜:尼康仪器(上海)有限公司;G3S 形态粒度分析仪:马尔文帕纳科有限公司;Misonix Sonicator-4000 超声仪:美国Misonix 公司;AL104 电子天平:梅特勒-托利多仪器有限公司;JULABO SW23 振荡恒温水浴槽:优莱博技术(北京)有限公司;Optima XPN 超高速离心机:美国贝克曼库尔特有限公司;Skalar San++连续流动分析仪:荷兰Skalar分析仪器公司;NicoletiS50 傅立叶变换红外光谱仪:赛默飞世尔科技(中国)有限公司;PerkinElmer 气相色谱仪:铂金埃尔默股份有限公司;Agilent 1260 Infinity II 高效液相色谱仪:安捷伦科技(中国)有限公司;C18 色谱柱(Lichrospher 100 RP-18e,5 μm,250 mm×4 mm):德国默克集团;Dionex ICS 3000 离子色谱仪:美国戴安有限公司;Vario 元素分析仪:艾力蒙塔贸易(上海)有限公司;TGA 2050 TA 热重分析仪:美国TA 仪器公司;AVANCEIII HD-400 液体超导核磁共振谱仪:美国布鲁克道尔顿公司。
1.3 方法
1.3.1 形态粒度的测定
基于干法分析,使用特定的分散粉末(5 mg~20 mg),在30 ms 内施加多个分散压力(0.5、1.0、5.0 bar),然后沉降60 s。基于不同的透射光、放大倍数、图像之间重叠(40%)和142 个识别粒子的阈值,观察并记录4 个20 mm2的表面区域的分析结果。检测记录结束后,对记录的图像进行过滤与分析,以确定颗粒的形态特性以及相关的数量和体积分布。最后基于Morphologi 软件分析出颗粒的统计数据。
1.3.2 细胞壁组分的提取
将角质胚乳和粉质胚乳的原始样品进行过筛处理。该提取方法在角质胚乳的基础上进行优化[15]。为了更有效地去除淀粉和蛋白质,分离出细胞壁中的所需组分,需经过不同提取方法的优化试验,最终确定最佳方法。将400 g 角质胚乳悬浮于2 L 的Tris-HCl 缓冲液(50 mmol/L,pH7.8)中,该缓冲溶液含有150 mmol/L NaCl、2 mmol/L 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)和1% Triton,并在4 ℃下振荡1 h。将混合物高速离心(12 000 r/min、20 min)。过滤后将沉淀用离子水洗涤3 次,在室温(20 ℃)下将其悬浮在1 L 的2%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)中1 h,再次离心和过滤。用去离子水再次洗涤沉淀部分,将该组分悬浮在去离子水中并将pH 值调节至7,然后用蛋白酶(2 mL)在55 ℃下处理2 h 并过滤,然后在95 ℃下用耐高温淀粉酶(800 μL)处理2 h,此时pH 值调节至6。将混合物热洗两次并过滤。在相同条件下进行淀粉的二次处理,以提高淀粉的溶解效果。固体部分用去离子水洗涤5 次,然后进行冷冻干燥以收集从角质胚乳中得到的细胞壁组分(Vi-CW)。对于粉质胚乳的提取,在SDS 步骤中使用超声辅助处理,功率38 W,时间为1 min。为避免温度过高应将样品置于冰浴中。后续步骤如上,最终收集从粉质胚乳中得到的细胞壁组分(Fl-CW)。
1.3.3 异木聚糖的分离与纯化
在95 ℃下从Vi-CW 和Fl-CW 中提取HX,在1.5 mmol/L 的KOH 溶液中提取2h。用盐酸中和上清液,基于去离子水透析法处理后10 000 r/min 离心2 min,将上清液冷冻干燥。碱性提取物中的HX 可通过阴离子交换层析法进行纯化,将100 mg 碱性提取物溶解在4 mL 去离子水中。以2 mL/min 的流速用去离子水(3倍柱体积)进行洗脱以回收未结合组分。结合部分的多糖用0~1 mol/L 的NaCl 溶液(3 倍柱体积)进行线性梯度洗脱。洗脱过程的监测采用糖醛酸比色法测定。将梯度洗脱的组分浓缩,用去离子水透析法处理后冷冻干燥,留存备用。
1.3.4 细胞壁组分的酶解
将Vi-CW 和Fl-CW 悬浮在超纯水中,并加入多酶制剂。在2 mL 悬浮液中HX 含量为10 mg,pH 值约为4.5,即在该酶制剂中主要存在的木聚糖酶的最佳pH值范围内[17]。对于10 mg HX,在1 U~10 U 范围内检测酶活并进行优化,最终确定5 U 即可达到溶解需求。因此,反应培养基在40 ℃下加入5 U 酶制剂进行孵育12 h。通过离心(10 000 r/min、2 min)收集上清液,沸水浴5 min 使酶失活,留存备用。
1.3.5 理化特性的分析
基于2 mg 样品与120 mg KBr 混合制成的KBr 颗粒进行傅立叶变换红外吸收(Fourier transform infrared reflection,FTIR)光谱分析。光谱在4 000 cm-1~700 cm-1区域内以2 cm-1的间隔透射模式进行测定。红外光谱是由200 个干涉图的共加产生的,基于软件OPUS 7.0版对2 000 cm-1~700 cm-1区域内的所有红外光谱进行基线校正和单位矢量标准化。本文中所有独立重复试验次数均为3 次,且所有试验的相对标准偏差均小于5%。用含有12.5 mmol/L 四硼酸钠和18 mol/L 浓硫酸水解样品后测定糖醛酸的含量,然后通过水解产物的衍生物进行比色。样品在25 ℃下12 mol/L 硫酸溶液中预水解30 min,然后在100 ℃下1 mol/L 的硫酸溶液中水解2 h,以确定中性糖的组成。将水解后产物进行还原并乙酰化后通过气相色谱法测定糖醇乙酸酯,并加入肌醇作为内标,使用DB225 色谱柱,以H2为载气,温度设定为205 ℃。考虑到样品中的多糖形式,最终测定结果以无水糖表示。乙酰酯在0.5 mol/L NaOH 中脱酯化后,以异丙醇作内标基于高效液相色谱(high performance liquid chromatography,HPLC)法进行测定。在15 ℃恒温条件下使用4 mmol/L 硫酸溶液以1 mL/min的流速进行洗脱。以3,4,5-三甲氧基-反式-肉桂酸作为内标物,阿魏酸(ferulic acid,FA)在2 mol/L NaOH 中脱酯后基于HPLC-DAD 法进行分析。用pH4.6 的乙腈/乙酸盐缓冲液梯度洗脱,流速为1 mL/min。基于美国分析化学协会(Association of Official Analytical Chemists,AOAC)的检测方法对淀粉进行定量。使用高效阴离子交换色谱-脉动电流探测法(high performance anion exchange chromatography-pulsed amperometric detector,HPAEC-PAD)代替酶测定法进行葡萄糖的定量分析。配备CarboPac PA1 色谱柱,恒温25 ℃,并以1 mL/min的流速用0.1 mol/L NaOH 进行洗脱。通过元素分析仪对所含氮进行测定,再进行换算得到蛋白质的含量[18]。灰分采用热重分析仪以10 ℃/min 的温度速率升高直至550 ℃进行分析测定。
1.3.6 高效尺寸排阻色谱法
基于高效尺寸排阻色谱(high-performance size-exclusion chromatography,HPSEC)法分析分子量和特性黏度。将样品溶解于0.05 mol/L 硝酸钠溶液中,在沸水浴中加热后过滤,吸取50 μL 样液通过自动进样器进样,并在室温(20 ℃)下以0.7 mL/min 的速率用0.05 mol/L 硝酸钠溶液洗脱。折射率增量(dn/dc)为0.147 mL/g,使用软件Omnisec 4.5 计算分子量以及特性黏度。
1.3.7 异木聚糖的结构表征
基于已有研究[19]的基础上改进甲基化方法测定单糖的组成。HX 样品包括:粉质胚乳中纯化的异木聚糖(pFl-HX)、角质胚乳中纯化的异木聚糖(pVi-HX)和麸皮中提取的异木聚糖(Bran-HX)。将1 mg 干燥样品溶解在1 mL 二甲基亚砜(dimethyl sulfoxide,DMSO)中,加热至80 ℃并保持该温度直至样品完全溶解。将溶液超声2 min 后冷却。将5%NaOH 加入到DMSO 溶液中,加入0.5 mL 碘甲烷后,将溶液涡旋并超声10 min后逐步加入2 mL 去离子水以终止甲基化反应。将2 mL 三氯甲烷加入溶液中,在8 000 r/min 条件下离心5 min。弃去水相,再洗涤有机相3 次,在每次涡旋和离心之前加入4 mL 去离子水。使有机相在室温(20 ℃)下蒸发完全,然后用2 mol/L 三氟乙酰基(trifluoroacetyl,TFA)在120 ℃下水解2 h。将转化后的糖醇乙酸酯通过气相色谱法进行测定。将Bran-HX 作为对照组,并对溶解在重水中的HX 样品进行1H-NMR 光谱分析。
2 结果与分析
2.1 不同胚乳及其细胞壁组分的表征特性
角质和粉质胚乳及其细胞壁组分的形态粒度图像见图1。

图1 角质和粉质胚乳及其细胞壁组分的形态粒度图像Fig.1 Macroscope view of vitreous and floury endosperm and morpho-granulometric analysis of the extracted cell wall particles
角质胚乳和粉质胚乳均来自于硬粒型玉米颗粒。由图1A 可知,两者均含有大量的单个淀粉粒和黑色簇状的淀粉粒。只有角质胚乳显示出存在粗糙的颗粒,在377 nm 处的紫外观察确定其为糊粉层碎片[20]。角质胚乳、粉质胚乳、Vi-CW 和Fl-CW 的化学组分见表1。
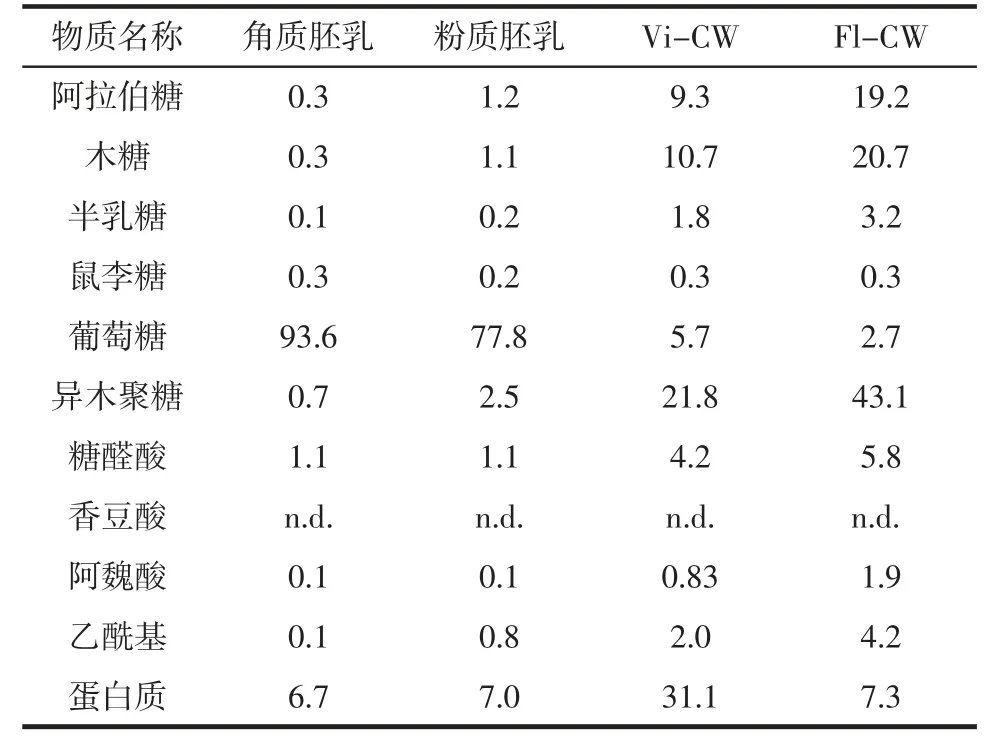
表1 角质胚乳、粉质胚乳、Vi-CW 和Fl-CW 的化学组分Table 1 Chemical components of vitreous endosperm,floury endosperm,Vi-CW and Fl-CW%
由表1 可知,对于角质胚乳和粉质胚乳总糖的质量百分比分别为95.7%和81.6%。通过Triton 和SDS两个预处理步骤,使用蛋白酶进行一次处理和耐高温淀粉酶两次连续处理,以达到去除蛋白质和淀粉的目的。通过计算可知,来自角质胚乳的细胞壁部分(Vi-CW)和来自粉质胚乳的细胞壁部分(Fl-CW)的产率分别为1%和3%。从粉质胚乳中提取的细胞壁组分虽然比角质胚乳的产率高,但与从其他谷物(小麦、黑麦或大麦)中提取相比仍然具有一定的困难。这可能是玉米胚乳中细胞壁的含量较低或角质胚乳的致密性导致的。
基于已有研究,在玉米麸皮中描述的HX 成分分析,HX 含量计算为阿拉伯糖、木糖和半乳糖的总和[21-22]。在比较不同样品中HX 的含量时,HX 只占原材料的较小部分,并且在粉质胚乳(2.5%)中含量比在角质胚乳(0.7%)中更高,说明其含量在粉质胚乳细胞壁中较高。角质胚乳和粉质胚乳中Ara/Xyl 的值分别为1 和1.1。这与已有相关研究[8]的从19 株玉米籽粒中手工分离得到的胚乳组织中糖醛酸的平均含量为1.1%和Ara/Xyl 比值为1.2 的分析结果基本吻合。少量Rha 的存在说明胚乳也含有半乳糖醛酸,并在细胞壁中形成少量的果胶。表1 中所示的糖醛酸含量包括半乳糖醛酸和葡萄糖醛酸,因此在计算细胞壁中的HX 含量时并未考虑两者的含量。在角质胚乳和粉质胚乳中蛋白质含量相当。为了能够更好地提取HX 应尽可能多地去除蛋白质和淀粉。
2.2 Vi-CW 和Fl-CW 的理化特性
通过3 种不同分散压力测定Vi-CW 和Fl-CW 的颗粒形态。此检测技术可对每个粒子进行详细分析,进而对试验结果进行统计学分析。结合图1B 可知,每次分析观察到的粒子数量在5.5 万~42.0 万。可观察到Vi-CW 和Fl-CW 两者均带有明显的粗颗粒和细颗粒。Vi-CW 和Fl-CW 的形态粒度参数见表2。

表2 Vi-CW 和Fl-CW 的形态粒度参数Table 2 Morphological granularity parameters of Vi-CW andFl-CW
由表2 可知,尽管两者经过相同的理化处理,但是平均直径d(1,0)略有不同。Vi-CW 的平均直径小于Fl-CW,当分散压力增加到5.0 bar 时平均直径明显下降。尤其是对于含有较大颗粒的Fl-CW,其直径下降了30%,而Vi-CW 的直径下降了20%。虽然两者体积分布的平均直径d(4,3)几乎无差别,但这与分散压力无关。Vi-CW 和Fl-CW 的数量分布与体积分布见图2。
图2 的分布曲线表明,细颗粒是受分散条件影响的主要物质。观察到纵横比接近0.65,所以可以评估出其约为“球体”模型,通过每个粒子的周长和面积可计算出比表面积。总交换表面可以通过细颗粒在0.5 bar条件下的平均比表面积来估算,可观察到Fl-CW 的比表面积小于Vi-CW。
Vi-CW 和Fl-CW 的化学组分还包括中性糖和酸性糖、香豆酸和阿魏酸、乙酰基和蛋白质。葡萄糖仍然存在于两者之中,但是考虑到Vi-CW 和Fl-CW 的产率,基于初始胚乳换算后Vi-CW 和Fl-CW 中存在的葡萄糖含量分别为0.06%和0.10%,这体现了淀粉酶处理的效率较好,说明99.9%的淀粉已被除去。在Fl-CW 中未检测到残留的淀粉,而在Vi-CW 中仍有少量残留的淀粉,表明该细胞壁部分含有混合键β-葡聚糖[23]。Vi-CW 的HX 含量为21.8%,几乎达到了Fl-CW(43.1%)的一半,但HX 在Fl-CW 中的分离率更高。以木糖含量为基础,分别计算阿拉伯糖、木糖和半乳糖的摩尔比,此可作为HX 化学结构的指标。Vi-CW 的值分别为0.87、1.00 和0.14;Fl-CW 的值分别为0.93、1.00 和0.13。两者的木糖和半乳糖的数值接近,Fl-CW 中阿拉伯糖比Vi-CW 高,因此两者的HX 之间侧链分布会略有不同。由表1 还可知,在Vi-CW 和Fl-CW 中糖醛酸含量分别为4.2%和5.8%,说明葡萄糖醛酸与HX 的侧链有关。然而,少量鼠李糖的存在说明存在果胶,从而伴随着半乳糖醛酸的存在。而阿魏酸基本上均与HX的阿拉伯糖残基相关[4,8]。乙酰基的存在说明在木糖残基上有支链。此外4 种待测样品中均未检测到香豆酸。
基于FTIR 光谱法对Vi-CW 和Fl-CW 进行分析,结果见图3。
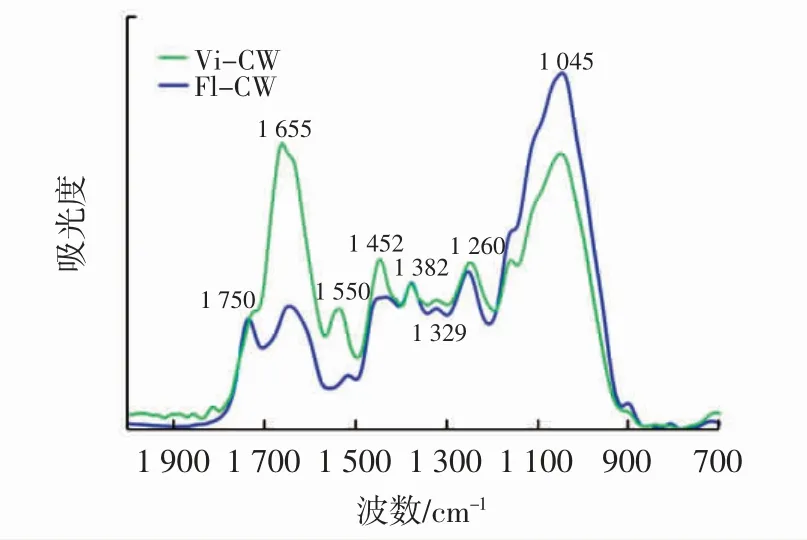
图3 Vi-CW 和Fl-CW 的红外光谱图Fig.3 FT-IR spectra of the Vi-CW and Fl-CW
由图3 可知,在1 045 cm-1处的峰表明C-O 和CC 的拉伸,并且HX 的糖苷键(C-O-C)可由1 260 cm-1处的条带表示。由(C=O,N-H)和(C-N,N-H)键导致的在1 550 cm-1和1 655 cm-1处的吸收可归因于蛋白质的存在,并证实了蛋白质在提取过程中没有被完全消除。在1 655 cm-1处,Fl-CW 的蛋白峰强度比Vi-CW 低很多,说明Fl-CW 的蛋白质含量更低。在1 452、1 382、1 329 cm-1和1 260 cm-1处的4 个小峰代表了C-H 和C-O 的弯曲或拉伸作用。在1 750 cm-1和1 260 cm-1处可见的两个尖锐峰可归因于酯键作用,其可能与酚酯和乙酰基的存在有关。尽管在预试验中使用了不同去除蛋白质的方法,但最佳处理方法仍会使Vi-CW 中含有超过31%的蛋白质。这与红外光谱分析结果一致。而对于Fl-CW 的蛋白质去除效果更为明显,其蛋白质含量仅为7.3%。这意味着Fl-CW 的蛋白质比Vi-CW的蛋白质更容易被蛋白酶水解。
2.3 异木聚糖的分离与纯化
不同异木聚糖的化学组成见表3。
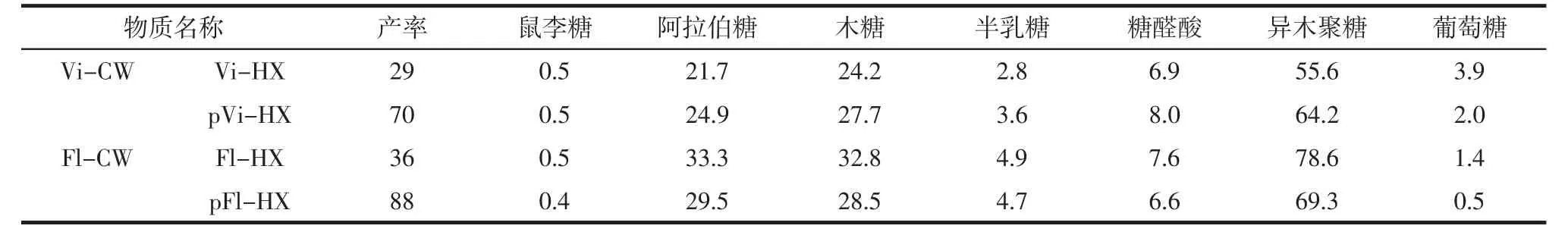
表3 不同异木聚糖的化学组成Table 3 Chemical composition of different heteroxylan%
Vi-HX 和Fl-HX 分别表示从Vi-CW 和Fl-CW中分离得到的异木聚糖;pVi-HX 和pFl-HX 分别表示从Vi-CW 和Fl-CW 中分离并通过阴离子交换色谱法纯化的异木聚糖。由表3 可知,基于优化后的提取方法Fl-CW 的HX 产率高于Vi-CW。然而,阿拉伯糖、木糖和半乳糖的各自摩尔比,在Vi-HX 中分别为0.90、1和0.10;在Fl-HX 中分别为1.02、1 和0.12。此结果表明,分离出的聚合物组成接近但并不相同。通过对Vi-CW 和Fl-CW 中各摩尔比值的比较分析,可知在碱性分离过程中一部分半乳糖损失,特别是在Vi-HX 中,半乳糖和鼠李糖产率低于异木聚糖且损失占比相似,说明损失掉的鼠李糖和半乳糖来源于相同的多糖,据此可推断出果胶可能被部分去除。所以,考虑到提取后异木聚糖中鼠李糖的含量较低,所以在表3 中糖醛酸被包含在异木聚糖的组分中。使用阴离子交换色谱法进一步纯化的HX 化学组成,得到Vi-HX 和Fl-HX 的趋势相似。以葡萄糖和游离糖醛酸组成的非结合组分分别占Vi-HX 和Fl-HX 负载材料的1.1%和2.2%。Vi-HX用0.2 mol/L 氯化钠、Fl-HX 用0.15 mol/L 氯化钠洗脱主要结合部分。由表3 中糖组分可知,纯化后HX 中阿拉伯糖、木糖和半乳糖的各自摩尔比几乎无变化,说明纯化的HX 主要是在葡萄糖中被损失掉的。
2.4 pVi-HX 和pFl-HX 的结构表征
pVi-CW 和pFl-CW 的HPSEC 谱图见图4。
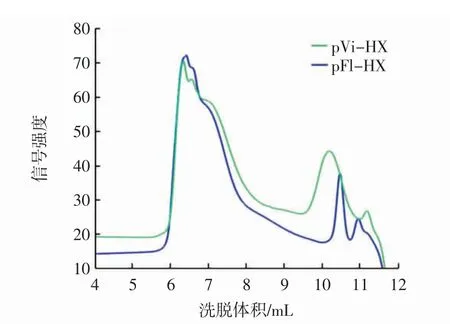
图4 pVi-CW 和pFl-CW 的HPSEC 谱图Fig.4 HPSEC spectra of the pVi-CW and pFl-CW
如图4 所示,高效尺寸排阻色谱显示出pVi-HX和pFl-HX 这两个纯化组分的曲线相似,主峰在6.4 mL处洗脱。两种组分都非常分散,在超过10 mL 时又出现了小峰。pVi-HX 和pFl-HX 的这些峰的固有黏度相似,分别为241 mL/g 和242 mL/g。结果表明,两种多糖组分在溶液中的体积相似,高于先前报道的从玉米麸皮中提取的HX 值(170 mL/g~180 mL/g)[21]。
异木聚糖组分中存在的中性糖的糖苷键组成见表4。
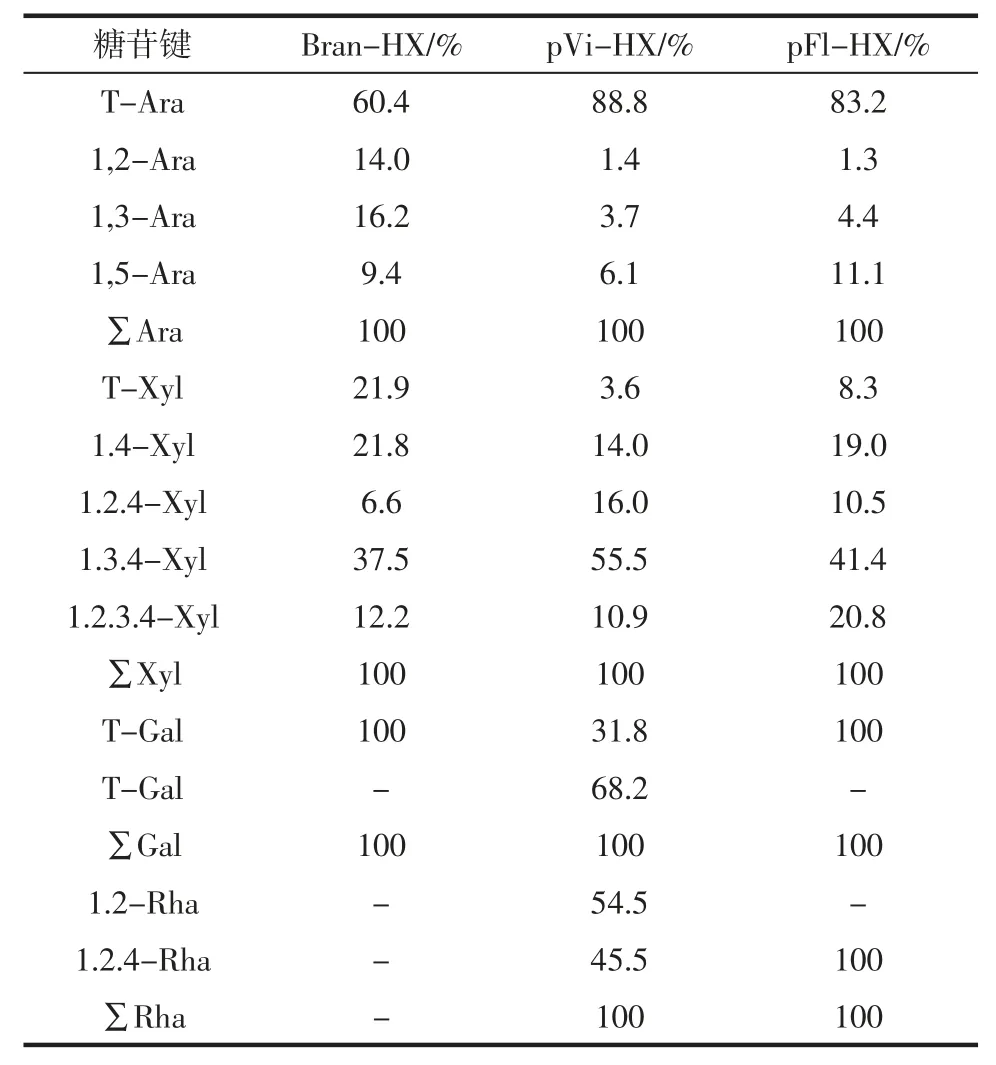
表4 异木聚糖组分中存在的中性糖的糖苷键组成Table 4 Glycosidic-linkage composition of neutral sugars present in HX fractions
通过甲基化和1H-NMR 光谱法进一步分析pVi-HX 和pFl-HX 结构的糖苷键组成,将玉米麸皮中分离的HX 作为对照组进行比较分析[24-25]。由表4 可知,多糖pFl-HX 和pVi-HX 表现出基于木聚糖复杂结构的相似性,但在木聚糖主干的取代上却存在差异性。由于pFl-HX 具有较高的Ara/Xyl 比值,因此未取代的1,4-木糖残基的比例应低于其他两个样品。pVi-HX和Bran-HX 均具有较低的Ara/Xyl 比值,这一特征可能是由于Vi-HX 单基取代木糖主链具有较高比例。然而,大部分木糖在Bran-HX 中被检测为末端残基,因此可能是单侧链或更复杂的侧链包括阿拉伯糖残基。通过1,2-Ara、1,3-Ara 和1,5-Ara 残基能够证明阿拉伯糖对Bran-HX 中复杂侧链的影响,而阿拉伯糖在pFl-HX 和pVi-HX 中基本以单末端残基形式存在。除与木聚糖主要的链分布和阿拉伯糖取代相关的主要结构特征外,1,2,4-鼠李糖通过甲基化分析证实了少量与pFl-HX 和pVi-HX 相关的果胶聚合物的存在。半乳糖被认为是复合物HX 中短侧链的末端残基,所以仅在pVi-HX 中检测到半乳糖的末端残基,说明短的半乳糖链或作为果胶侧链或作为HX 侧链。
通过1H-NMR 光谱可进一步证实木糖主链的不同取代模式。5.1~5.6 范围内的峰主要对应于在木糖骨架上分支的阿拉伯呋喃糖残基的异头质子的化学位移。该区域显示出的多个共振峰证明了取代模式的复杂性。Vi-HX 和Fl-HX 的核磁共振光谱虽然不相似但很接近,但与Bran-HX 光谱相比表现出明显不同的特征。单个阿拉伯糖残基在单/双基取代木糖残基上的异位质子的化学位移如图5 所示。
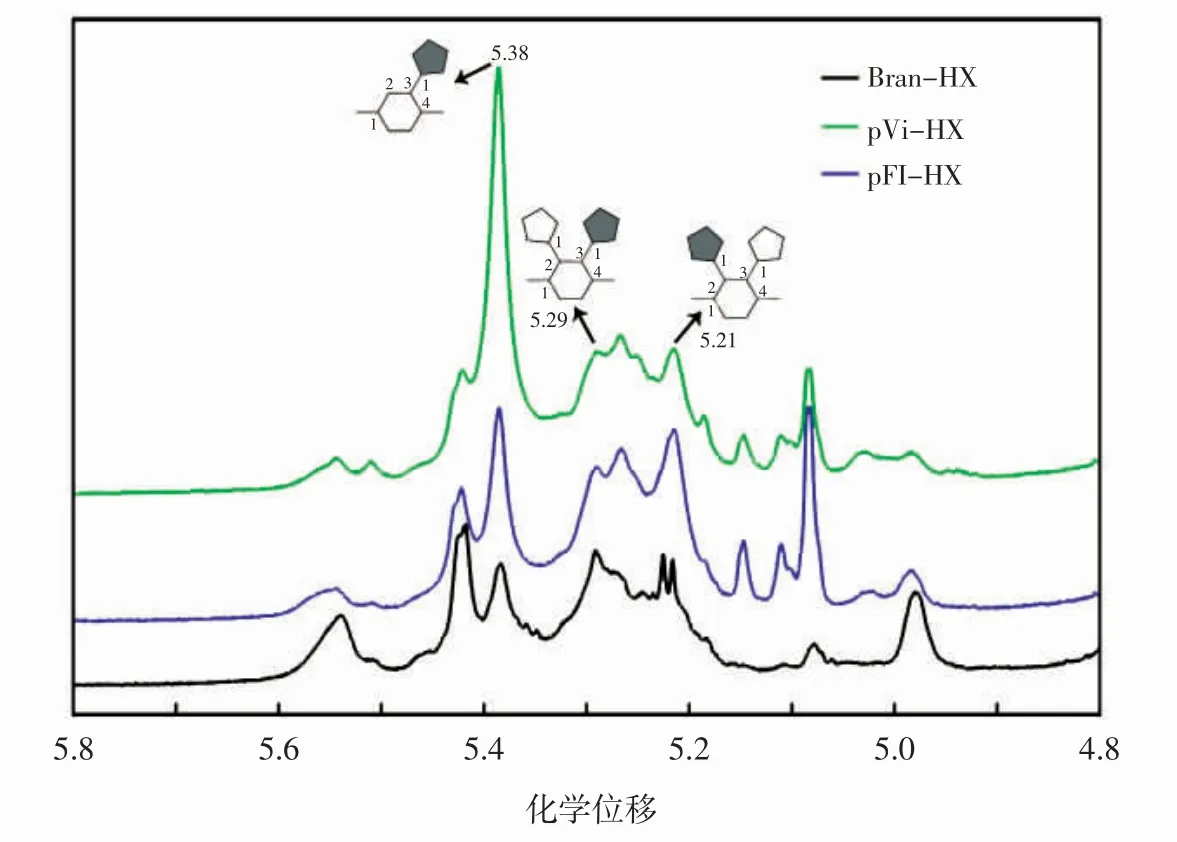
图5 Bran-HX、pVi-CW 和pFl-CW 的1H-NMR 表征图谱Fig.5 Characterisation of Bran-HX,pVi-CW and pFl-CW by 1H-NMR
由图5 可知,基于位置2 或3 被阿拉伯糖连续取代木糖残基,位置3 单基取代(5.38)的阿拉伯糖残基的化学位移可上下移动[26-27]。因此,根据聚合物中阿拉伯糖连续取代木糖残基的程度,在5.38 附近可观察到峰展宽。在木糖残基的位置2(5.21)和3(5.29)上作为双取代存在的阿拉伯糖的异头质子也可观察到类似的峰展宽。只有在5.38 处的峰值可以确定阿拉伯糖残基在1,4-木糖残基的位置3 上的单基取代。该峰值的相对比例在Vi-HX 中比在Fl-HX 中更明显,而Bran-HX 中明显最小,说明Bran-HX 中存在更复杂的分支模式和侧链分布。在1H-NMR 光谱中Vi-HX 的1,3,4-木糖的比例较高,可得出单基取代率更高,此结果与甲基化结果一致。
2.5 细胞壁组分的酶解特性
通过木聚糖酶和阿拉伯呋喃糖苷酶对分离的胚乳细胞壁进行降解,进一步研究玉米在高价值产品转化过程中胚乳细胞壁的酶降解特性,结果见表5。
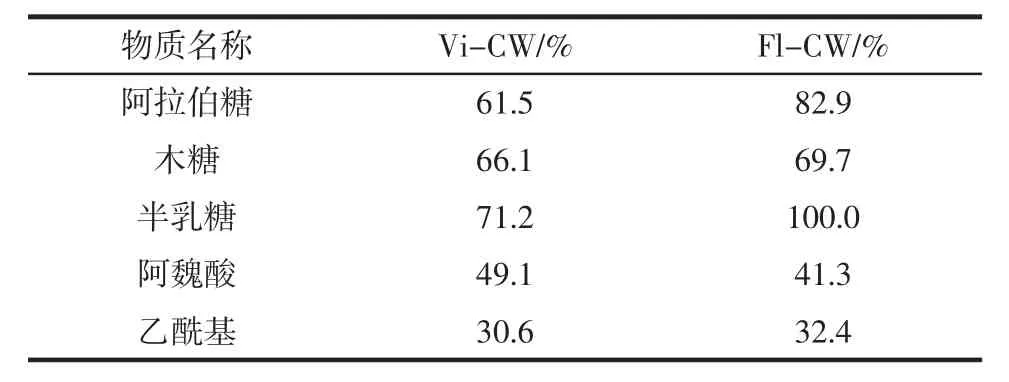
表5 Vi-CW 和Fl-CW 中糖组分的酶促降解Table 5 Enzymatic degradation of sugar components in Vi-CW and Fl-CW
如表5 所示,降解后进行定量测定并分析其糖组分。对于Vi-CW 和Fl-CW 的可溶性总糖分别占原质量的15.5%和40.8%,且对粉质胚乳比角质胚乳的作用更有效。通过形态粒度测定法确定的比表面积值表明Vi-CW 和Fl-CW 的值非常接近。可溶性糖含量与Vi-CW(21.8%)、Fl-CW(43.1%)中HX 的含量有关。这表明Fl-CW 中的HX 比Vi-CW 更容易被酶解。两种组分的酶敏感性不同可能与化学结构或HX 与各自细胞壁组分中其他组分的相互作用有关[28]。
Vi-CW 和Fl-CW 组分中大部分阿拉伯糖和木糖被溶解,这与结构分析(甲基化和NMR)有关。结果表明,Fl-HX 中单基取代和未取代木糖的比例高于Vi-HX,导致Fl-HX 更容易酶解。从Vi-CW 中溶解的半乳糖初始含量为71.2%,而半乳糖从Fl-CW 中则完全溶解(100%)。此结果说明Fl-CW 更易被降解,并且半乳糖取代物在Vi-CW 和Fl-CW 的HX 中位置不同,例如在Vi-HX 中仅存在1,4-半乳糖。阿魏酸和乙酰基的溶解率低于糖类,这表明未降解部分比降解部分更富含这些取代基,因此这些取代基会导致部分HX难以水解[29-30]。本研究是在细胞壁上进行降解,而结构分析是针对分离后的异木聚糖进行,或许会存在差异。然而,通过计算可知提取后异木聚糖的回收率达到了90%以上,确保了所研究的HX 代表了细胞壁中存在的HX。从角质胚乳和粉质胚乳中分离出的HX存在轻微的结构差异,涉及木糖单基取代率、侧链中阿拉伯糖和半乳糖的含量以及半乳糖的位置,也能够解释酶制剂对粉状胚乳效率较高的原因。
3 结论
本研究从玉米的角质胚乳和粉质胚乳中成功分离提取了异木聚糖组分,同时进行特性表征的分析,表明它们与麸皮中的HX 有所不同。因为Vi-HX 比Fl-HX 含有更多的单取代木糖,在角质和粉质胚乳的HX 中可观察到支化度存在差异,而这些差异参与调节了每个组分的酶敏感性。由玉米胚乳中异木聚糖的结构表征分析可知,酶制剂中添加的木聚糖酶和阿拉伯呋喃水解酶可能会提高木糖的产率。由于木糖更容易被肠道微生物群代谢,会对机体的生长性能产生有利影响。所以,本研究可有效靶向玉米颗粒的酶促降解,有助于酶制剂的开发与应用。
