醉茄素A对金黄色葡萄球菌肺炎小鼠的抗炎作用
2022-08-05徐芳张海泉卢春凤张振林
徐芳,张海泉,卢春凤,张振林
(珠海市人民医院检验科,珠海 519000)
金黄色葡萄球菌是一种普遍存在的人畜共患病病原体,属革兰阳性球菌,为院内感染的常见病原菌之一[1],可引起或诱发机体多种严重感染,如化脓性感染[2]、肺炎[3]、肠炎[4]及感染性心内膜炎[5]等,甚至能导致脓毒血症的发生[6]。金黄色葡萄球菌肺炎是最常见的金黄色葡萄球菌介导的疾病之一,且死亡率高。鉴于目前多重耐药金黄色葡萄球菌菌株的流行,特别是耐甲氧西林金黄色葡萄球菌菌株的广泛存在[7],使得金黄色葡萄球菌感染的治疗变得越来越难。因此,迫切需要对这种病原体造成的疾病的新的治疗策略。
醉茄素A(withaferin A,WFA)是南非醉茄的主要生物活性成分之一,具有如抗氧化、抗炎、抗血管生成、抗肿瘤、抗微生物和促凋亡等广泛的药理活性[8-11]。然而,WFA 是否具有抗金黄色葡萄球菌肺炎作用及其具体机制尚不清楚。因此,本研究利用金黄色葡萄球菌肺炎小鼠模型探讨WFA对金黄色葡萄球菌肺炎的治疗作用及相关机制。
材料与方法
1 动物和菌株
30只C57BL/6小鼠(SPF级,雄性,5~6周龄,体重18~20g)购自珠海百试通生物科技有限公司[SCXK(粤)2020-0051]。小鼠饲养于珠海市人民医院动物实验平台的温度(22±2)℃、湿度(60±5)%和12 h/12 h明暗循环的动物房,5只/笼,每3~5 d 更换笼内垫料1次,自由饮食饮水,适应性饲养5 d后进行实验。金黄色葡萄球菌标准菌株ATCC25923购自广东环凯微生物科技有限公司。
2 主要试剂
WFA(#HY-N2065)和二甲基亚砜(dimethyl sulfoxide,DMSO;#HY-Y0320)购自美国MedChemEXpress公司;苏木精(#H104304)和伊红(#E196384)购自上海阿拉丁生化科技股份有限公司;通用SP检测试剂盒(#SP0041)购自北京索莱宝科技有限公司;小鼠抗CD177单克隆抗体(#sc-376329)购自美国Santa Cruz公司;DAPI(#D807022)购自上海麦克林生化科技有限公司;FITC标记羊抗小鼠IgG抗体(#BL0901)购自北京百奥莱博科技有限公司;小鼠IFN-γ(#BK0081)、IL-6(#BK0252)、TNF-α(#BK0170)和IL-1β(#BK0095)ELISA试剂盒、兔抗Cleaved Caspase-1抗体(#BS1730)和兔抗凋亡相关斑点样蛋白(apoptosis-associated speck-like proteincontain a CARD,ASC)抗体(#BS72573)购自南京巴傲得生物科技有限公司;兔抗含NLR家族Pyrin域蛋白3(NLR family Pyrin domain containing protein 3,NLRP3)抗体(#29125)和HRP偶联羊抗兔IgG(#L3012)购自美国Signalway antibody公司;BCA蛋白浓度定量分析试剂盒(#LD0174)、兔抗GAPDH抗体(#AF1186)和增强ECL发光试剂盒(#LD0183)购自广州赖德生物技术有限公司。
3 动物分组、造模及WFA治疗处理
将30只小鼠随机分为对照组(Con组)、模型组(Model组)及WFA治疗组(Model+WFA组),每组10只。用0.5%戊巴比妥钠腹腔注射(0.1 mL/10 g)麻醉小鼠,对照组经鼻滴入20 μL生理盐水,其它两组均经鼻注入20 μL金黄色葡萄球菌悬液(含菌量为5×106菌落形成单位)[12]。WFA以DMSO助溶,配制成10 mg/mL贮存液,给药时将贮存液混于生理盐水,稀释为200 μg/mL工作液。Model+WFA组小鼠在造模后,每日腹腔注射5 mg/kg WFA ,连续应用7 d;其余两组每日注射等量含2% DMSO的无菌生理盐水,连续应用7 d。7 d后,麻醉小鼠,打开胸腔,用PBS灌洗支气管并收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)后,处死小鼠并分离肺。
4 肺组织含水量检测
取左侧肺脏用滤纸吸干表面水分,称取湿重,然后将其置于烘箱中烘烤72 h至样本完全脱水,称取肺脏干重。计算肺组织的湿重与干重比值(wet weight/dry weight,W/D),其比值反映肺组织的含水量,提示肺水肿的程度。
5 苏木精-伊红染色
将小鼠右肺组织使用4%的甲醛固定,石蜡包埋,然后切为8 μm厚的连续切片。选取每组第6层切片行苏木精- 伊红(HE)染色,光学显微镜下以40倍物镜观察并采集图像。
6 BALF中细胞计数
BALF以600 r/min离心5 min,将沉淀的细胞悬浮在2 mL PBS中,用细胞计数板对细胞计数。此外,收集上清液以备后续检测。
7 BALF中IFN-γ、IL-6、TNF-α和IL-1β水平检测
取BALF上清液,根据ELISA试剂盒说明书,对3组大鼠BALF进行IL-1β、IL-6、IL-10以及TNFα测定。
8 免疫组织化学染色
CD177免疫荧光染色:肺组织切片用二甲苯脱蜡和梯度递减的乙醇复水后,用柠檬酸缓冲液高温进行抗原修复,用10%羊血清在室温封闭30 min,然后用中性粒细胞标记物CD177抗体(1:500)在37℃下孵育1 h,PBS洗涤2 min×3次,用FITC标记羊抗小鼠IgG(1:500)在37 ℃下孵育30 min,再次洗涤切片,DAPI(5 μg/mL)染核2 min,并在荧光显微镜下以20倍物镜观察并采集图像。CD177阳性细胞数提示中性粒细胞浸润数量。
NLRP3 SP法染色:根据SP试剂盒说明书,肺组织切片用二甲苯脱蜡和梯度递减的乙醇复水后,3%H2O2室温处理10 min,用柠檬酸缓冲液高温进行抗原修复,用10%正常羊血清在室温封闭30 min,然后用抗NLRP3抗体(1:400)在37 ℃下孵育1.5 h,PBS洗涤2 min×3次,生物素化羊抗兔IgG(1:400)37℃下孵育30 min,PBS洗涤2 min×3次,用链霉亲和素过氧化物酶(1:1000)在37 ℃下孵育30 min,PBS洗涤2 min×3次,DAB显色5 min,苏木精复染。在光学显微镜下以40倍物镜观察并采集图像。
9 Western blot
RIPA裂解液提取小鼠肺脏组织的蛋白并用BCA蛋白浓度定量分析试剂盒定量蛋白浓度。每个样品取20 μg蛋白加入上样缓冲液后置于沸水中变性3 min,然后进行10% SDS-PAGE电泳。将电泳分离的蛋白以湿法电转(电流:200 mA,电转时间:90 min)至PVDF膜。用5%脱脂牛奶进行非特异性结合位点封闭(室温30 min),1:1000稀释的抗NLRP3、ASC、cleaved Caspase-1和1:5000稀释的抗GAPDH一抗4 ℃分别孵育过夜。以TBST洗涤5 min×3次后,室温孵育1:1000稀释的HRP偶联羊抗兔IgG 1 h,以TBST洗涤5 min×3次后,ECL发光液中显影,并利用Chemi Scope 3300 Mini型化学发光成像仪(上海勤翔科学仪器有限公司)采集条带图像和分析条带光密度值。蛋白相对表达水平以目的蛋白条带光密度值/GAPDH光密度值×100%表示。
10 统计学分析
采用SPSS21.0软件进行统计分析。计量资料用均数±标准差表示,用单因素方差分析事后检验对组间均数进行两两比较,P<0.05认为有统计学意义
结果
1 WFA减轻金黄色葡萄球菌肺炎小鼠肺组织形态改变、肺含水量和BALF中细胞数的增加
HE染色观察显示,模型组小鼠肺组织出现肺泡壁增厚、肺泡和间质炎性细胞浸润、出血和肺泡渗出液,而WFA治疗组小鼠上述病理表现明显减轻(图1A)。对肺组织的W/D比率测定显示,模型组小鼠W/D比率较对照组明显增高,而WFA治疗组小鼠肺组织W/D比率较模型组明显下降,但仍高于对照组(图1B)。对BALF中细胞计数显示,模型组小鼠BALF中的细胞总数显著高于对照组,而WFA治疗组小鼠BALF中的细胞总数较模型组相比显著下降,但仍高于对照组(图1C)。
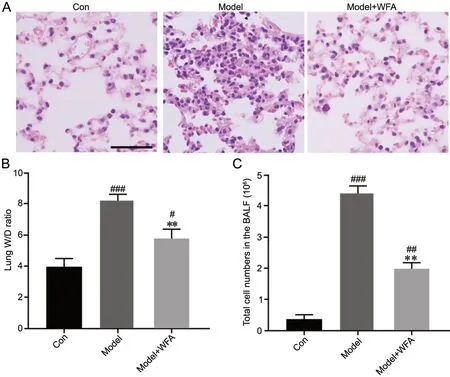
图1 WFA对金黄色葡萄球菌肺炎小鼠的肺组织形态学改变、肺含水量以及BALF中细胞数的影响。A,肺组织HE染色代表性图像(比例尺,100μm);B,肺组织W/D比率统计学分析;C,BALF中细胞数量统计学分析。与Con组相比,#P<0.05,##P<0.01,###P<0.001;与Model组相比,**P<0.01;n=10Fig. 1 Effect of WFA on the histopathological change of lung tissues, lung water content and cell amount in the Staphylococcus aureus pneumonia mice BALF. A, representative images of HE staining of lung tissues (scale bar, 100μm); B, statistical analysis of lung tissue W/D ratios; C, statistical analysis of cell amount in BALF. Compared with Con group: #P<0.05, ##P<0.01, ###P<0.001; compared with Model group: **P<0.01; n=10
2 WFA降低金黄色葡萄球菌肺炎小鼠BALF中促炎细胞因子
对3组小鼠BALF中炎症因子IFN-γ、IL-6、TNFα和IL-1β进行测定,结果显示,与对照组相比,模型组小鼠BALF中IFN-γ、IL-6、TNF-α和IL-1β显著升高,而与模型组相比,WFA治疗组BALF中上述炎症因子显著降低,但仍高于对照组(图2)。
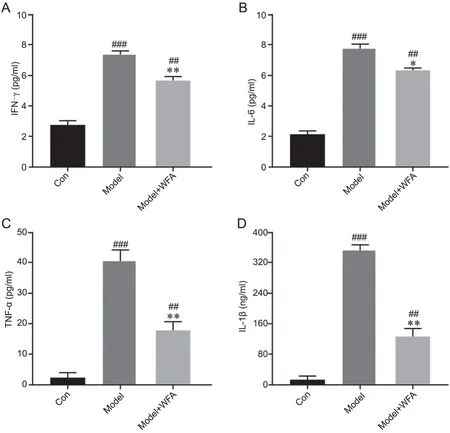
图2 小鼠BALF中炎症因子IFN-γ(A)、IL-6(B)、TNF-α(C)和IL-1β(D)水平的统计学分析。与Con组 相 比,##P<0.01,###P<0.001;与Model组 相 比,*P <0.05, **P<0.01;n=10Fig. 2 Statistical analysis of the level of inflammatory cytokines IFN-γ (A), IL-6(B), TNF-α (C) and IL-1β (D) in mice BALF. Compared with Con group: ##P<0.01, ###P<0.001; compared with Model group: *P <0.05, **P<0.01; n=10
3 WFA减轻金黄色葡萄球菌肺炎小鼠肺组织中性粒细胞浸润
用中性粒细胞标志物CD177对3组小鼠肺组织中性粒细胞浸润程度进行检测。结果显示,与对照组相比,模型组小鼠肺组织中CD177阳性细胞明显增多,而WFA治疗组小鼠CD177阳性细胞较模型组显著减少,但仍高于对照组(图3),表明WFA治疗组小鼠肺组织中性粒细胞募集受到一定程度的抑制。
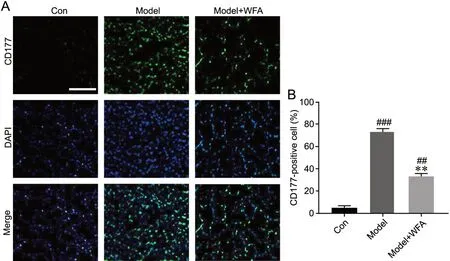
图3 WFA对金黄色葡萄球菌肺炎小鼠肺组织中性粒细胞募集的影响。A,小鼠肺组织中性粒细胞募集的代表性CD177免疫荧光染色检测(例尺,100 μm);B,CD177阳性细胞数量统计学分析;与Con组相比,##P<0.01,###P<0.001;与Model组相比,**P<0.01;n=8Fig. 3 Effect of WFA on neutrophil recruitment in the lung tissues of Staphylococcus aureus pneumonia mice. A, representative CD177 immunofluorescence staining of neutrophil recruitment in lung tissues (scale bar, 100 μm); B, statistical analysis of the number of CD177-positive cells in lung tissues; compared with Con group: ##P<0.01, ###P<0.001; compared with Model group: **P<0.01; n=8
4 WFA抑制金黄色葡萄球菌肺炎小鼠肺组织中NLRP3炎症小体通路活化
对3组小鼠肺组织NLRP3进行免疫组织化学检测(NLRP3阳性显示为棕色颗粒)显示,对照组仅少量着色且染色浅,模型组呈现大面积NLRP3阳性染色且染色深,而WFA治疗组小鼠肺组织中阳性信号较模型组低(图4A);Western blot检测肺组织中NLRP3炎症小体的主要成员NLRP3、ASC、cleaved caspase-1水平显示,与模型组相比,WFA治疗组小鼠肺组织中NLRP3、ASC和cleaved caspase-1蛋白表达水平明显降低,但仍高于对照组(图4B—E),说明WFA可抑制金黄色葡萄球菌肺炎小鼠肺组织中NLRP3炎症小体激活。
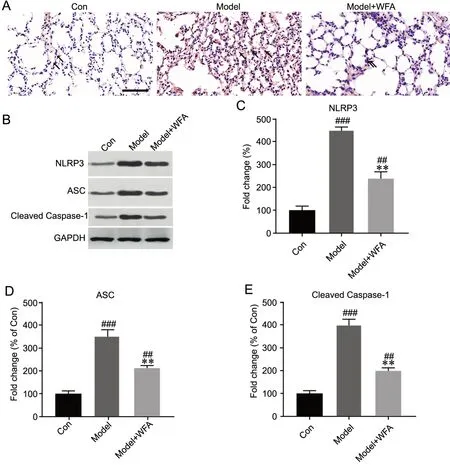
图4 WFA抑制金黄色葡萄球菌肺炎小鼠肺组织中NLRP3炎症小体激活。A,小鼠肺组织NLRP3表达的代表性免疫组织化学检测(比例尺,100 μm)。B—E,小鼠肺组织中NLRP3、ASC和cleaved Caspase-1水平的Western blot检测与统计学分析;与Con组相比,#P<0.05,##P<0.01,###P<0.001;与Model组相比,**P<0.01;n=6Fig. 4 WFA inhibited NLRP3 inflammasome activation in the lung tissues of Staphylococcus aureus pneumonia mice. A, representative immunohistochemical staining of NLRP3 expression in lung tissues (scale bar, 100 μm); B to E, Western blot detection and statistical analysis of the level of NLRP3, ASC and cleaved Caspase-1 in lung tissues; compared with Con group: #P<0.05, ##P<0.01, ###P<0.001; compared with Model group: **P<0.01; n=6
讨论
金黄色葡萄球菌肺炎属于肺炎中较重的一种,尽管目前医疗技术不断发展,但其仍具有较高的死亡率和发病率,抗炎及改善免疫是治疗金黄色葡萄球菌肺炎最核心的手段。WFA从药用植物南非醉茄的叶子、浆果和根茎中分离提取得到的甾体内酯,已被证实具有显著抗炎和调节免疫作用[9]。本实验结果提示WFA对金黄色葡萄球菌肺炎小鼠有很好的抗炎作用并改善金黄色葡萄球菌肺炎小鼠肺组织病理形态学改变,提示WFA可能也是潜在的金黄色葡萄球菌肺炎的治疗药物。
肺炎通常伴随着免疫系统的过度激活,其特征是在肺泡腔中炎性细胞和蛋白质液体增加[13]。肺泡毛细血管屏障急性损伤可使其通透性增加,导致富含蛋白质的渗出性水肿[14]。此外,IFN-γ、IL-6、TNF-α和IL-1β是多功能细胞因子,在局部和全身水平上参与炎症和免疫反应[15]。这些促炎细胞因子可导致严重的金黄色葡萄球菌肺炎的肺损伤[16]。WFA治疗后的金黄色葡萄球菌肺炎小鼠BALF中细胞数目及促炎细胞因子均减少并且肺组织中中性粒细胞浸润程度减轻,这表明WFA可抑制炎症免疫反应过度激活。
NLRP3炎症小体在炎症和先天免疫中具有重要和突出的作用[17]。已有研究[18-20]表明,金黄色葡萄球菌肺炎的肺组织中伴随NLRP3炎症小体的过度激活,且NLRP3炎症小体的过度激活能加重肺损伤,而减弱NLRP3炎症小体活性能降低肺损伤。在本研究中,WFA治疗后金黄色葡萄球菌肺炎小鼠肺组织中NLRP3炎症小体激活受到显著抑制。
综上所述,WFA可改善金黄色葡萄球菌肺炎小鼠的症状并降低炎症反应和NLRP3炎症小体活化。
