低氧浓度促进人牙髓干细胞增殖及神经分化
2022-08-05张浩高淑君武沐洋李睿宁肖培伦于树娜王晓莉王凡涛
张浩,高淑君,武沐洋,李睿宁,肖培伦,于树娜,王晓莉,王凡涛
(潍坊医学院,1口腔医学院,2医学影像学院,3基础医学院,潍坊 261053;4兰州大学第二临床医学院,兰州 730000)
人牙髓干细胞(human Dental pulp stem cells,hDPSCs)是从牙髓组织中分离出的一种外胚层来源的成体干细胞[1],与神经干细胞来源胚层相同,具有较强的增殖能力,且体外可诱导分化为神经元,修复脑损伤。因此,hDPSCs备受人们关注[2]。目前,体外培养细胞多在常氧(21% O2)下进行,而正常人体组织内平均氧浓度仅为5%[3],且人体不同组织氧浓度也存在较大差异,人脑组织中氧浓度为 3%~8%。不同氧浓度对hDPSCs的影响、是否低浓度氧更有利于hDPSCs的增殖及其神经分化目前均尚不清楚[4]。鉴于hDPSCs是治疗脑损伤性疾病的重要干细胞来源[5],若能体外预处理hDPSCs,提高其增殖及神经诱导潜能,将可最大限度发挥hDPSCs的临床效能。本研究采用EdU免疫荧光染色法及CCK-8法观察不同氧浓度(1%、5%、10% 和 21%)培养hDPSCs对其增殖及细胞活性的影响,并诱导其向神经元分化,确定hDPSCs体外增殖及神经分化诱导的最佳条件,以期为hDPSCs移植治疗脑损伤性疾病的临床应用提供科学的理论依据。
材料与方法
1 主要实验试剂及仪器
DMEM 培养液(HyClone,美国);胎牛血清(Gibco,美国);I型胶原酶、分散酶(Sigma,美国);CD34、CD90 单克隆抗体(北京博奥森生物技术有限公司);CD146单克隆抗体(武汉三鹰生物技术有限公司);巢蛋白(nestin) 单克隆抗体(ABclonal,美国);山羊抗兔 IgG 荧光二抗(北京中杉金桥生物技术有限公司);含DAPI的防淬灭荧光封片剂(Sigma,美国);kFluor488-Click-iT EdU试剂盒(江苏凯基生物技术股份有限公司);CCK-8试剂盒(上海七海复泰生物科技有限公司);EGF(PeproTech,美国);bFGF(MCE,美国);B27(Gibco,美国);正置相差显微镜(日本OLYMPUS 公司);酶标仪(美国Thermo公司);三气培养箱(美国Thermo公司)。
2 hDPSCs 体外分离、培养及分组
临床上收集拔除完整的智齿,供体年龄在16~20岁,牙齿拔除后将其放入预冷的含5%双抗的培养液中,4 h内运回实验室,用含 5%双抗的0.01 mol/L PBS反复冲洗,无菌条件下取出牙髓,并将牙髓组织剪碎为1 mm3大小。将组织移入1.5 mL EP管中,加入20倍消化酶(3 mg/mL I型胶原酶和4 mg/mL分散酶),置于37 °C环境下消化15 min,将消化后的组织块接种到培养瓶中,加入4 mL含体积分数 20%胎牛血清的DMEM培养液,放入37 ℃、5% CO2培养箱中,4 h后翻瓶;5 d换液1次,当原代细胞铺满瓶底80%~90%时,进行消化、传代,并将传代的 hDPSCs 采用随机数字表法分为实验组(1% O2组、5% O2组、10% O2组)与对照组(21% O2组)。
3 hDPSCs 表面标记物的免疫荧光鉴定
取对数生长期的 hDPSCs,调整细胞浓度为 4×104个/mL,接种于24孔板中,置于37 ℃、5% CO2培养箱中,细胞贴壁后,4%多聚甲醛固定细胞。爬片分别加入兔抗CD34(1:300)、CD90(1:300)和 CD146(1:300)一抗,4℃ 孵育过夜;次日,洗涤后加入 Alexa Fluor 488标记的山羊抗兔IgG 荧光二抗(1:100),37 °C 避光孵育1 h,充分洗涤后,DAPI复染细胞核。每张爬片随机取5个视野,正置荧光显微镜下观察、拍照。
4 EdU试剂盒检测hDPSCs增殖
取对数生长期的hDPSCs,调整细胞浓度为2×104个/ml接种于24孔板,置于 37℃、5% CO2培养箱中,细胞贴壁后,将孔板放入三气培养箱,设置氧浓度为 1% O2、5% O2、10% O2和 21% O2,分别培养6 h、24 h、72 h后,加入50 μmol/L的EdU,孵育1 h,DAPI复染细胞核。每张爬片随机取5个视野,正置荧光显微镜下观察、拍照,并计数EdU阳性细胞数。
5 CCK-8试剂检测hDPSCs活性
取对数生长期hDPSCs,调整细胞浓度为4×104个/mL接种于96孔板,置于37 ℃、5%CO2培养箱中,细胞贴壁后,将孔板放入三气培养箱,设置氧浓度为 1% O2、5% O2、10% O2和21% O2,每组6个复孔,培养24 h后每孔滴加10μL CCK-8溶液,放入培养箱孵育2 h,酶标仪测定450 nm处吸光度(Optical Density,OD)值,比较各组hDPSCs活性。
6 hDPSCs神经诱导后形态学观察
取对数生长期的hDPSCs,调整细胞浓度为2×105个/mL接种于培养瓶中,置于37 ℃、5% CO2培养箱中,细胞生长达到80%~90%融合后进行神经诱导,去掉原先培养液,加入神经诱导液(DMEM加入20 ng/mL EGF、20 ng/mL bFGF、20% B27),放入三气培养箱,分别设定氧浓度为1%、5%、10%和21%,每2 d 更换一次神经诱导液,培养5 d后取出细胞,每个培养瓶随机取5个视野,相差倒置显微镜下观察、拍照,并通过Image J软件自动计算细胞数目,测量每个细胞突起数目。突起测量和计算方法:以具有突起的细胞胞体为圆心,画一个半径为20 μm的圆,将其直接连接在细胞体上,与此圆的交点数量定义为突起的数量[6]。
7 Nestin 免疫荧光染色
取对数生长期的hDPSCs,调整细胞浓度为2×104个/mL接种于孔板中,同前进行神经诱导,培养5 d后取出细胞,同前进行免疫荧光染色,加入兔抗nestin(1:500)一抗,4℃孵育过夜,次日,加入山羊抗兔荧光二抗(1:100),37 °C 避光孵育1 h,DAPI复染细胞核。每张爬片随机取 5个视野,正置荧光显微镜下观察、拍照,并采用 Image J软件分析免疫荧光染色的荧光强度(平均光密度),以此代表Nestin免疫反应性(表达水平)。
8 统计学分析
采用SPSS 22.0 统计软件对数据进行统计学分析。所有计量资料采用均数±标准差(±s)表示,采用单因素方差分析,方差齐性资料,组间两两比较采用SNK-q检验,P<0.05 为差异具有统计学意义。
结果
1 体外培养 hDPSCs 的形态学
牙髓组织经过组织块酶消化法培养5 d后,在光学显微镜下可见组织块边缘有梭形样细胞游出,呈放射状或漩涡状,排列有序,透光性好。细胞达到 80%~90% 汇合后,进行消化传代,相差倒置显微镜下观察,传代后的细胞成梭形,部分细胞为多边形(图1)。
2 hDPSCs的鉴定
CD34、CD90、CD146免疫荧光细胞化学染色结果示,培养的hDPSCs免疫荧光染色后,间充质干细胞标志物 CD90、CD146均呈阳性,细胞浆染为绿色,细胞核染为蓝色,即CD90+DAPI+、CD146+DAPI+,培养的hDPSCs不表达造血干细胞表面标志物CD34,仅可见染为蓝色的细胞核,即CD34-DAPI+(图1)。
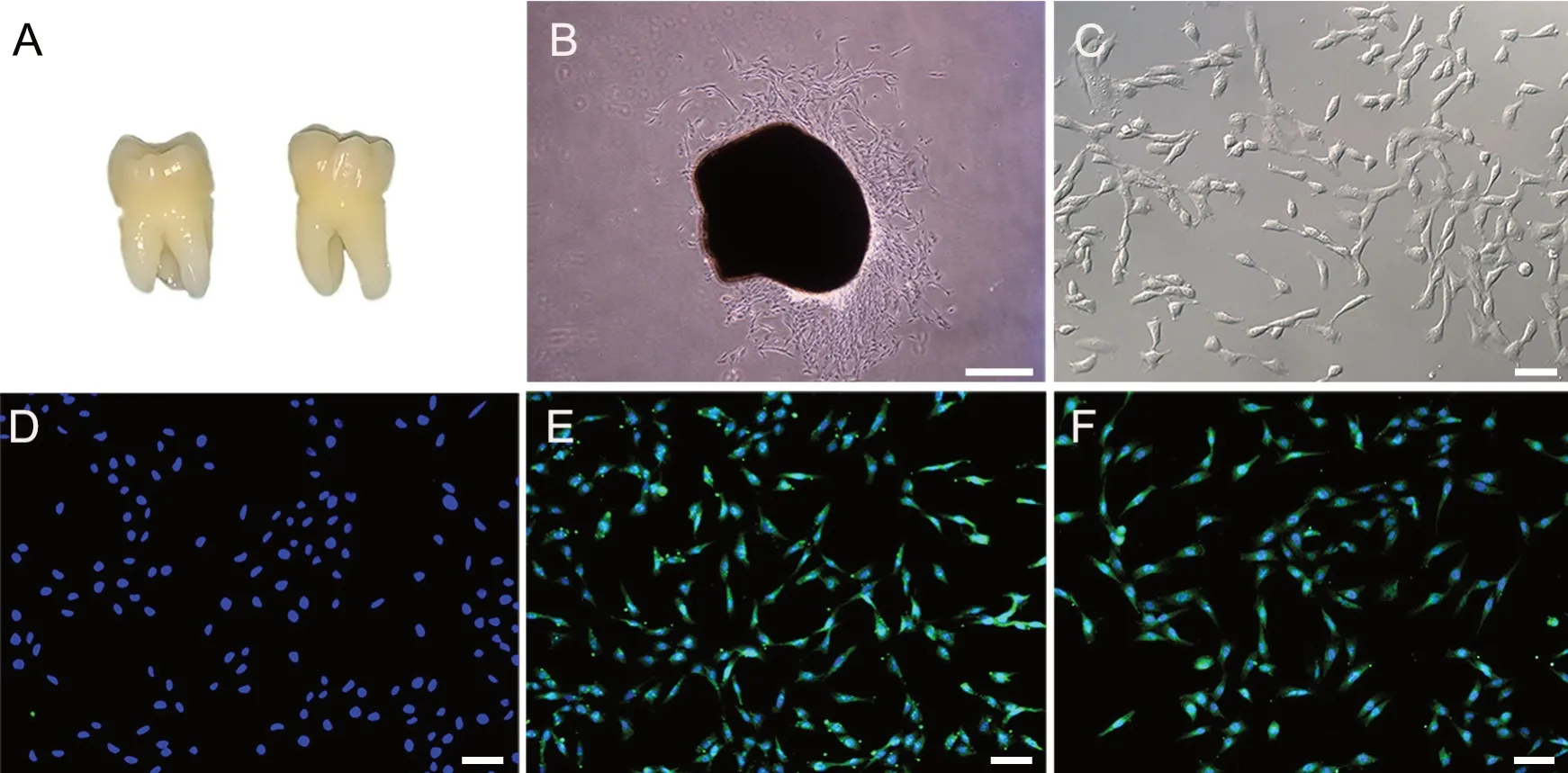
图1 hDPSCs的分离、培养与鉴定。 A,新鲜拔除的智齿;B,组织块边缘爬出的hDPSCs,细胞呈放射状沿组织块四周游出(比例尺,200 μm);C,第3代 hDPSCs呈长梭形或多角形(比例尺,50 μm);D,hDPSCs CD34阴性(比例尺,50 μm);E,hDPSCs CD90阳性(比例尺,50 μm);F,hDPSCs CD146阳性(比例尺,50 μm)Fig.1 Isolation, culture and identification of hDPSCs. A, freshly removed wisdom teeth. B, hDPSCs that grew out of the edge of the tissue block, the cells spread radially around the tissue block; scale bar, 200 μm. C, hDPSCs of the third generation appearing long spindle or polygonal; scale bar, 50 μm; D, hDPSCs negative for CD34(scale bar, 50 μm). E, hDPSCs positivel for CD90, scale bar, 50 μm. F, hDPSCs positive for CD146, scale bar, 50 μm
3 5% O2增强hDPSCs增殖作用最强
EdU染色显示:hDPSCs体外培养6 h时,各组hDPSCs增殖率无显著差异;培养24 h时,5% O2组hDPSCs增殖率显著高于21% O2组,1% O2、10% O2组hDPSCs增殖率亦显著高于21% O2组,但低于5% O2组;培养72 h 时,5% O2组hDPSCs增殖率于显著高于21% O2组,1% O2和10% O2组hDPSCs增殖率与21% O2组差别不显著(图2,表1)。
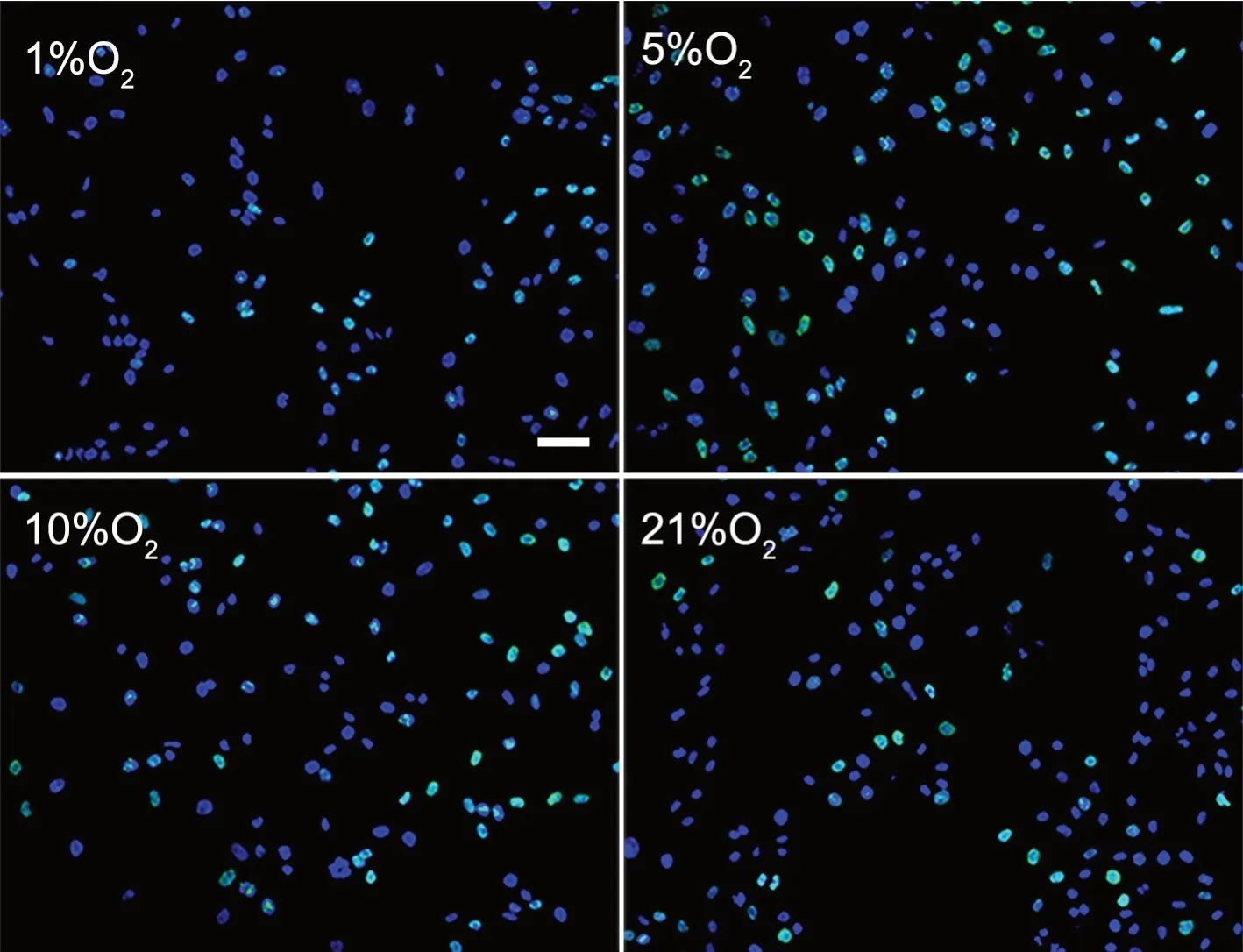
图2 不同氧浓度下对hDPSCs增殖影响的EdU染色检测。hDPSCs培养24 h;DAPI复染细胞核;比例尺,50μmFig. 2 EdU staining for effects of different oxygen concentrations on the proliferation of hDPSCs. hDPSCs cultured for 24 h; nuclear counterstaining with DAPI; scale bar, 50 μm

表1 不同氧浓度对人牙髓干细胞增殖率的影响Tab. 1 Effect of different oxygen cencentration on proliferation rates of human dental pulp stem cells
4 5% O2增强hDPSCs活力作用最强
CCK-8法检测显示:体外培养24 h,1% O2组hDPSCs活力显著低于21% O2组,5% O2组细胞活力显著高于21% O2组,而10% O2组与21% O2组细胞活力无显著差异(图3)。
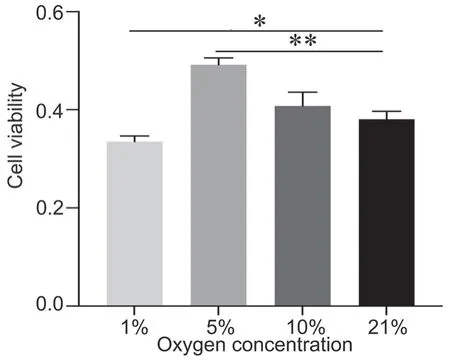
图3 不同氧浓度对hDPSCs细胞活力影响的CCK-8 法检测。hDPSCs 培养24 h;*P<0.05;**P<0.01Fig. 3 CCK-8 assay of the effect of different oxygen concentrations on the cell viability of the hDPSCs. hDPSCs cultured for 24 h; *P < 0.05, **P < 0.01
5 5% O2最显著促进hDPSCs神经诱导形态学变化
加入神经诱导液诱导5 d后,各组细胞胞体均变圆,折光度增强,细胞呈现双极或多极突起,突起细、长,末端分叉,呈典型的神经元样形态。其中,5% O2组神经诱导后的hDPSCs突起最多,最细长,细胞间触角有连接,并显著多于 1% O2、10% O2及21% O2组,1% O2、10% O2组突起数量显著多于 21% O2组,且10% O2组突起数量显著多于 1% O2组(图4)。
6 5% O2 上调hDPSCs神经诱导后Nestin 表达最显著
神经诱导5 d后,各组均可见大量Nestin免疫反应阳性细胞,1% O2、5% O2及 10% O2组Nestin免疫反应性均显著强于21% O2组,且5% O2组Nestin免疫反应性显著强于1% O2及 10% O2组,10% O2组Nestin免疫反应性亦显著强于1% O2组(图4)。

图4 不同氧浓度对hDPSCs神经诱导5 d后形态及nestin表达的影响。A—D,神经诱导5 d后hDPSCs形态;A,1% O2;B,5% O2;C,10% O2;D,21% O2。E—H,神经诱导5 d后hDPSCs nestin免疫组织化学染色,DAPI复染细胞核;E,1% O2组;F,5% O2组;G,10% O2组;H,21% O2。比例尺,20 μm。I,突起数量比较。J,nestin免疫反应强度比较;*P<0.05,**P<0.01Fig. 4 The effect of different oxygen concentrations on the morphology and nestin expression in the hDPSCs after neural induction for 5 d. A to D, cell morphology of the hDPSCs after neural induction for 5 d; A, 1% O2; B, 5% O2; C, 10% O2; D, 21% O2. E to H, nestin immunofluorescence staining of the hDPSCs after neural induction for 5 d, nuclear counterstaining with DAPI; E, 1% O2; F, 5% O2; G, 10% O2 ; H, 21% O2. Scale bar, 20 μm. I, comparison of the number of neurites; J, *P<0.05, **P<0.01, compared with 21%O2 group; J, comparison of nestin immunoreactive intensity of the hDPSCs; *P<0.05, **P<0.01
讨论
目前干细胞移植技术在临床应用中,面临的关键制约因素是干细胞移植后存活率低,以及到达病损部位的细胞数量少,而且病损部位常常处于缺血缺氧状态。因此,通过体外预处理对维持移植后干细胞的生物特性显得格外重要[7]。尽管低氧对 hDPSCs 的影响已有报道,但hDPSCs最佳的低氧培养条件仍存在争议。本研究采用EdU免疫荧光染色法观察1%、5%、10%和21% 4个不同氧浓度检测低氧处理不同时间点对 hDPSCs增殖的影响,发现5% O2环境下明显促进hDPSCs增殖,且在24 h时最明显,这与Ahmed等的研究结论一致[8]。同时,本研究发现不同氧浓度下hDPSCs在不同时间点增殖速率有差异,氧浓度过高或过低都会导致增殖速率降低,而在 5% O2下细胞能够较长时间维持较高增殖速率,但具体调控机制尚不清楚。培养早期,各组细胞增殖速率未见显著差异,但此后生长迅速[9],在72 h时各组增殖速率均下降且差异不显著,其机制可能与细胞大量增殖,生长空间不足,细胞之间相互接触,产生接触抑制。
在常氧条件下培养的干细胞,可因其过早衰老、DNA损伤、染色体畸变和代谢变化等,导致细胞活性丧失[10,11],且在常氧环境下,培养的干细胞移植到体内,由于局部组织缺血缺氧,导致移植后的细胞出现大量凋亡[12]。有研究发现,低氧可以促进细胞HIF-1磷酸化,进而上调VEGF,激活PI3K/Akt通路增加细胞活性及血管通透[13],同时,抑制p53凋亡信号的表达,保护细胞免受氧自由基损伤[14,15]。本研究发现,在体外不同氧浓度培养hDPSCs,对其活性的影响是不同的,5% O2hDPSCs活性最好,而1%O2条件下,hDPSCs活性降低,10% O2条件下细胞活性高21% O2,由此可见适宜低氧浓度可以维持细胞活性,而在较低氧浓度或常氧条件下细胞活性下降。
hDPSCs 与神经系统具有共同的胚层起源,目前研究发现hDPSCs可以表达多种神经源性标记物,如nestin、神经丝、β -微管蛋白III等[16]。与常氧相比,低氧环境下培养牙乳头干细胞1周后,其神经发生相关基因(CNP、SNAIL、NSE、GDNF 和 NT3)的表达明显上调,细胞形态呈现一种类似神经元样,具有角形细胞体和神经突,一些细胞也可通过突触相互连接[17]。本研究中,低氧明显促进 hDPSCs神经向分化,在5% O2条件下,神经诱导后的 hDPSCs 出现双极或多极突起最多,突起细而长,末端具有分叉等典型的神经元样形态变化。同时,细胞免疫荧光检测发现,在5% O2下诱导的hDPSCs,其神经细胞相关特异性蛋白 Nestin的表达显著增强。因此,推测,低氧条件下能够促进hDPSCs神经分化,且 5% O2培养效果更佳。
综上所述,体外低氧培养能够促进hDPSCs增殖,提高细胞活性,并更易促进诱导神经分化,其中,在5% O2时更有利于维持hDPSCs的生物学特性及神经分化,从而为hDPSCs体内移植治疗脑损伤疾病提供科学的依据。
