牛磺脱氧胆酸引起内质网应激降低和减轻T2DM肝损伤
2022-08-05杨仕坤连俊波霍双杰倪璐宋慧茹温俊秀罗丹李双宋旭东门秀丽董丽儒
杨仕坤,连俊波,霍双杰,倪璐,宋慧茹,温俊秀,罗丹,李双,宋旭东,门秀丽,董丽儒
(华北理工大学附属医院,病理科,唐山 063000)
2型糖尿病(type 2 diabetes,T2DM)是当今世界上最严重的健康问题之一,2015年全球有4.15亿糖尿病患者,保守估计到2040年将达到6.42亿,然而几乎一半(49.7%)的糖尿病患者未得到明确诊断。糖尿病肝损伤(diabetic liver injury, DLI)是导致糖尿病患者死亡的主要原因之一,胰岛素抵抗和肝细胞内脂肪聚集是D2TM的重要特征之一。内质网是肝细胞脂质代谢的主要场所,当机体出现高脂血症和胰岛素抵抗时会破坏肝细胞内质网的稳态,诱导内质网应激(endoplasmic reticulum stress,ERS)。严重或长时间ERS可以引起其下游凋亡信号如JNK、CHOP及Caspase介导的凋亡路径持续激活,最终引起细胞功能受损或凋亡。内质网应激抑制剂牛磺脱氧胆酸(tauroursodeoxycholic acid, TUDCA)为结合型胆汁酸,是一种由牛磺酸和熊去氧胆酸组成的共轭胆汁酸,具有解痉、抗炎、抗惊厥及溶石作用[2]。TUDCA在体外和体内均可作为蛋白质折叠的分子伴侣发挥作用,但关于TUDCA对DLI的影响机制尚不完全清楚[3]。本研究利用瘦素受体(leptin receptor, LEP-R)基因纯合缺失突变(db/db)T2DM模型小鼠(db/m即lean小鼠为正常表型小鼠)[4,5],检测TUDCA对自发性T2DM模型小鼠肝细胞损伤的影响及机制,为预防DLI发生及发展提供实验依据。
材料与方法
1 实验动物
SPF级13周龄成年雌性瘦素受体纯合缺陷(db/db) T2DM模型小鼠和表型正常的雌性C57BL db/m(lean)小鼠,即(lepr-/m)小鼠各10只(北京美森生物医药科技有限公司,许可证编号:SCXK京2011-0012),体重分别为37~51 g和18~24 g。将两种小鼠随机分成溶剂对照组(Vehicle, VEH组)和TUDCA组,每天早、晚8点各给药1次,剂量为TUDCA 500 mg/kg,连续灌胃2周,VEH组采用同样方法给予同等体积生理盐水。
2 主要试剂
小鼠胰岛素酶联免疫检测试剂盒(Linco公司);即用型免疫组织化学二步法试剂盒、山羊超敏二步法试剂盒和DAB显色试剂盒(北京中杉金桥生物技术有限公司);葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)兔源多克隆抗体和C/EBP同源蛋白(C/EBP homologous protein,CHOP)兔源重组单克隆抗体(杭州华安生物公司);甘油明胶封片剂和PAS染色试剂盒(北京索莱宝科技有限公司);油红O试剂盒(河北瑞帕特生物科技有限公司);其余试剂均由华北理工大学附属医院病理科提供。
3 体重与生化指标检测
连续测量小鼠体重和空腹血糖的变化,14 d后经眼球取血,处死动物,留取血浆。全自动生化分析仪检测血浆中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC),血糖快速测定仪检测口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)水平,双抗体夹心酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定胰岛素水平、速率法测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)含量。
4 HE染色
各组小鼠的部分肝组织经10%中性甲醛固定后行石蜡包埋与切片、二甲苯脱蜡、下行酒精入水;苏木素染液染色3 min,流水冲洗后0.7%盐酸酒精分化液分化2~5 s,充分流水洗后反蓝5~10 min;0.5%~1%伊红染色20 s后,上行酒精脱水、二甲苯透明、中性树胶封固,光镜观察、拍照。
5 油红O染色
部分肝组织行冰冻切片后行油红O染色:切片用甲醛固定10min,蒸馏水洗3次,油红O稀释液(按油红饱和液和稀释液3:2稀释,静置10 min)染色15 min,避光,密封。60%异丙醇分色至无色,蒸馏水洗3次;苏木精复染细胞核,自来水洗反蓝3 min,蒸馏水洗,甘油明胶封片,光镜观察、拍照。
6 PAS染色
小鼠肝组织石蜡切片常规脱蜡至水,自来水冲洗2 min,再用蒸馏水浸洗 2次,置于氧化剂(高碘酸)中室温放置5~8 min;自来水冲洗1次,再用蒸馏水浸洗2次,入雪夫试剂中于室温暗处浸染10~20 min,自来水冲洗10 min;苏木素复染细胞核1~2 min,酸性分化液分化2~5 s,自来水冲洗10~15 min后,更换双蒸水,自来水反蓝;酒精脱水、二甲苯透明、中性树胶封固,光镜观察与拍照。
7 免疫组织化学染色分析
小鼠肝组织石蜡切片常规脱蜡至水,PBS浸洗3次,每次3 min;EDTA修复液(1:49)加入高压锅加热沸腾2.5 min。滴加适量的内源性过氧化物酶阻断剂,孵育15 min,PBS浸洗3次×3 min。正常山羊血清室温孵育15 min,倾去血清;抗GRP78(1:300)和抗CHOP (1:300)一抗(以PBS代替一抗作为阴性对照)4 ℃孵育过夜;常温复温30 min后PBS浸洗3 min×3次;生物素标记山羊抗小鼠/兔IgG,37 ℃孵育30 min,PBS浸洗3 min×3次;辣根过氧化物酶标记链霉卵白素工作液,室温孵育10 min,PBS浸洗3 min×3次;DAB显色,苏木素复染后分化反蓝,酒精脱水、二甲苯透明、中性树胶封片。高倍镜(40倍物镜)下每张切片随机选取5个高倍视野,应用Image-Pro plus 6.0软件对染色阳性物质表达部位和表达量进行图像分析。
8 统计学方法
应用SPSS23.0分析软件,所有计量资料以均数±标准差(±s)表示,各组间均数数据比较以单因素方差分析(analysis of variance,One-way ANOVA),两样本均数比较以独立样本t检验处理,以P<0.05为差异有统计学意义。
结果
1 TUDCA处理不影响db/db小鼠体重
对各组小鼠体重动态监测14 d显示:所有db/db小鼠各个时间点的体重均显著高于lean小鼠;TUDCA处理对db/db小鼠和lean小鼠的体重均无影响(图1)。

图1 TUDCA处理对db/db小鼠体重的影响。db/db+VEH 与 lean+VEH比较,*P < 0.05; db/db+TUD 与 lean+TUD 比较,#P < 0.05;n=5Fig.1 Effect of TUDCA treatment on the body weight of db/db mice. *P < 0.05, compared with lean+VEH; #P < 0.05, compared with lean+TUD; n=5
2 TUDCA减轻db/db 小鼠OGTT及血浆ALT和AST水平升高
生化分析检测显示,db/db+VEH组小鼠口服葡萄糖后血糖水平显著升高,且2 h内血糖未能降至口服葡萄糖前的水平;db/db+TUD组小鼠口服葡萄糖后血糖水平升高但不显著,2 h内血糖恢复至口服葡萄糖前的水平;lean+VEH组及lean+TUD组小鼠口服葡萄糖前后血糖仅有轻度变化,两组差异无统计学意义(图2)。
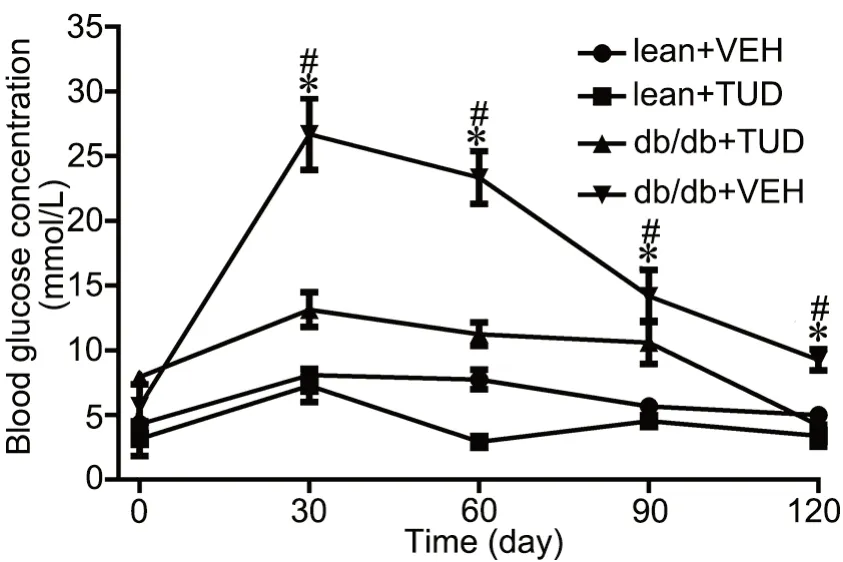
图2 TUDCA处理2周对db/db小鼠OGTT的影响。与 lean+VEH比较,*P<0.05 ;与db/db+TUD 比较,#P<0.05;n=5Fig. 2 Effect of TUDCA treatment for 2 weeks on OGTT of db/db mice . *P<0.05, compared with lean+VEH; #P<0.05, compared with db/db+TUD; n=5
与lean组相比, db/db+VEH组小鼠血清中TC、TG、ALT和 AST水平明显升高;与db/db+VEH组相比,db/db+TUD组血清TC、TG无明显差别,但db/db+TUD组血浆ALT及AST水平明显降低,但仍高于lean+VEH组和lean+TUD组(图 3);给药前后lean组小鼠血清TC、TG、ALT和AST水平无显著性差异。

图3 TUDCA处理对db/db小鼠血清TC、TG、ALT和AST水平的影响。与lean+VEH比较,*P<0.05 ;与db/db+TUD 比较,#P<0.05;n=5Fig. 3 Effect of TUDCA treatment for 2 weeks on serum levels of TC, TG, ALT and AST in db/db mice . *P<0.05, compared with lean+VEH; #P<0.05, compared with db/db+TUD; n=5
3 各组小鼠胰岛素水平变化
ELISA检测显示,db/db+VEH组小鼠胰岛素水平较lean+VEH组明显升高;以TUDCA(500 mg/kg)处理db/db小鼠2周后,其胰岛素水平较db/db+VEH组明显降低,但仍显著高于lean+VEH组和lean+TUD组(图4)。lean+TUD组给药前后胰岛素水平无明显差别。
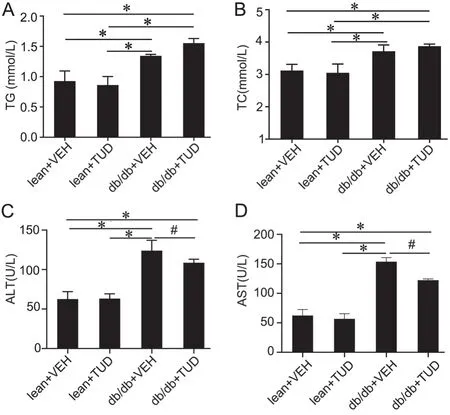
图4 TUDCA处理对db/db小鼠胰岛素水平的影响。与 lean+VEH比较,*P<0.05;与db/db+TUD 比较,#P<0.05;n=5Fig. 4 Effect of TUDCA treatment for 2 weeks on serum level of insulin in db/db mice. *P<0.05, compared with lean+VEH; #P<0.05, compared with db/db+TUD; n=5
4 TUDCA处理减轻db/db小鼠肝病理变化
HE染色显示,lean组小鼠肝细胞肝板间隔一致,肝血窦清晰可见;db/db+VEH组肝内可见散在或小灶状炎细胞浸润,肝板间隔不等,细胞排列紊乱,肝血窦受压变窄,肝细胞内可见互相融合的脂滴;给予TUD处理后肝细胞内脂滴减少,部分区域肝索结构清晰,肝窦间隙明显(图5)。

图5 TUDCA处理对db/db小鼠肝组织病理学影响的HE染色观察。db/db+VEH组,红色箭头示肝细胞脂肪变性,绿色箭头示肝细胞核肿胀,蓝色箭头示炎细胞浸润,黄色箭头示肝血窦受压变形;db/db+TUD组,红色箭头示肝细胞脂肪变性,黄色箭头示肝血窦可见,腔内含红细胞,部分肝索排列清晰,黑色箭头示肝小叶中央静脉,白色箭头示肝细胞水肿;比例尺,50 µmFig.5 HE staining observation on the effect of TUDCA treatment on histopathological changes of the db/db mice liver tissues. In the db/db+VEH group, red arrow shows hepatocyte steatosis, green arrow shows hepatocyte nuclei swelling, blue arrow shows inflammatory cell infiltration, yellow arrow shows extruded hepatic blood sinusoids. In the db/db+TUD group, red arrow shows hepatocyte steatosis, yellow arrow shows hepatic blood sinusoid with red blood cells in the lumen, some hepatocyte cords are clearly arranged, black arrow shows central vein of hepatic lobule, white arrow shows hepatocyte edema; scale bar, 50 µm
PAS染色显示,lean组可见肝细胞局灶性糖原颗粒少量表达,呈紫红色。与lean+VEH组比较,db/db+VEH组肝细胞胞浆内糖原颗粒明显增加,胞质呈紫红颗粒状着色,并可见核内糖原空洞形成;与db/db+VEH组相比,db/db+TUD组糖原颗粒减少,核内糖原空洞形成减轻(图6A)。油红O染色显示,lean组小鼠肝细胞内可见散在脂滴。与lean+VEH组相比,db/db+VEH组肝细胞胞至内可见大量红染小脂滴,呈团块状或点状;与db/db+VEH组相比,db/db+TUD组脂滴有所减少,肝细胞脂肪变性减轻(图6B)。
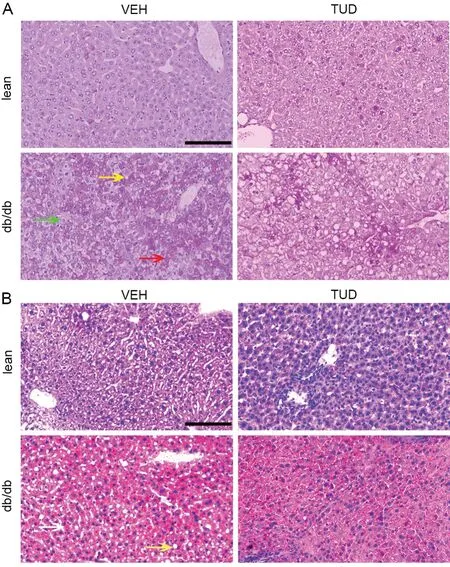
图6 TUDCA处理对db/db小鼠肝组织病理学影响的PAS和油红O染色观察。A,代表性PAS染色结果,黄色箭头示肝脂肪变,绿色箭头示肝细胞肿胀,红色箭头示糖原颗粒贮积。B,代表性油红O染色结果;白色箭头示均质红染的脂质贮积团块,黄色箭头示肝脂肪变性,核偏位。比例尺,50 µmFig. 6 PAS and Oil Red A staining observation on the effect of TUDCA treatment on histopathological changes of the db/db mice liver tissues. A, representative PAS staining results; yellow arrows show hepatic steatosis, green arrows show hepatocyte swelling, and red arrows show glycogen granule storage. B, representative Oil Red O staining results; white arrows show homogeneous red-stained lipid storage masses and yellow arrows show hepatic steatosis with nuclear deviation. Scale bar, 50 µm
5 TUDCA处理抑制db/db小鼠肝细胞内GRP78和CHOP表达的上调
免疫组织化学染色显示,lean小鼠肝内有少数细胞GRP78和CHOP阳性。与lean+VEH组相比,db/db+VEH组肝细胞内GRP78和CHOP阳性细胞明显增多,GRP78和CHOP免疫反应性明显增强。与db/db+VEH组比较,db/db+TUD组肝细胞GRP78和CHOP免疫反应性明显减弱,但仍强于lean+VEH组和lean+TUD组(图7A、B)。
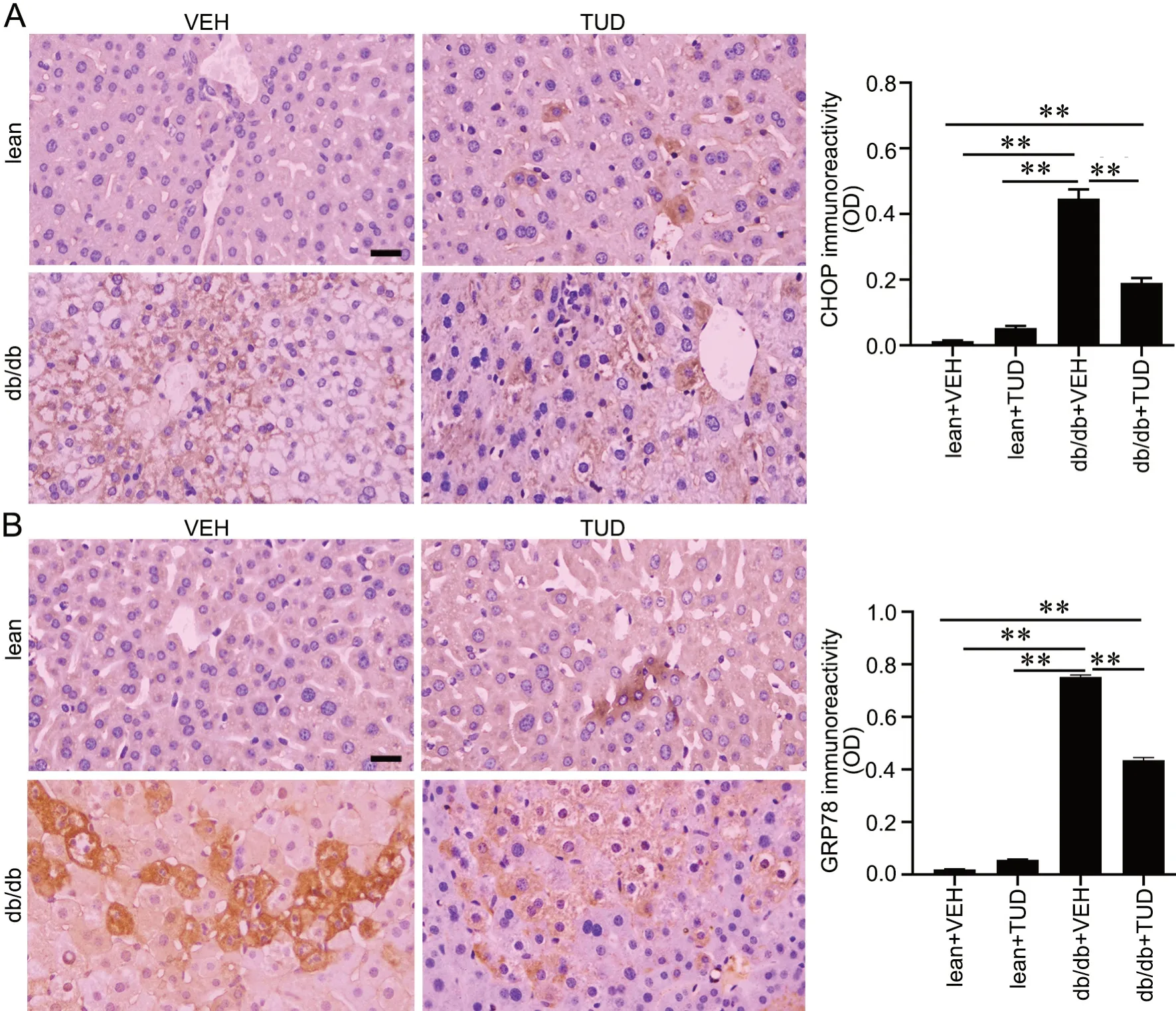
图7 A-B TUDCA处理对db/db小鼠肝细胞内GRP78及CHOP表达影响的免疫组织化学检测。A,GRP78免疫反应性代表性免疫组织化学染色结果与统计学分析;B,CHOP免疫反应性代表性免疫组织化学染色结果与统计学分析;比例尺,20 µm;**P<0.01;n=5Fig. 7 Immunohistochemical examination of GRP78 and CHOP expression in the hepatic tissue of the db/db mice. A, representative immunohistochemical staining results and statistical analysis of GRP78 immunoreactivity; B, representative immunohistochemical staining results and statistical analysis of CHOP; scale bar, 20 µm; **P<0.01; n=5
讨论
在2型糖尿病所致肝损伤中,超过90%的T2DM肥胖患者与非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)密切相关。NAFLD以胰岛素抵抗和肝脏脂肪聚集为特征[6]。内质网是肝细胞脂质代谢的主要场所,当机体出现如高血糖、高脂血症和胰岛素抵抗时,肝细胞内质网的稳态会被破坏,导致细胞器内质网中错误折叠的蛋白质或未折叠的蛋白质增加诱发ERS。短暂激活ERS具有保护作用,长期激活则会破坏内质网稳态,从而导致肝功能障碍和肝脏疾病的发生[7]。DLI发病的机制复杂,涉及遗传因素、环境因素和代谢因素等,但主要包括胰岛素抵抗、肝细胞损伤及游离脂肪酸(free fatty acid, FFA)的增加,这些因素都可导致细胞内内质网等细胞器功能受损并影响DLI的发生与发展。
大量证据表明内质网应激与胰岛素抵抗、脂质沉积和与FFA升高密切相关。慢性高脂血症和高血糖可导致内质网稳态的紊乱,引起不可逆的未折叠蛋白反应(unfolded protein in response,UPR)激活和细胞死亡,表现为胰岛素抵抗或衰竭、脂肪变性、炎症反应、脂质合成障碍等。因此,内质网应激反应和UPR信号通路可能在DLI发病机制中起着重要作用。DLI时肝细胞内可出现糖原贮积,肝小叶汇管区炎细胞的浸润及肝细胞的脂肪变性甚至纤维化等。TUDCA能作为蛋白质折叠的分子伴侣改善胆汁纤维化、视网膜变性、帕金森病和葡萄糖功能障碍等病变[8-11]。TUDCA通过调节内质网的功能及稳定蛋白构象增强内质网对蛋白折叠的处理能力,减少蛋白质翻译及促进错误蛋白降解,对内质网的应激造成的损伤发挥保护作用[12]。本研究拟通过TUDCA对自发性T2DM小鼠模型进行药物干预,检测血浆中相关的生化指标、ERS标志物及肝细胞脂质贮积情况,探讨T2DM肝细胞损伤引起脂肪变的可能机制。
糖利用障碍引起血中游离脂肪酸FFA的增加不仅干扰胰岛素信号系统导致脂肪肝形成,还能增加肝细胞对氧化应激及炎症反应敏感性,使细胞器受损[13,14]。FFA超过肝脏自我合成脂蛋白的能力,使大量脂肪酸蓄积引起脂肪变性,出现大量脂滴形成,由于高糖状态,糖原贮积过多,导致肝糖原贮积增加,这也在本实验中得到了证实[13]。OGTT实验和胰岛素耐量实验是检查胰岛素敏感性的有效方法。db/db+VEH组小鼠口服葡萄糖后血糖水平显著升高,且2 h内血糖未能降至口服葡萄糖前的水平,但胰岛素水平显著升高;db/db+TUD组小鼠口服葡萄糖后血糖水平升高但不显著,2 h内血糖恢复至口服葡萄糖前的水平,相比于db/db+VEH组小鼠,db/db+TUD组胰岛素水平显示显著下降,TUDCA表现出能有效降低血糖和改善胰岛素敏感性的功能。db/db+VEH组小鼠HE染色及油红O染色发现肝细胞胞质内可见大量小脂滴,呈团块状或点状;PAS染色发现肝细胞胞质内糖原颗粒明显增加,并可见核内糖原空洞形成,而经过TUDCA处理后的db/db小鼠肝脏脂滴沉积、炎细胞浸润、糖原空洞形减少及肝细胞损伤减轻,血清TC、TG、AST及ALT下调。研究结果说明TUDCA作为一种分子伴侣,不仅能缓解ERS,还能改善胰岛素敏感性,降低血糖水平,减轻高血糖对肝脏内质网的损伤。由此我们推测DLI形成的原因可能与脂代谢障碍、胰岛素抵抗、肥胖及肝糖原贮积有关。
GRP78是热休克蛋白70(HSP70)家族的成员之一,它主要存在于真核细胞的ER膜上[15]。GRP78的功能是作为分子伴侣,它与错误折叠的蛋白质和未装配的复合物结合,并启动UPR调节和ERAD降解。CHOP主要介导细胞凋亡。在ERS状态下,GRP78和CHOP的表达则明显上调[15,16]。糖尿病大鼠模型证实肝细胞中GRP78和CHOP表达的均上调[17,18]。在本研究免疫组织化学检测中,db/db+VEH组肝细胞内GRP78及CHOP免疫反应性明显增强,说明db/db小鼠出现高血糖能增加小鼠肝脏负荷,导致肝细胞功能受损,脂质贮积增加,FFA升高,加重肝细胞ERS,激活GRP78分解并启动UPR和激活ERAD;GRP78解离后又可促进eIF2α自身磷酸化激活间接诱导CHOP持续表达,从而导致肝细胞受损[19]。经过TUDCA处理后肝细胞损伤减轻,GRP78和CHOP表达上调明显抑制,由此提示TUDCA减轻自发性T2DM模型小鼠肝细胞损伤其机制可能与抑制内质网应激有关。
综上所述,本研究证明TUDCA能缓解和改善DLI,其主要机制可能是作为蛋白质折叠分子伴侣的TUDCA能减轻2型糖尿病导致的ERS反应,通过下调GRP78及CHOP表达来改善胰岛素分泌,调节肝脏脂质代谢缓解DLI。内质网应激通路抑制剂TUDCA可能成为治疗DLI的新途径,从而达到预防DLI发生及发展的目的。
