达珀利奈抑制急性缺血性脑卒中小鼠皮层神经炎症、胶质细胞活化及SARM1表达
2022-08-05崔迈尹付艳琼李卓丽陈吴越廖敏陈佰慧
崔迈尹,付艳琼,李卓丽,陈吴越,廖敏,陈佰慧
(1温州医科大学组织学与胚胎学教研室,2温州医科大学第一临床医学院,温州 325035)
脑卒中是由脑部血液循环障碍引起的神经功能缺陷疾病,具有高致残、高致死的特点,已成为影响全世界人口健康和社会经济发展的重大问题[1]。脑卒中分为出血性和缺血性,其中缺血性脑卒中发生后,大脑内氧糖供应不足会引起神经元的死亡并释放大量炎症因子,诱发神经炎症,进而加重神经损伤程度[2]。脑缺血损伤诱导的神经炎症反应与胶质细胞的激活密切相关[3]。小胶质细胞是中枢神经系统中常驻的免疫细胞。缺血性脑损伤发生后,小胶质细胞从静息状态分别被激活为经典激活型(M1型)和替代激活型(M2型),前者可分泌促炎因子,表达诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、加剧炎症反应和神经元损伤;而后者通过释放抗炎因子、诱导分化簇206(cluster of differentiation 206,CD206)的表达进而抑制神经炎症引起的神经损伤[4]。另外,星形胶质细胞是脑缺血损伤后最早受损的胶质细胞,可被激活为反应性星形胶质细胞,释放多种凋亡因子并异常增殖形成胶质瘢痕,造成不可逆的组织功能损伤[5]。因此,抑制神经胶质细胞活化是改善脑缺血损伤的一个重要途径[3]。
大量研究发现达珀利奈[(E)-Daporinad,FK866]是一种自身免疫性疾病[6]和类风湿性关节炎[7]等多种炎性疾病的潜在治疗药物。最近,Sasaki等人证明FK866参与调控神经组织损伤与修复过程,该研究发现FK866通过间接地抑制α和Toll/白细胞介素受体结构域蛋白1[sterile alpha and toll/interleukin receptor (TIR) motif containing protein 1,SARM1]的表达来阻断轴突变性,从而保护神经元免受损伤,因此FK866也可作为SARM1的抑制剂[8]。Maynard等人发现在SARM1全敲小鼠的脑挫伤模型中,白质损伤区域的小胶质细胞和星形胶质细胞的活性被减弱,炎症反应降低,同时改善运动和认知功能缺陷,对脑挫伤起到神经修复作用[9]。然而,在缺血性脑卒中发生后FK866是否通过阻断SARM1的活性,参与调控胶质细胞活化并发挥神经保护作用仍有待研究。
为了探究FK866在缺血性脑卒中急性期是否发挥神经保护作用并分析其机制,本研究应用光化学栓塞法制备小鼠局部缺血模型,模拟缺血性脑卒中的病理生理过程,检测了FK866对急性缺血性脑卒中小鼠大脑皮层损伤、运动协调功能、脑内缺血灶部位胶质细胞的活化及SARM1表达的影响。
材料与方法
1 实验动物及分组
选取8周龄成年雄性C57BL/6小鼠[购自江苏集萃药康生物科技股份有限公司,清洁级,许可证号:SYXK(浙)2015-0009],体重22~28 g。全部传入并饲养繁殖于温州医科大学实验动物中心的SPF级动物实验室,饲养环境温度控制为22~25 ℃,湿度为50%~60%,光照12 h,饮水和进食自由。小鼠按随机法分为假手术组(Sham组)、缺血损伤手术组(Vehicle组)、缺血手术后给予FK866干预组(FK866组)。本研究动物实验方案均得到了温州医科大学实验动物伦理委员会批准。
2 动物模型
小鼠在注射10 mg/ml孟加拉红溶液(100 mg/kg,Sigma)5 min后,腹腔注射1%戊巴比妥钠麻醉,待其彻底麻醉后,将小鼠固定于脑立体定位仪(68025,RWD),用剃毛机将小鼠头部毛发剃除,使用碘伏溶液消毒3次,自双眼中间至双耳中间纵向剪开头皮暴露颅骨后,以前囟为基准原点,缺血灶定位于左侧初级体感皮层前肢区(primary somatosensory cortex, forelimb region,S1FL),将激光发光器(MBL-III-473/100,Coherent)调至波长473 nm、功率50 mW的激发光,照射15 min,光化学栓塞缺血手术完毕后缝合小鼠头皮,置于37℃热板复苏。FK866组的小鼠,在手术当天和术后1 d、2 d、3 d连续4天给药,每天2次,腹腔注射溶于0.9%生理盐水的FK866溶液(5 mg/kg,Sigma)。Vehicle组小鼠在相同时间腹腔注射同剂量的0.9%生理盐水,Sham组小鼠接受相同手术过程,但不注射孟加拉红溶液。
3 行为学试验
小鼠分别在缺血手术前1 d以及手术后1 d和3 d进行行为学检测,通过以下2种行为学试验测定小鼠的运动功能。
3.1 圆筒试验
圆筒试验用来评估小鼠在直立状态下自发性使用前肢的偏好。本研究中缺血病灶位于左侧S1FL区,该区域损伤后会导致小鼠使用右侧前肢的贴壁次数减少,损伤严重者甚至不使用右侧前肢,而使用左侧前肢的贴壁次数会增加,因此我们可以通过评估小鼠左侧前肢的贴壁次数反应其恢复情况。试验在安静环境下、小鼠最活跃的时间段19:00—22:00 进行;小鼠在透明有机玻璃的圆筒里(13.6 cm × 19.9 cm:直径×高)一共3 min,全程录像,圆筒后面设置玻璃以获取小鼠背对摄像机的行为;小鼠在直立状态下前肢接触筒壁(以双前肢放回地面为标记)记为一组。左前肢贴壁率计算公式如下:
左前肢贴壁率=左前肢贴壁次数/(左前肢贴壁次数+右前肢贴壁次数+双前肢贴壁次数)× 100%3.2 网格爬行试验
网格爬行试验用来评估小鼠前肢运动功能及协调性。左侧S1FL区缺血损伤后会导致小鼠右侧前肢的感觉运动障碍,小鼠的前爪无法进行正常抓握,因此我们可以通过评估小鼠右侧前肢在网格爬行时掉落的次数反应其运动恢复情况。试验在安静环境下、小鼠最活跃的时间段19:00—22:00进行;小鼠被放置在不锈钢金属篮筐(27.5 cm × 22 cm:直径×高)里,将每格边长为1 cm正方形不锈钢金属篮筐固定在实验室工作台上方约50 cm处,一共1 min,全程录像,记录小鼠的步行次数,计算右前肢掉落率:

4 尼氏染色
向小鼠腹腔注射1%戊巴比妥钠麻醉后,开胸,用静脉输液针由心尖插入到左心室内通过蠕动泵驱动器(BT100-2J,兰格)匀速注入0.01mol/L PBS缓冲液,然后以4%多聚甲醛经心脏灌注固定。剥取脑组织后,置于4%多聚甲醛溶液进行后固定,经30%蔗糖脱水后用冰冻切片机(CM1950-1-0,Leica)作连续冠状切片,切片厚度为30 μm。将脑切片放入PBS 溶液洗10 min×3次,放入55 ℃烘箱中干燥20~30 min;之后放入装有0.1%尼氏染色液(C0117,碧云天)的染缸中,放置时间根据着色情况而定;放入95%乙醇中洗脱30 s,100%乙醇中脱水2 min,然后放入二甲苯中透明5 min×2次,中性树胶封片,晾干后置于显微镜(Nikon)下拍照。
5 TUNEL染色与免疫荧光双重染色
取出冰冻切片置于0.01 mol/L PBS中漂洗10 min×3次;脑片置于4%PFA中固定20 min后用PBS漂洗10 min×3次,用1×柠檬酸钠抗原修复液于96 ℃水浴加热6 min进行抗原修复,PBS漂洗10 min×3次;用3% H2O2-甲醇溶液10 min,将脑片置于含小鼠抗NeuN抗体(1:800,Abcam)溶液中4 ℃孵育过夜;次日用PBS溶液漂洗10 min×3次;按照TUNEL细胞凋亡试剂盒(No. 11684817910,罗氏)说明避光配制TUNEL反应液,将盒中50 μL的脱氧核糖核苷酸末端转移酶(terminal deoxynucleotidyl transferase,TdT)浓缩溶液加入到450 μL的FITC荧光素标记的脱氧尿嘧啶核苷三磷酸(2’-deoxyuridine-5’-triphosphate,dUTP)溶液里,充分混匀后加入相应的含Alexa 594荧光素的驴抗小鼠二抗(1:1000,Jackson ImmunoReaserch)和细胞核标记物DAPI(1:1000,Sigma)置于37 ℃恒温烘箱避光孵育1 h;再用PBS溶液漂洗10 min×3次;滴适量抗荧光淬灭剂封片,荧光显微镜(Li2,Nikon)拍照。
6 免疫组织化学染色
取出冰冻切片置于0.01 mol/L PBS中漂洗10 min×3次;脑切片浸入0.3%H2O2-甲醇溶液中20 min,之后PBS漂洗10 min×3次;放入2.5% 正常羊血清封闭30 min,在分别含有兔抗离子化钙结合适配体分子1(ionized calcium binding adapter molecule 1,Iba1)抗体(1:1000,Abcam)、小鼠抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(1:50,Cell Signaling Technology)溶液中4 ℃孵育过夜;次日用PBS漂洗10 min×3次;二抗以相应的含辣根过氧化物酶(HRP)的山羊抗兔/小鼠抗体(1:250,Abcam)室温孵育1.5 h,PBS漂洗10 min×3次;浸入亲和素-生物素过氧化酶复合物(avidin-biotinylated peroxidase complex,ABC)溶液(32020,Thermo Scientific)(1:100)反应1 h,用PBS漂洗10 min×3次;再浸入3,3’-二氨基联苯胺(3,3’-diaminobenzidine,DAB)溶 液(D8001,Sigma)显色(时间可根据染色效果和要求调整),用PBS漂洗10 min×3次;放入55 ℃烘箱干燥;将切片分别浸入50%、70%、80%、90%、95%、100%乙醇中脱水5 min,二甲苯中透明5 min×2次,中性树胶封片,晾干后显微镜(Nikon)下拍照。
7 蛋白免疫印迹
冰上剖取小鼠大脑,取大脑皮层缺血部位,于精细天平上称量,每100 mg脑组织加1 mL 含蛋白酶抑制剂的组织裂解液,低温快速匀浆,于冰上裂解30 min;于4 ℃、12000 r/min离心10 min;吸取上清,加入5×上样缓冲液,吹打混匀,放入100 ℃干式金属恒温器(OSE-DB-01,天根)煮10 min;等量蛋白按顺序上样,经8%-10% SDS-PAGE胶电泳分离,然后转膜至PVDF膜上,再置于5%脱脂奶粉室温封闭1~2 h,1×TBST漂洗10 min×3次;之后置于以下特异性一抗中4 ℃温和孵育过夜:兔抗Iba1抗体(1:1000,Abcam),兔抗SARM1抗体(1:1000,Novus),小鼠抗GFAP抗体(1:1000,Cell Signaling Technology),小鼠抗iNOS抗体(1:1000,Abcam),山羊抗CD206抗体(1:1000,R&D System),小鼠抗胶质瘢痕标志物磷酸蛋白聚糖(phosphacan)抗体(1:1000,Sigma),小鼠抗β-actin抗体(1:3000,Abcam);次日TBST漂洗10 min×3次;含HRP的山羊抗兔/小鼠抗体(1:5000,Abcam)以及含HRP的驴抗山羊抗体(1:5000,Abcam)室温孵育1.5 h,TBST漂洗10 min×3次;根据ECL化学发光试剂盒(SQ201,雅酶)以1:1比例配制曝光液并均匀覆盖在PVDF膜上,室温下孵育1 min后于化学发光成像系统(ChemiScope6000,勤翔)曝光并保存结果。
8 统计学处理
采用Prism 8软件统计分析,实验结果用均数±标准差(±s)表示。各组间采用两样本t检验和单因素方差分析。P<0.05为差异具有统计学意义。
结果
1 FK866抑制缺血性脑卒中小鼠神经损伤
为了探究FK866在缺血性脑卒中诱导的神经损伤中的作用,应用尼氏染色和TUNEL染色检测大脑皮质缺血病灶面积和神经元凋亡水平。尼氏染色显示:Sham组小鼠大脑皮层未见缺血病灶,Vehicle组小鼠大脑皮层可见大面积缺血病灶,FK866组小鼠大脑皮层缺血病灶面积较Vehicle组明显缩小;TUNEL染色与NeuN免疫荧光染色显示:Sham组小鼠大脑皮层未见或偶见TUNEL染色阳性神经元,Vehicle组小鼠缺血灶内可见大量TUNEL阳性的凋亡神经元,而FK866组凋亡神经元数量明显少于Vehicle组(图1),表明FK866干预可显著抑制缺血对神经元的损伤。

图1 FK866对缺血性脑卒中小鼠皮层神经损伤影响的尼氏染色与TUNEL染色检测,箭头示TUNEL染色阳性的神经元Fig. 1 Nissl and TUNEL stainings to detect the effect of FK866 on the cortical neuronal injury in ischemic stroke mice, arrows show positive neurons with TUNEL staining
2 FK866改善缺血性脑卒中小鼠运动能力缺陷
应用圆筒试验和网格爬行试验检测小鼠运动功能显示:Vehicle组小鼠神经运动功能损伤明显,圆筒试验中左前肢接触率和网格爬行试验中右前肢掉落率较Sham组明显增多。在缺血手术后1 d,FK866组小鼠运动神经功能损伤症状较Vehicle组有所缓解,圆筒试验中左前肢接触率和网格爬行试验中右前肢掉落率均较Vehicle组明显减少。在缺血手术后3 d,FK866组小鼠较Vehicle组小鼠在圆筒试验中左前肢接触率和在网格爬行试验中右前肢掉落率进一步减少(表1,表2)。

表1 FK866对缺血性脑卒中小鼠运动功能影响的圆筒试验检测Tab.1 Effect of FK866 on the motor function of ischemic stroke mice by cylinder test

表2 FK866对缺血性脑卒中小鼠运动功能影响的网格爬行试验检测Tab. 2 Effect of FK866 on the motor function of ischemic stroke mice by grid walking test
3 FK866抑制缺血性脑卒中后小胶质细胞活化并促进其M2极化
为了阐明FK866对脑缺血损伤后神经元和运动功能缺陷的保护作用所涉及的潜在机制,应用免疫组织化学染色检测大脑皮层缺血灶及周围的胶质细胞活化情况。Iba1(小胶质细胞标记物)免疫组织化学染色显示:Sham组Iba1标记的小胶质细胞呈分枝杆状,胞质较小,此为静息小胶质细胞;Vehicle组小鼠大脑皮质缺血灶内Iba1阳性小胶质细胞免疫反应性较Sham组显著升高,多呈棕色颗粒状的阿米巴样,且胞质增大,分支缩短变粗;然而,FK866组小鼠大脑皮质缺血灶内Iba1阳性小胶质细胞免疫反应性则明显降低,可见少许体积变大,呈棕色颗粒状的阿米巴样小胶质细胞(图2A)。
因为各组皮层中小胶质细胞的形态不一,提示可能是小胶质细胞受不同刺激后的不同极化分型。由于小胶质细胞处于M2型激活时也会发生阿米巴样形态改变,但其作用为减轻炎症反应,因此应用免疫印迹实验检测大脑皮层中缺血部位的Iba1、iNOS(小胶质细胞M1型标记物)和CD206(小胶质细胞M2型标记物)的蛋白表达水平。结果显示:与Sham组相比,Vehicle组小鼠的大脑皮层缺血部位中Iba1的表达水平上升;与Vehicle组相比,FK866组小鼠大脑皮层缺血部位中Iba1和iNOS的表达水平降低,而CD206的表达水平上升(图2B)。表明在缺血性脑卒中后,FK866抑制小胶质细胞的活化并促进其向M2型极化。
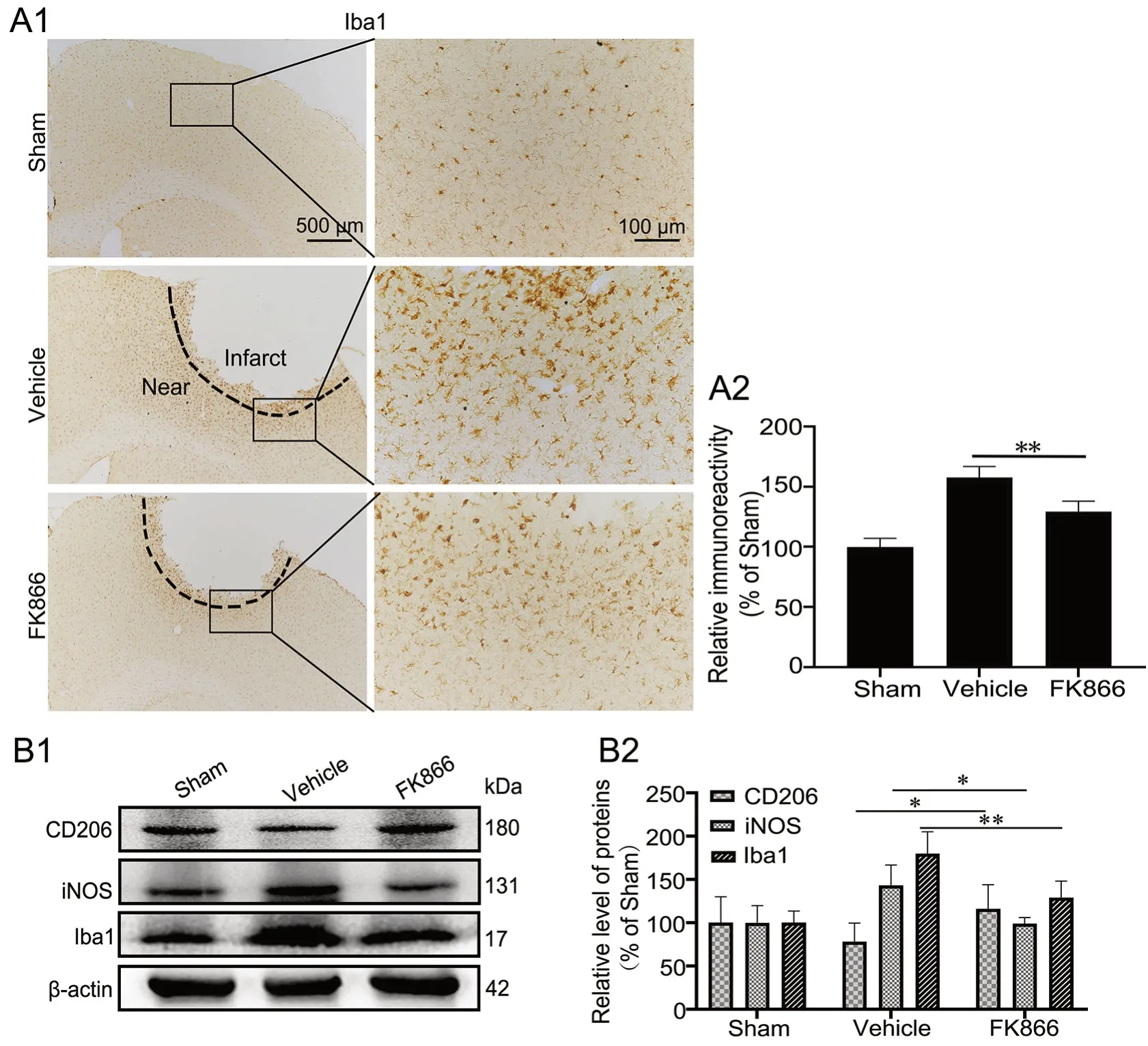
图2 FK866对缺血性脑卒中小鼠脑内小胶质细胞活化的影响。A,Iba1表达水平免疫组织化学检测与统计学分析;A1,Iba1表达的代表性免疫组织化学染色图像;A2,Iba1表达的免疫组织化学染色强度的统计学分析;**P<0.01。B,CD206、iNOS和Iba1表达的免疫印迹法检测与统计学分析;B1,CD206、iNOS和Iba1表达的代表性免疫印迹检测结果;B2,CD206、iNOS和Iba1表达水平的统计学分析;*P<0.05,**P<0.01;n=4Fig. 2 Effect of FK866 on the activation of microglia in the brains of ischemic stroke mice. A, immunohistochemical detection and statistical analysis of Iba1 expression. A1, representative images of Iba1 immunohistochemical staining; A2, statistical analysis of the immunohistochemical staining intensity of Iba1 expression; **P<0.01. B, Western blot detection and statistical analysis of the expression of CD206, iNOS and Iba1; B1, representative Western blot results of CD206, iNOS and Iba1 expression; B2, statistical analysis of the expression level of CD206, iNOS and Iba1; *P<0.05, **P<0.01; n=4
4 FK866抑制缺血性脑卒中小鼠脑内星形胶质细胞活化及胶质瘢痕的形成
GFAP(星形胶质细胞标记物)免疫组织化学染色显示:Sham组GFAP免疫反应性星形胶质细胞散布在皮质中,且胞质较小;Vehicle组大脑皮质缺血灶周围可见大量GFAP阳性星形胶质细胞,较Sham组的免疫反应性升高;与Vehicle组相比,FK866组小鼠大脑皮层缺血灶周围GFAP阳性星形胶质细胞的免疫反应性则明显降低(图3A)。
因为Vehicle组中GFAP阳性星形胶质细胞多聚集在缺血灶周围并延伸出长突起,提示可能存在胶质瘢痕的增生,应用免疫印迹实验检测各组皮层缺血灶部位GFAP和胶质瘢痕标记物phosphacan[10]表达水平。免疫印迹实验显示:Vehicle组小鼠大脑皮层缺血部位GFAP和phosphacan表达水平明显高于Sham组;与Vehicle组相比,FK866组小鼠大脑皮层缺血部位GFAP和phosphacan表达水平显著降低,但仍高于Sham组(图3B)。由此表明在缺血性脑卒中后,FK866可明显抑制星形胶质细胞激活以及胶质瘢痕的形成。
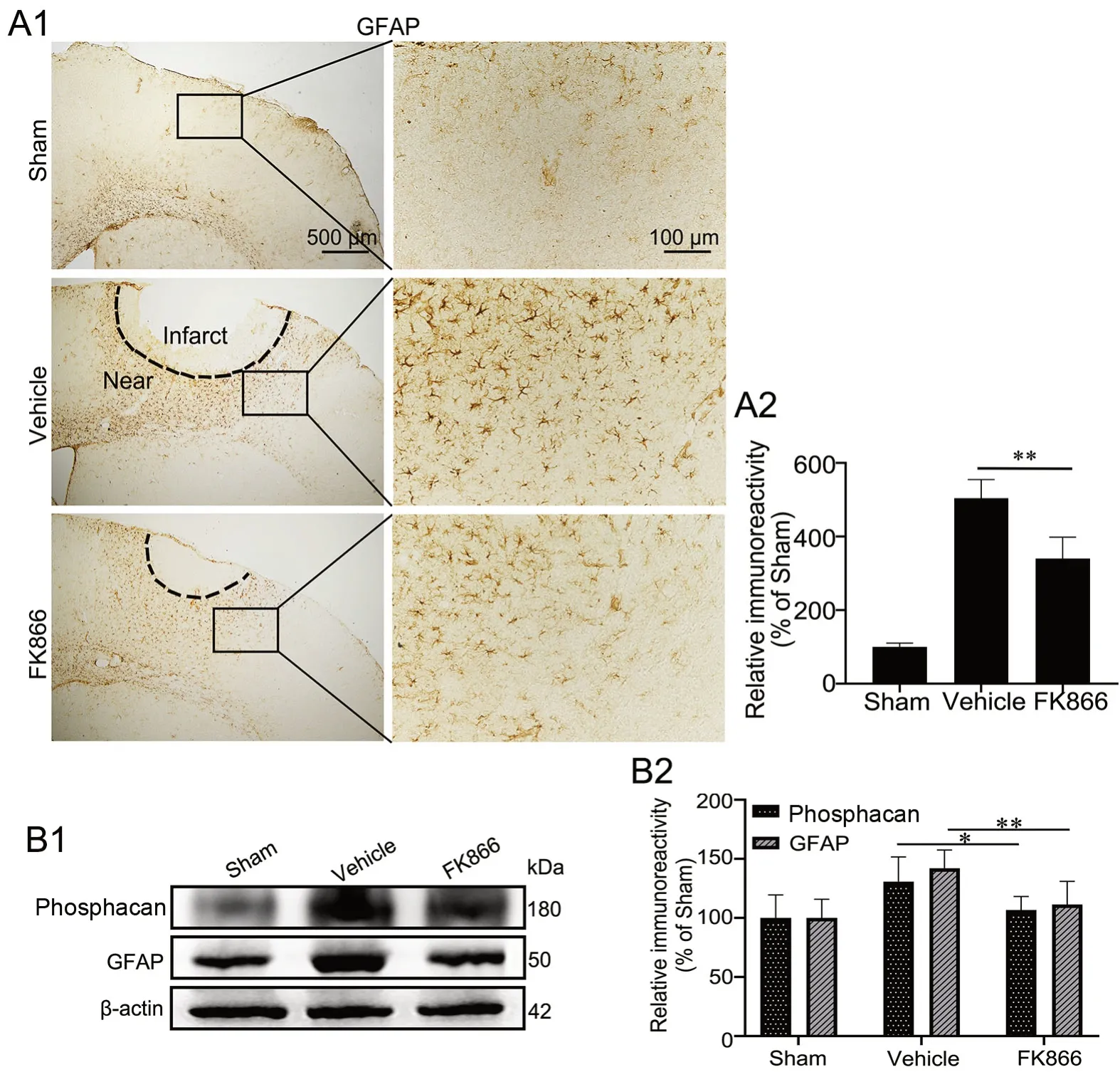
图3 FK866对缺血性脑卒中小鼠脑内星形胶质细胞活化的影响。A,GFAP表达水平免疫组织化学检测与统计学分析;A1,GFAP表达的代表性免疫组织化学染色图像;A2,GFAP表达的免疫组织化学染色强度的统计学分析。B,phosphacan和GFAP表达的免疫印迹法检测与统计学分析;B1,phosphacan和GFAP表达的代表性免疫印迹检测结果;B2,phosphacan和GFAP表达水平的统计学分析。*P<0.05,**P<0.01;n=4Fig. 3 Effect of FK866 on the activation of astrocytes in the brains of ischemic stroke mice. A, immunohistochemical detection and statistical analysis of GFAP expression. A1, representative images of GFAP immunohistochemical staining; A2, statistical analysis of the immunohistochemical staining intensity of GFAP expression. B, Western blot detection and statistical analysis of the expression of phosphacan and GFAP; B1, representative Western blot results of phosphacan and GFAP expression; B2, statistical analysis of the expression of phosphacan and GFAP. *P<0.05, **P<0.01; n=4
5 FK866抑制缺血性脑卒中后SARM1的表达
为了揭示FK866对脑缺血损伤后的神经保护机制提供依据,应用免疫印迹实验检测了FK866对脑缺血损伤后皮质内SARM1水平的影响。结果显示:在缺血损伤后,Vehicle组小鼠皮层SARM1水平显著上升;与Vehicle组相比,FK866组中SARM1水平显著下降(图4)。
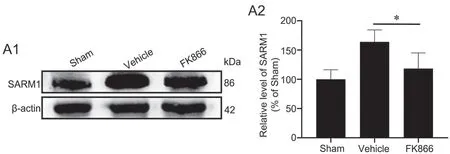
图4 SARM1表达的免疫印迹法检测与统计学分析。A1,SARM1表达的代表性免疫印迹检测结果;A2,SARM1表达水平的统计学分析;*P<0.05;n=4Fig. 4 Western blot detection and statistical analysis of the expression of SARM1. A1, representative Western blot results of SARM1 expression; A2, statistical analysis of the expression level of SARM1; *P<0.05; n=4
讨论
近年来的研究显示FK866在脑挫伤及脑缺血损伤的治疗上具有神经保护作用,通过降低烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyl transferase,NAMPT)的活性,阻碍烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)合成进而保护神经元,减轻炎症反应,促进机体恢复[11,12]。然而FK866在中枢神经系统中还可以通过抑制SARM1的活性来发挥保护作用[8,13]。本研究探讨了FK866在缺血性脑卒中后神经保护作用的潜在机制,结果表明,FK866可能通过下调SARM1减轻缺血后神经元的损伤,抑制胶质细胞活化。
已有研究发现FK866减轻脑挫伤后诱导的神经元损伤并改善神经功能[11]。本研究发现,FK866减少小鼠大脑皮层缺血灶面积和病灶内凋亡神经元的数量,减轻皮层缺血损伤程度。同时,FK866可以明显改善缺血后小鼠的运动功能缺陷。研究显示在光化学诱导缺血性脑卒中模型,自发性前肢活动与前爪抓握能力是评估神经保护功能的良好指标[14],所以本研究应用了圆筒试验和网格爬行试验,并发现FK866干预后的小鼠自发性使用损伤侧前肢次数降低以及损伤对侧前肢抓握能力增强,表明FK866在缺血性脑卒中后发挥神经保护作用。
本研究观察到,大脑皮层缺血损伤发生后,FK866可以明显抑制病灶部位小胶质细胞的活化,这与在大鼠缺血再灌注模型中的研究结果类似[12]。FK866具有抗炎特性[7],因此推测其对缺血后的神经保护作用与抑炎反应的诱导有关。小胶质细胞在脑损伤后迅速被激活并做出反应,目前已提出小胶质细胞有两种激活状态,即具有促炎作用的M1型小胶质细胞和具有抗炎作用的M2型小胶质细胞[4]。本研究通过检测缺血部位小胶质细胞的极化情况,发现FK866干预后的小鼠皮层缺血部位iNOS蛋白水平降低而CD206蛋白水平升高,表明FK866促进病灶内的小胶质细胞向M2型极化。M2型小胶质细胞可以清除细胞碎屑和死亡的神经元,利于血肿清除、血管生成和组织重塑[15],因此推测FK866是通过诱导小胶质细胞向M2型极化,并发挥抗炎作用促进机体的恢复。
大脑缺血后的星形胶质细胞功能受损,导致神经元的进一步损伤甚至死亡,并且易聚集在病灶周围形成胶质瘢痕,阻碍神经组织的修复[16]。本研究显示FK866干预后的小鼠皮层缺血灶周围星形胶质细胞免疫反应性降低,呈轻微的反应性星形胶质化。在大鼠局灶性脑缺血慢性期中观察到FK866可以抑制星形胶质细胞增生所致的胶质瘢痕形成[12],本研究结果也显示FK866降低了病灶部位phosphacan的蛋白表达水平,抑制胶质瘢痕的形成,这种抑制作用可能也参与受损神经组织恢复的过程。表明FK866通过抑制缺血后胶质细胞活化来缓解缺血性脑损伤的程度。
此外有研究指出FK866、神经元、神经胶质细胞以及SARM1之间存在明显联系[8,9],因此推测其潜在机制可能是与SARM1的表达有关。在本研究中,FK866明显下调缺血部位SARM1水平,然而相关研究多集中于化疗、脑挫伤诱导的轴突变性中[11,17],还未有在脑缺血损伤后探究FK866对 SARM1活性的调控,因此本研究是首次发现FK866抑制脑缺血损伤后诱导的SARM1水平上调。据报道,SARM1在受到损伤刺激后会诱导瓦勒变性、神经元凋亡及促炎因子的产生[18,19]。因此FK866可能通过抑制SARM1的活性来减轻缺血诱导的神经元损伤。SARM1是Toll样受体(toll-like receptors,TLRs)下游的接头蛋白之一,在星形胶质细胞中TLRs可以通过SARM1信号途径介导反应性星形胶质化来调控脑卒中后的炎症反应、神经功能损伤和病灶梗死程度[20]。另一方面,体外实验中证明SARM1上游的TLR4参与受损后小胶质细胞引起的促炎反应和先天免疫反应[21]。
本研究表明脑损伤后中枢神经系统中的小胶质细胞和星形胶质细胞活化与SARM1密切相关。FK866可能通过调控SARM1上游因子TLRs参与的信号通路,进而降低小胶质细胞和星形胶质细胞介导的神经炎症反应及胶质瘢痕的形成,最终参与脑缺血损伤后的神经修复。后期我们将进一步探究FK866在脑缺血后发挥保护作用的具体机制,为今后治疗缺血性脑卒中提供有效药物靶点,为临床上缺血性脑卒中的治疗提供新策略。
