基于高通量测序分析不同食盐浓度的酸菜中微生物多样性
2022-08-05贾晶晶魏爱丽赵虎威燕平梅
贾晶晶,魏爱丽,赵虎威,燕平梅
(太原师范学院 生物系,山西 晋中 030012)
我国人口众多,物产丰富,地域辽阔,具有民族特色的传统食品分布全国各地。在传统食品中极具特色的代表之一就是发酵蔬菜制品[1]。而酸菜是最具有代表性的发酵蔬菜之一,在现代生活中扮演着重要的营养角色,是将新鲜蔬菜经微生物的作用发生一些理想的生化反应而成的一种蔬菜制品。在发酵中起主要作用的微生物是乳酸菌[2]。适量食用酸菜有益人体健康,能促进肠道菌群的增长,且具有降胆固醇、降血压、降血脂、提高人体免疫力等一系列益处[3],还可以降解草酸盐以防治肾脏疾病,帮助人体吸收铁元素,因此深受人们的喜爱。
目前酸菜大多采用自然发酵的方法来制作,其发酵过程不易控制,且会因加入不合适的盐量而产生过量对人体有害的亚硝酸盐,带来严重的食品安全隐患,故一定程度上制约了酸菜的生产数量和质量。适当浓度的盐溶液不仅可以控制酸菜中乳酸菌的生长代谢活动,影响其风味与品质,而且可使酸菜不易腐败,增加其保质期。
传统的微生物纯培养方法是早期对酸菜中微生物多样性研究的主要方法,通过培养基培养的微生物根据微生物的形态或生化特征进行鉴定,然后经显微镜观察法和生化鉴定来对样品中的微生物种属进行分类鉴定[4]。传统的纯培养方法具有原理简单、实验设备要求较低、微生物形态观察和计数便捷等优势,但其也有得到的结果不能完全反映样品中微生物多样性的劣势[5],尽管依赖纯培养的方法具有很多局限性,但这种方法依然大大推动了微生物学的发展。近年来,以克服传统微生物学鉴定的局限性,不需要任何培养步骤,通过DNA分析的Culture-Independent方法被开发出来[6-8],如基于分子生物学的高通量测序技术[9-10],此技术克服了传统的微生物纯培养技术的限制,能够更加客观地分析样品,以及更为准确地分析微生物组成、多样性和动态变化,揭示更为复杂的细菌多样性,包括不可培养的微生物、亚优势种群和后期生长的物种。高通量测序技术已经广泛应用在分析水体、发酵食品、土壤微生物多样性等领域[11-13],是目前对微生物多样性分析研究的主流方法。
本实验运用高通量测序技术,通过对食盐浓度分别为8%、12%的酸菜样品中微生物群落多样性的研究,探讨了不同食盐浓度下酸菜发酵过程中微生物群落的结构组成及变化,对于改善酸菜的风味、提高酸菜的营养价值、降低酸菜中的有害物质有着积极作用,为酸菜的工业化生产提供了一定的理论指导。
1 材料和方法
1.1 材料与仪器
1.1.1 实验材料
新鲜卷白菜;食用盐;DNA提取试剂盒:天根生化科技(北京)有限公司。
1.1.2 实验仪器
DYY-6C型琼脂糖凝胶电泳仪 北京六一仪器厂;TGL-16B型高速离心机 上海安亭科学仪器厂;JB-CJ-1000FX型洁净工作台 苏州佳宝净化工程设备有限公司;YEC4A271069型移液器 大龙兴创实验仪器(北京)股份有限公司。
1.2 方法
1.2.1 材料处理
将新鲜卷白菜置于阴凉通风处干燥脱水72 h,洗净沥干后分别装入6个洗净晾干的泡菜坛中,每坛装200 g卷白菜,并用压菜石压紧。每3坛为一个对照组,分别加入160,240 g食盐,按一层白菜一层盐的顺序压紧,最上面用食盐封顶后,用压菜石压紧,倒入2 L冷开水,淹没白菜,盖上坛盖,坛沿加水,置于15 ℃阴凉通风处进行发酵。
1.2.2 样品DNA的提取及PCR扩增
待酸菜发酵至第14天时,使用移液器分别从酸菜液的上、中、下部各取12 mL样液总计36 mL置于离心管内,10000 r/min离心10 min,倒掉上清液,收集底部菌体,将每个对照组所收集到的3份底部菌体混合后置于2 mL的EP管内备用。
按照细菌基因组DNA提取试剂盒对6个样品的DNA进行提取。提取完成经琼脂糖凝胶电泳仪检测DNA质量后,将其置于-20 ℃以备后续实验操作。
采用338F(5′-ACTCCTACGGGAGGCAGCA-3′)、806R(5′-GGACTACHVGGGTWTATAAT-3′)为引物扩增细菌16S rDNA V3-V4区序列,然后按照PCR产物的检测方法检测。
1.2.3 高通量测序
将提取到的DNA样品送至上海美吉生物医药科技有限公司进行MiSeq测序。按照97%相似性对非重复序列进行操作分类单元(operational taxonomic units,OTU)聚类,最后采用RDP Classifier贝叶斯算法对 97%相似水平的OTU代表序列进行分类学分析,并在各个水平统计每个样品的群落组成,细菌使用Silva数据库进行比对。
1.2.4 数据分析
利用Mothur软件构建稀释性曲线;利用QIIME软件对样品的Chao丰富度指数、香农(Shannon)多样性指数、辛普森(Simpson)多样性指数等进行计算;利用柱形图和环状图展示不同分类水平下各门和属的相对含量;利用SPSS 16.0进行统计分析,R语言制作热图,Excel软件绘制柱形图、群落分布环状图。
2 结果与分析
2.1 稀释曲线
以抽取的数据量为横坐标,以Alpha多样性指数Shannon多样性指数值为纵坐标绘制曲线(见图1),根据曲线是否达到平缓来判断本次测序数据量是否足够,测序深度是否可以较为可靠地表现出该样品的微生物组成。
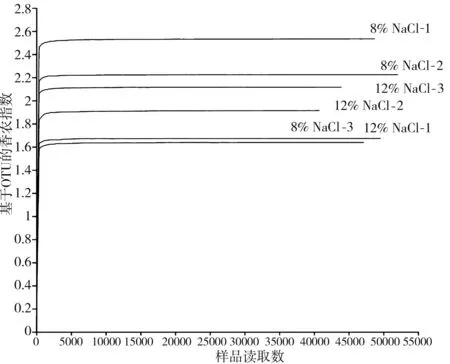
图1 不同食盐浓度样品的稀释曲线图Fig.1 The dilution curves of samples with different salt concentrations
由图1可知,6个样品的稀释曲线趋于平缓,故说明此次测序数据呈饱和状态,其测序结果可以涵盖酸菜样品中绝大多数的物种,满足了后续生物信息学分析的要求。
2.2 发酵酸菜中细菌序列丰度及多样性分析
利用高通量测序方法对不同食盐浓度的发酵酸菜液样品进行分析,共得到40769条序列,157个可操纵分类单元(OTU)。
Shannon多样性指数、Chao丰富度指数、Simpson多样性指数是常见的Alpha多样性指数。本研究中所得到的Alpha多样性指数见表1。群落Alpha多样性指数能够反映出物种的丰富度和多样性程度[14]。

表1 不同食盐浓度发酵酸菜Alpha多样性指数Table 1 Alpha diversity indexes of fermented Chinesesauerkraut with different salt concentrations
由表1可知,8%食盐的样品Chao值和Shannon指数分别为109和2.14,高于12%食盐浓度的104.33和1.89,故可说明在8%食盐浓度的酸菜样品中,其微生物的丰富度和多样性较高。
2.3 不同食盐浓度的发酵酸菜细菌群落结构分析
不同食盐浓度的酸菜样品中微生物在门水平上的相对含量分布见图2,其细菌分属5个门,Proteobacteria(变形菌门)和Firmicutes(厚壁菌门)为优势菌门,此外,样品中还有Actinobacteria(放线菌门)、Cyanobacteria(蓝藻门)、Bacteroidetes(拟杆菌门)。

图2 8%、12%食盐浓度的酸菜液在细菌门水平上的相对含量Fig.2 The relative content of Chinese sauerkraut solution with salt concentrations of 8% and 12% at the phylum level
由图2可知,从门水平上来看,在8%食盐浓度的酸菜样品中,Proteobacteria的相对含量为49.27%,Firmicutes的相对含量为49.99%,另外3个门的总相对含量为0.73%;在12%食盐浓度的酸菜样品中,Proteobacteria的相对含量为67.01%,Firmicutes的相对含量为32.39%,其他3个门的总相对含量为0.60%。结果表明,尽管食盐浓度不同,但其中Proteobacteria和Firmicutes均为优势菌门。高通量测序结果与用聚合酶链式反应-变性梯度凝胶电泳结合荧光定量核酸扩增检测系统[15]的方法来对发酵酸菜中微生物菌群结构进行分析的方法相比,研究结果更为准确、全面地揭示了酸菜中的细菌菌群结构,进一步证明了高通量测序技术在分析微生物群落结构方面的独特优势。
研究结果显示:在酸菜发酵的过程中,第一优势菌门为变形菌门,这一门的细菌通常构成了白菜本身的微生物群落,如假单胞菌和肠杆菌,第二优势菌门为厚壁菌门。朱琳等研究在萝卜酸菜发酵液中亚硝酸盐的上升和回落的变化期间酸菜液中细菌群落结构的多样性,表明在峰值期与回落期细菌多样性大不相同,而在亚硝酸盐的回落期酸菜液中第一优势菌门为厚壁菌门[16]。本次实验结果显示:在8%食盐浓度的酸菜样品中,厚壁菌门(49.99%)的相对丰度高于变形菌门(49.27%),说明其细菌群落符合亚硝酸盐浓度回落期的细菌群落结构,可说明食盐浓度在8%的发酵酸菜安全性相对较高。
不同食盐浓度的酸菜液中细菌在属水平上的相对含量(列举前十种)见图3和图4。
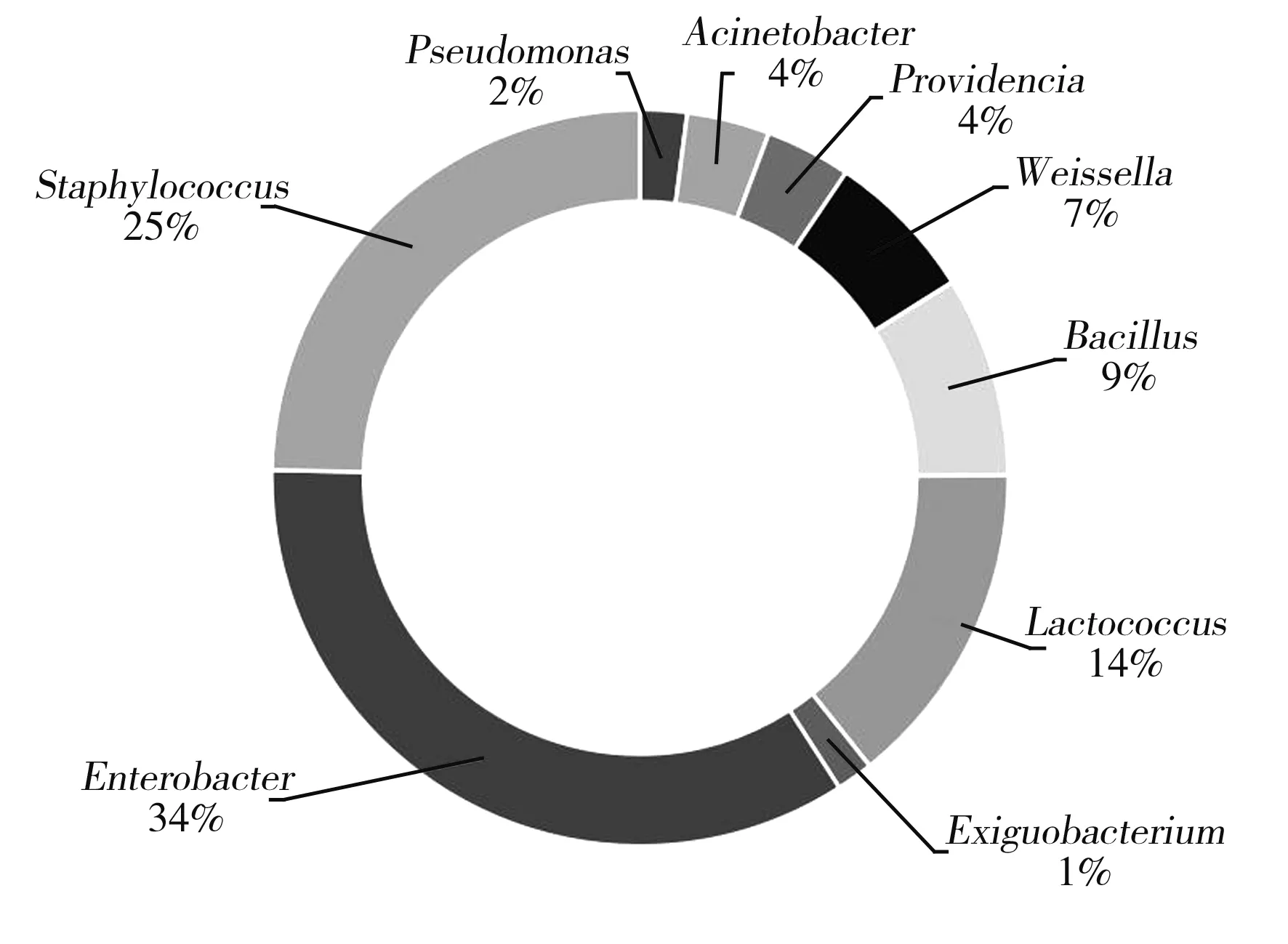
图3 8%食盐浓度酸菜中微生物在属水平上分布环状图Fig.3 Ring-like distribution of microorganisms in Chinese sauerkraut with 8% salt concentration at the genus level
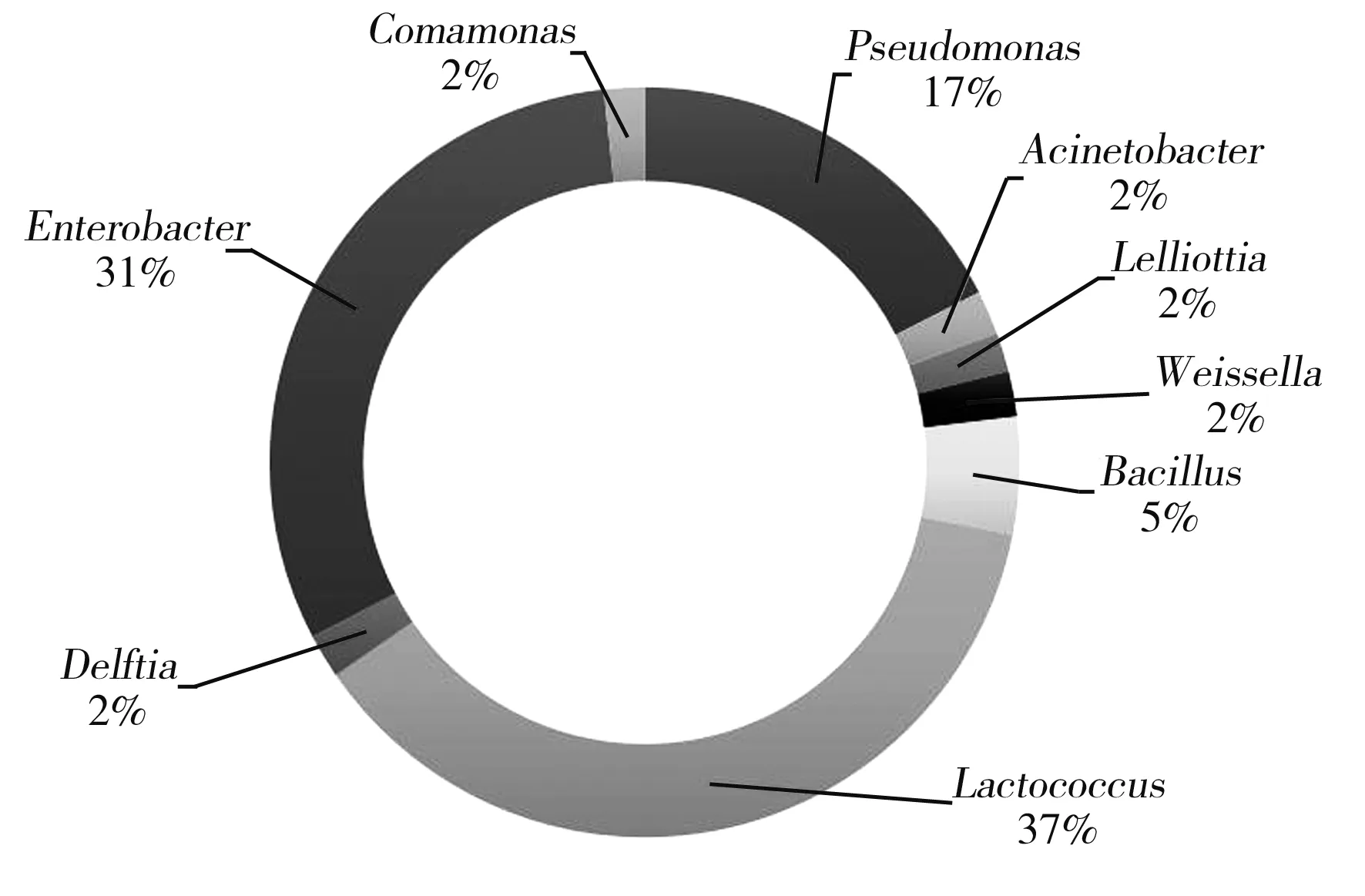
图4 12%食盐浓度酸菜中微生物在属水平上分布环状图Fig.4 Ring-like distribution of microorganisms in Chinesesauerkraut with 12% salt concentration at the genus level
由图3和图4可知,在8%食盐浓度的酸菜样品中,Enterobacter(肠杆菌属)、Staphylococcus(葡萄球菌属)、Lactococcus(乳球菌属)、Bacillus(芽孢杆菌属)、Weissella(魏斯氏菌属)为优势菌属,其相对百分比分别为34%、25%、14%、9%、7%,此外,该样品中还有Providencia(普罗威登斯菌属)、Acinetobacter(不动杆菌属)、Pseudomonas(假单胞菌属)、Exiguobacterium(微杆菌属)等。在12%食盐浓度的酸菜样品中,Lactococcus(乳球菌属)、Enterobacter(肠杆菌属)、Pseudomonas(假单胞菌属)为优势属,其相对百分比分别为37%、31%、17%,此外,该样品中还有Bacillus(芽孢杆菌属)、Weissella(魏斯氏菌属)、Delftia(代尔夫特菌属)、Acinetobacter(不动杆菌属)、Comamonas(丛毛单胞菌属)、Lelliottia等。
二者对比,其优势属均有Enterobacter(肠杆菌属)和Lactococcus(乳球菌属),且在12%食盐浓度的酸菜样品中Lactococcus的相对含量(37%)远高于在8%食盐浓度的酸菜样品中的相对含量(14%)。故可知随着食盐浓度的增加,Lactococcus的相对含量有着升高的趋势,且在不同食盐浓度的酸菜样品中乳酸菌均为优势菌,因为其有益生作用,常作为发酵剂被广泛应用于各类食品的生产加工过程中。
通过热图可视化方法可以直观研究群落组成。由图5可知,X1、X2、X3代表8%食盐浓度的样品,X4、X5、X6代表12%食盐浓度的样品,X2样品中Enterobacteriaceae含量明显高于其他样品,可能是取样不同造成差异明显。所有菌群中,Lactococcus(乳球菌属)在酸菜发酵中起主要作用,此外,Weissella(魏斯氏菌属)也有发现,乳酸菌在酸菜发酵期间起到非常关键性的作用,这与国内外众多学者的研究结果一致[17-18]。
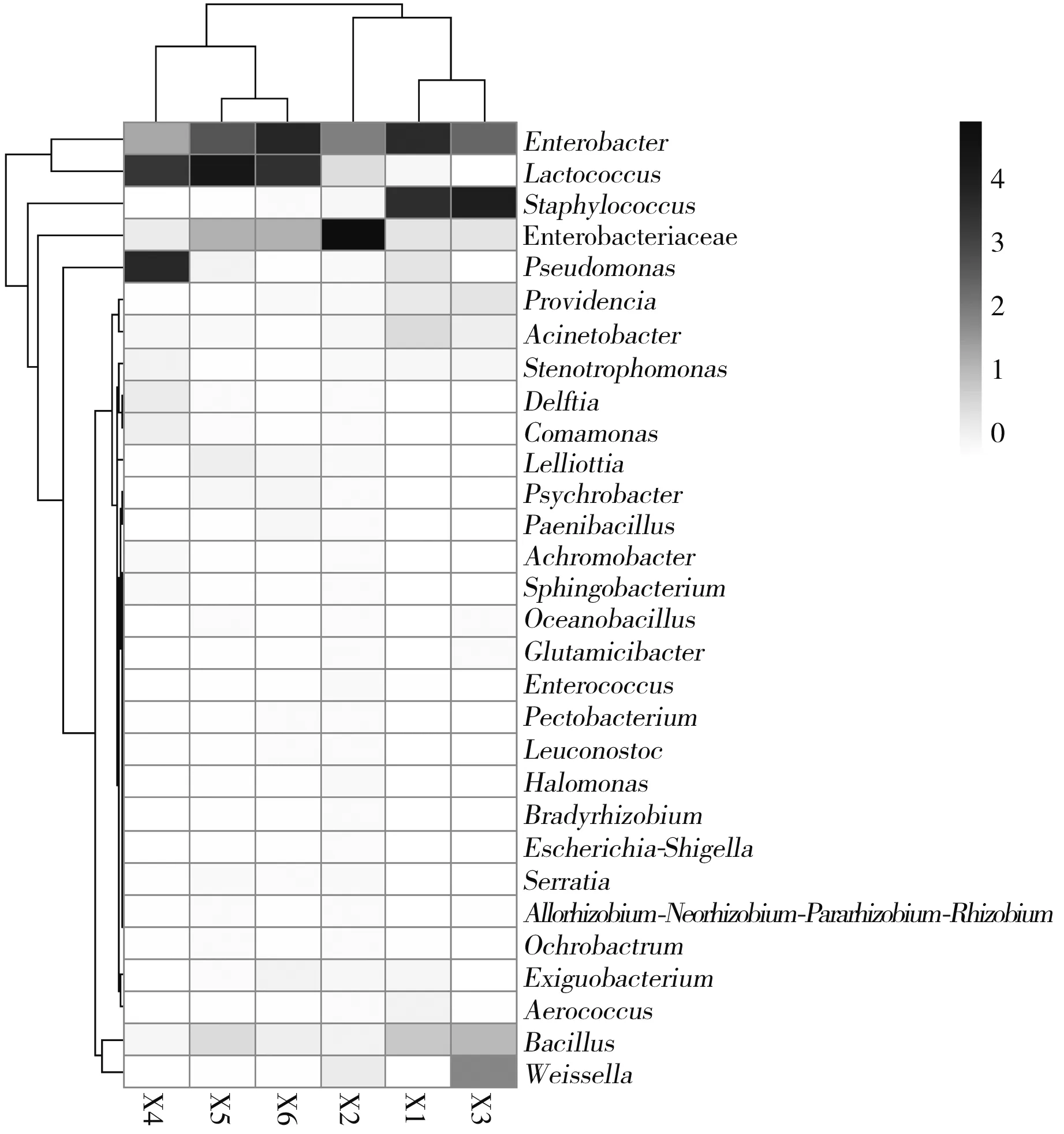
图5 不同样品热图Fig.5 Heat map of different samples
3 讨论
蔬菜的发酵作用主要是由其微环境中微生物的生长代谢活动引起的,且其中微生物的各种生长代谢活动对发酵蔬菜的各个方面都有着一定的影响。除了蔬菜中原本含有丰富的营养物质之外,发酵蔬菜中还有着蔬菜经乳酸菌的发酵作用形成的乳酸、核苷酸、醇类、醛类、酮类和酯类等物质,这些物质不仅赋予了酸菜独特的风味,而且对人体的健康也大有裨益。
由于加工类型的不同,发酵所用的原材料品种、发酵温度、盐溶液浓度、发酵工艺等因素都会对发酵过程中的乳酸菌群落结构产生影响,且发酵温度和盐溶液浓度对其影响较大。熊涛等的研究表明,在泡菜的发酵过程中,菌系结构和其生长代谢活动对泡菜的品质有着显著影响[19],也有研究表明盐度是影响大肠杆菌生长最主要的因素[20]。
本研究以8%和12%食盐浓度的酸菜样品为研究对象,利用高通量测序对其在发酵过程中的微生物多样性进行了细致的研究,直观地指出:在门水平上,Proteobacteria(变形菌门)和Firmicutes(厚壁菌门)为优势菌门;在属水平上,Enterobacter(肠杆菌属)和Lactococcus(乳球菌属)为优势菌属。且在12%食盐浓度的酸菜样品中Lactococcus的相对含量(37%)远高于在8%食盐浓度的酸菜样品中的相对含量(14%)。结果表明,8%食盐浓度的酸菜样品中微生物的多样性较高,而引起发酵的主要菌属Lactococcus随着食盐浓度的增加有升高的趋势。
研究不同食盐浓度的酸菜中微生物的种类及群落差异对优化酸菜的发酵工艺,提高酸菜食品的安全性具有极其重要的作用。揭示特定环境中的微生物物种多样性,寻找不同微生物在其特定生态系统中的相关作用仍是目前微生物生态学的热门之一。然而目前对于酸菜中的微生物构效、互作关系及其相关的生理生化反应缺乏科学性和整体性的研究与标准,特别是缺乏对于乳酸菌在不同加工方式的酸菜中的生长规律及其在日常生活和工业中统一的、系统性的指导标准与应用,这些都将成为未来在蔬菜发酵研究过程中的重要课题。
