樱桃李多酚类物质成分鉴定及其改善脂代谢的作用研究*
2022-08-05张姣姣苏黑艳帕尔哈提吐克孜吾守尔黄伟伟李艳红何恩鹏
张姣姣, 苏黑艳·帕尔哈提, 吐克孜·吾守尔, 黄伟伟, 杨 坡, 李艳红△, 何恩鹏△
(1新疆特殊环境物种多样性应用与调控实验室,新疆特殊环境物种保护与调控生物学实验室,新疆师范大学生命科学学院,新疆 乌鲁木齐 830054;2新疆师范大学运动人体科学重点实验室,新疆 乌鲁木齐 830054)
肥胖已成为导致其它慢性疾病甚至死亡的重要原因之一[1],是影响人类健康的全球性公共卫生问题,其特点是长期摄入的能量超过了身体的能量消耗,体重和脂肪组织含量增加,致使身体出现慢性炎症、肝损伤等问题,进而引起一系列慢性疾病发生[2-3]。
流行病学研究表明,多摄入新鲜水果有助于减肥[4-5]。其中,深色、富含多酚的水果(如蓝莓、覆盆子和杨梅)提取物具有显著改善糖脂代谢的作用。例如,在高脂饮食(high-fat diet,HFD)诱导的糖尿病小鼠中,蓝莓提取物可显著降低血清和肝脏甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)水平,并对肝脏起到保护作用[6]。杨梅可通过增加脂肪酸的氧化和下调脂肪酸合成相关基因的表达改善脂代谢,显著改善肥胖相关特征,主要与其富含的多酚类物质相关[7]。
樱桃李(Prunus cerasiferaEhr.)属于蔷薇科李属,主要分布于新疆伊犁霍城县。研究发现,樱桃李果实富含有机酸、维生素、矿物质、多酚等物质,具有抗氧化、抗肿瘤、抗炎等作用[8-9]。本课题组前期研究发现,紫果樱桃李果汁对HFD 诱发的肥胖小鼠有预防作用且果汁中总多酚含量丰富[10]。樱桃李果实中多酚类物质的成分及其改善脂代谢的作用尚不明确。因此,本研究通过液相色谱-质谱(liquid chromatography with mass spectrometry,LC-MS)对紫果樱桃李提取物中的多酚类化合物进行定性分析,并以HFD 喂养的肥胖小鼠为模型,评估其在体内对脂代谢的改善作用及可能机制,为樱桃李多酚降脂功能成分的开发提供理论依据。
材料和方法
1 材料
SPF 级 5~6 周龄 C57BL/6 雄性小鼠,购自南京君科生物公司,动物合格证号SCXK(苏)2016-0010。紫果樱桃李购自新疆伊犁霍城县大西沟。
2 主要试剂
Trizol、cDNA反转录试剂盒和荧光定量PCR试剂盒购自天根生化科技(北京)有限公司;TC、TG、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和丙氨酸转氨酶(alanine aminotransferase,ALT)检测试剂盒购自南京建成生物工程有限公司;蛋白检测所用的Ⅰ抗、Ⅱ抗均购自上海碧云天生物技术有限公司;TEMED 和PVDF 膜购自Sigma;其它生化试剂均为进口分装或国产分析纯。所用引物由生工生物工程(上海)股份有限公司合成。
3 主要方法
3.1 樱桃李多酚的提取 新鲜樱桃李采用甲醇/水/甲酸(体积比90∶9∶1)提取液浸提后,AB-8 大孔吸附树脂吸附,60%乙醇洗脱,旋转蒸发浓缩,真空冷冻干燥成粉末。
3.2 电喷雾电离 喷雾电压:-2.8 kV;鞘气:40 arb;辅助气:10 arb;气帘气:35;离子源温度:350 ℃;毛细管温度:300 ℃;-70 V;聚焦电压:-350 V,DP2:-10 V。整个过程采用氮气。样品分析采用DDA 模式:Q-Orbitrap 采集范围为 m/z 100~1 500,碎片离子扫描范围设为m/z 50~1 500;碰撞气:10%、30%和50%;MS 分辨率为70,000 FWHM(m/z 200);MS2 分辨率为17,000 FWHM(m/z 200);数据采集及分析采用Xcalibur 4.0软件(Thermo Fisher Scientific)。
3.3 实验动物分组及给药 50 只小鼠适应性喂养1周后,随机分为2组:正常对照(normal control,NC)组10 只(正常饲料喂养),其余40 只为高脂组(HFD喂养)。8 周后,将造模成功的小鼠随机均分为4 组:HFD 组、低剂量(200 mg/kg)多酚组(HFD+L 组)、高剂量(500 mg/kg)多酚组(HFD+H 组)和奥利司他(orlistat;15.6 mg/kg)组(HFD+O 组)。灌胃给药,每天一次。实验进行8 周,每周称重一次。最后一次灌胃后,小鼠禁食12 h,摘眼球采血,随即颈椎脱白处死,取肾脏、肝脏、心脏和脾脏称重,后置于-80℃冰箱冻存。脏器指数(%)=m1/m×100%,其中m1为脏器质量(g),m为小鼠处死前的体质量(g)。
3.4 血清指标的测定 按照试剂盒说明书测定血清TG、TC、HDL-C和LDL-C含量,以及AST和ALT活性。
3.5 肝脏组织形态学分析 将肝脏用10%甲醛固定24 h以上,乙醇梯度脱水,二甲苯透明,石蜡包埋,预冷,切成5 μm厚,进行HE和油红O染色。
3.6 荧光定量PCR 检测 Trizol 法从肝脏中提取总RNA,反转录成cDNA;根据基因序列设计特异性引物,序列见表1。按照荧光定量PCR 试剂盒操作,检测过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)、脂肪酸合酶(fatty acid synthase,FAS)、乙酰辅酶A 羧化酶(acetyl-CoA carboxylase,ACC)、CD36、胆固醇调节元件结合蛋白1c(sterol-regulatory element-binding protein-1c,SREBP-1c)、CCAAT/增强子结合蛋白α(CCAAT/enhancer-binding protein α,C/EBPα)、肉碱棕榈酰转移酶 1(carnitine palmitoyltransferase-1,CPT-1)和酰基辅酶A氧化酶(acyl-CoA oxidase,ACO)的mRNA表达,以β-actin为内参照,采用2-ΔΔCt法计算mRNA的相对表达量。

表1 引物序列Table 1. Sequences of the primers
3.7 Western blot 分析 肝脏样品加入蛋白裂解液研磨后裂解,离心获得含蛋白质上清液。BCA 法定量蛋白浓度,SDS-PAGE 后转移至PVDF 膜上,脱脂奶粉封闭,分别加入FAS、SREBP-1c、C/EBPα、CD36、AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)、p-AMPK、ACO 和β-actin 抗体孵育,后加入山羊抗小鼠IgG 孵育。采用ECL 化学发光试剂盒显色,蛋白凝胶成像仪观察蛋白条带,ImageJ 软件对蛋白条带进行灰度分析,计算蛋白的相对表达量。
4 统计学处理
实验数据采用GraphPad Prism 8.0 和SPSS 23.0软件进行分析,结果以平均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 果实多酚主要成分质谱分析
采用LC-MS 测定樱桃李总多酚提取物中的多酚成分,发现5种酚酸和单宁,以及13种黄酮及其衍生物,主要酚类物质为槲皮素-7-O-葡萄糖苷、槲皮素-7-O-阿拉伯糖苷、槲皮素、山柰酚-3-O-葡萄糖苷、山柰酚-7-O-葡萄糖苷、山柰酚-7-O-芸香糖苷、表儿茶素、3-O-咖啡酰基奎宁酸、5-O-咖啡酰基奎宁酸和4-O-咖啡酰基奎宁酸,见表2。
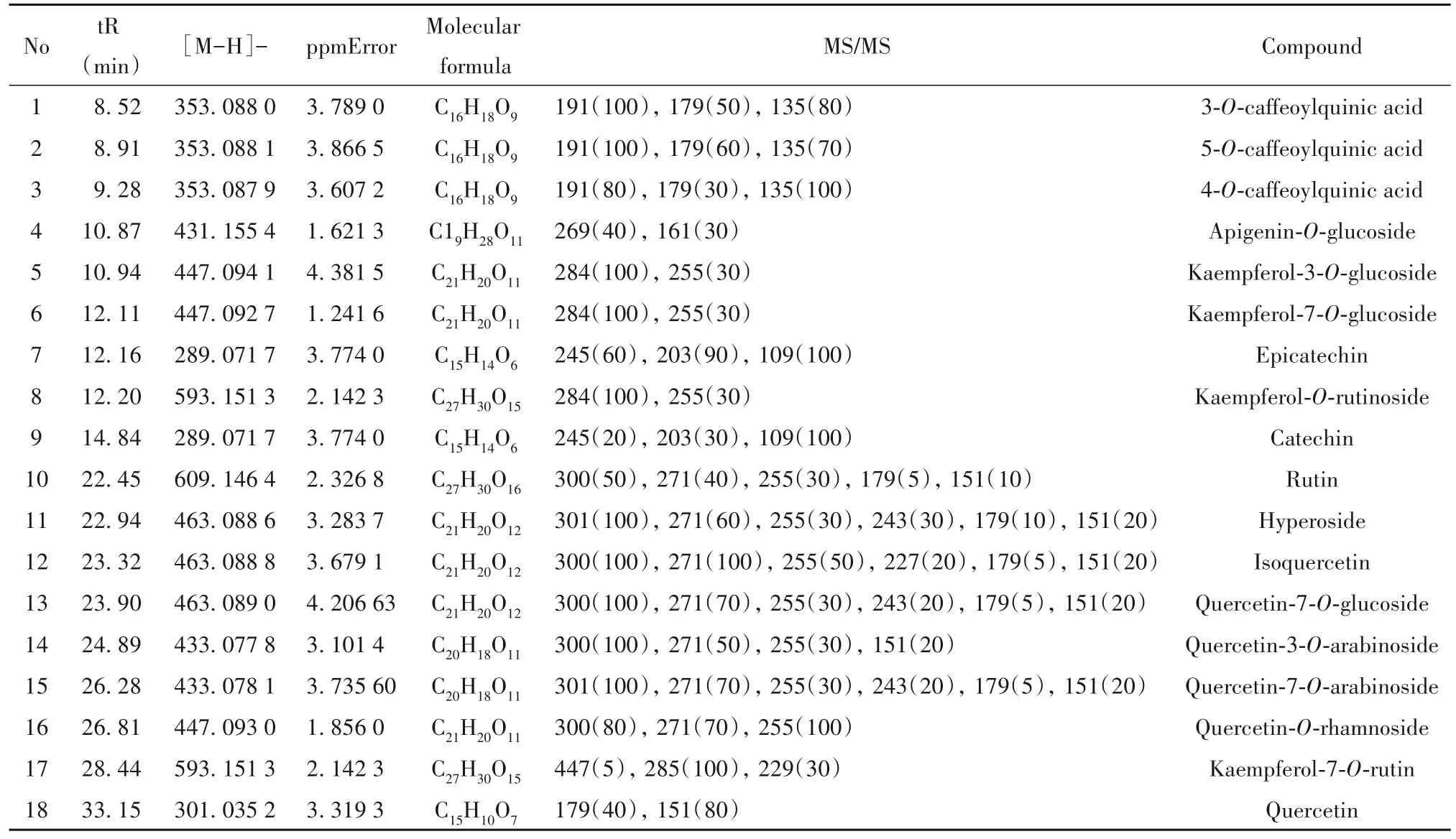
表2 樱桃李果实多酚主要成分质谱分析Table 2. Analysis of main components of fruit polyphenol by mass spectrometry
2 体重和组织指数
对小鼠体重变化进行分析发现,干预8 周后,与HFD 组相比,HFD+H 组小鼠体重减轻,见表3。这说明樱桃李多酚可降低因HFD引起的体重增加。
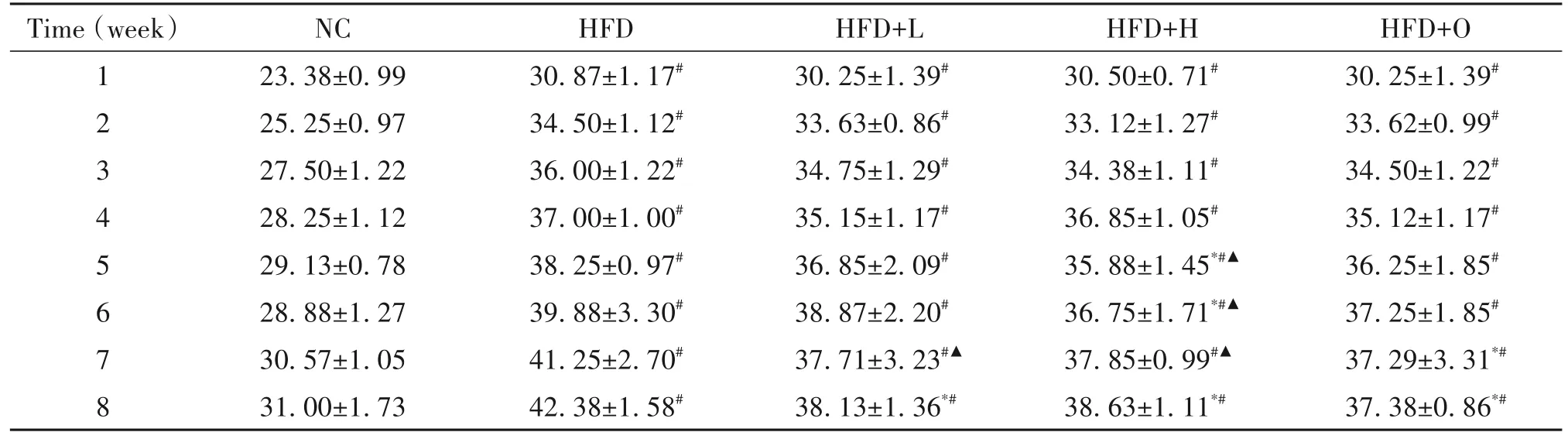
表3 不同干预方法对肥胖小鼠体重的影响Table 3. Effects of different intervention methods on body weight of obese mice(g. Mean±SD. n=10)
对小鼠脾脏、肝脏和肾脏指数进行检测发现,与HFD组比较,HFD+L和HFD+H组脾脏和肾脏指数均无显著差异(P>0.05),而肝脏指数显著降低(P<0.05),见表4。这说明樱桃李多酚对小鼠脏器无毒副作用,能够减轻HFD引起的小鼠肝脏肿大。
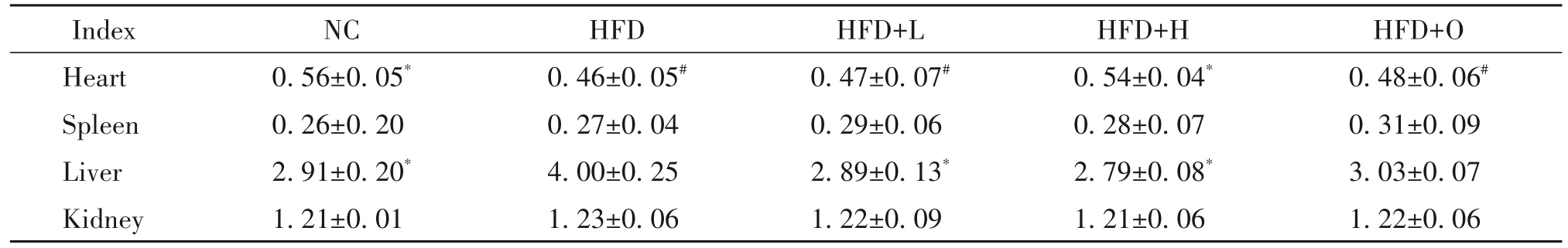
表4 不同干预方法对肥胖小鼠组织指数的影响Table 4. Effects of different intervention methods on tissue indexes in obese mice(%. Mean±SD. n=10)
3 血清生化指标的测定
测定小鼠血清 TG、TC、LDL-C、HDL-C、AST 和ALT水平。结果显示,樱桃李多酚干预后,HFD+H组TG、TC、LDL-C、AST 和 ALT 水平均显著低于 HFD 组(P<0.05),HDL-C 水平显著升高(P<0.05),见图1。这表明樱桃李多酚能显著降低肥胖小鼠血脂水平,减轻HFD所致肥胖对小鼠肝脏的损害。
4 肝脏组织形态学分析
采用HE和油红O染色对小鼠肝脏进行组织学观察,结果如图2 所示。HE 染色结果显示,NC 组肝小叶结构正常,细胞排列紧密,且胞浆内未见脂滴;HFD组肝细胞体积增大,且胞浆内出现大量脂肪空泡;HFD+L和HFD+H 组胞浆内脂肪空泡明显减少,肝细胞排列紧密,且肝小叶结构得到改善。油红O染色结果显示,NC 组肝脏细胞排列紧密,细胞核为蓝色,肝细胞内有少量红色脂滴;HFD 组细胞核数量减少,视野中出现大量红色脂滴;HFD+L和HFD+H 组红色脂滴明显减少,脂质积累逐渐减轻。上述结果表明,樱桃李多酚能够减轻肥胖造成的小鼠肝脏脂质积累。
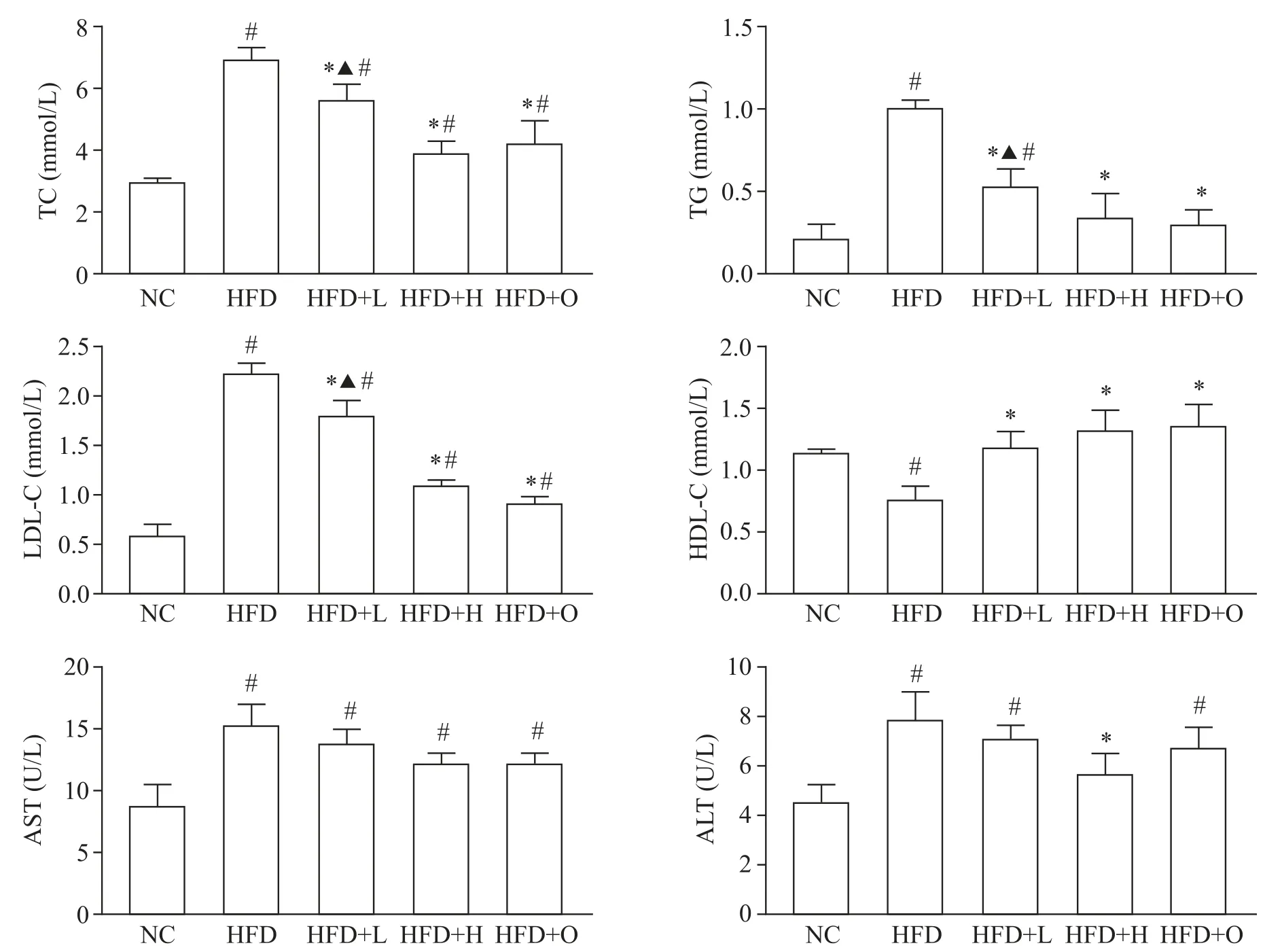
Figure 1. Determination of serum biochemical indexes in mice. Mean±SD. n=10.*P<0.05 vs HFD group;#P<0.05 vs NC group;▲P<0.05 vs HFD+O group.图1 小鼠血清生化指标测定

Figure 2. HE and oil red O staining of liver tissues(×200).图2 肝脏横切面HE和油红O染色
5 mRNA表达分析
荧光定量PCR 结果显示,与HFD 组相比,HFD+L 和 HFD+H 组 脂 肪合 成 相关 因 子 PPARγ、FAS、ACC、SREBP-1c、CD36 和 C/EBPα 的mRNA 表达均显著下调(P<0.05),脂肪氧化相关因子CPT-1 和ACO的mRNA 表达显著上调(P<0.05),见图3。这说明樱桃李多酚能调控脂代谢相关因子的mRNA表达。
6 蛋白表达分析
Western blot 结果显示,与 HFD 组相比,樱桃李多酚能降低 FAS、SREBP-1c、C/EBP-α 和 CD36 蛋白表达(P<0.05),提高 p-AMPK 与 AMPK 比值(P<0.05),见图4。这说明樱桃李多酚可激活AMPK,调节脂代谢相关蛋白表达。
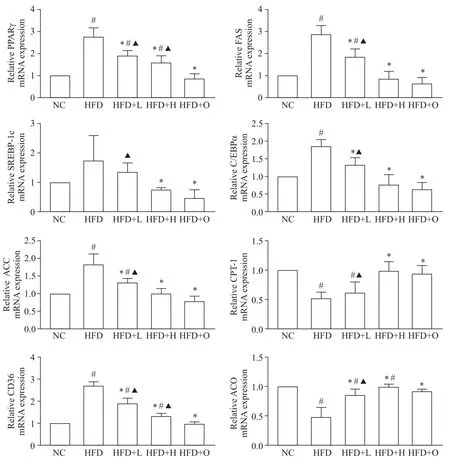
Figure 3. The mRNA expression of lipid metabolism-related molecules in liver tissues. Mean±SD. n=5.*P<0.05 vs HFD group;#P<0.05 vs NC group;▲P<0.05 vs HFD+O group.图3 肝脏脂代谢相关因子的mRNA表达
讨 论
多酚是一种强抗氧化剂,具有预防和治疗肥胖的生物活性[11-12]。已有研究发现,不同颜色和品种的樱桃李多酚的抗氧化活性与总多酚含量有关,其中紫色果实的总多酚含量最高[13]。本课题组前期对紫果樱桃李总多酚中黄酮类、酚酸类和黄烷醇类的含量进行测定,发现黄酮类是樱桃李中的主要酚类[14]。本研究发现,樱桃李多酚提取物中的主要成分有18种,其中5 种为酚酸和单宁,13 种为黄酮及黄酮衍生物,与前期测定结果一致。本研究为樱桃李多酚成分功能的进一步深入研究奠定基础。
人体内TC、TG 和LDL-C 含量增加,会导致体内脂肪堆积,引起动脉粥样硬化等心血管疾病[15-16]。本研究中,采用每天灌胃500 mg/kg 和200 mg/kg 的樱桃李多酚,8 周后可以减少小鼠体重增加,显著降低肥胖小鼠血清 TC、TG 和 LDL-C 含量,增加 HDL-C 含量。此外,肝脏脂滴的数量和大小也显著降低,说明樱桃李多酚提取物具有减肥作用。
能量代谢的信号分子AMPK 在脂代谢中发挥重要作用,可通过多条通路调控脂质合成和分解,被认为是改善脂代谢最值得关注的靶点。AMPK 广泛存在于真核细胞中[17],当 AMPK 被激活磷酸化时,会下调转录因子PPARγ、C/EBPα、SREBP-1c 和其他脂肪生成因子,从而减少脂肪酸、甘油三酯和胆固醇等脂质的合成[18-21]。本研究发现,樱桃李多酚能提高肥胖小鼠肝脏p-AMPK 与AMPK 蛋白的比值,降低C/EBPα、SREBP-1c、CD36 和 FAS 的 mRNA 及蛋白表达,说明樱桃李多酚能够激活AMPK 信号通路,调节下游转录因子及脂代谢相关酶的表达。
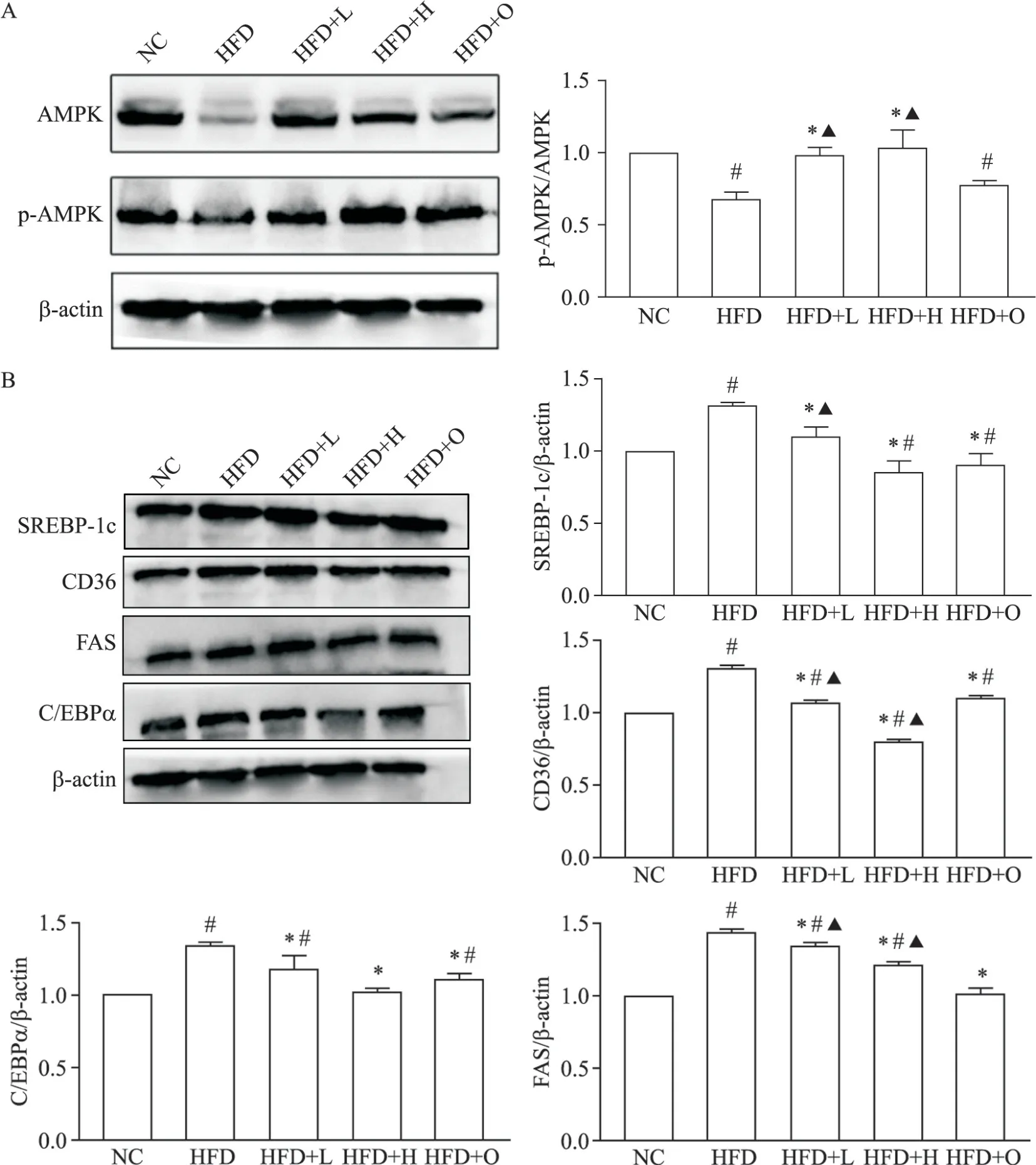
Figure 4. Expression of AMPK(A)and lipid metabolism-related proteins(B)in liver tissues. Mean±SD. n=3.*P<0.05 vs HFD group;#P<0.05 vs NC group;▲P<0.05 vs HFD+O group.图4 肝脏AMPK及脂代谢相关蛋白表达
综上所述,通过对樱桃李多酚进行定性分析,我们发现樱桃李中酚类物质成分丰富。樱桃李多酚可通过激活AMPK 信号通路调控下游转录因子而改善脂代谢。本研究为樱桃李多酚作为降脂功能成分的开发利用提供理论依据。樱桃李中多酚成分的降脂功能及作用机制仍需要进一步深入研究。
