不同时间慢性间歇低氧下CB1R/AMPK/PGC-1α信号通路对H9C2大鼠心肌细胞的调控作用*
2022-08-05胡梓璇穆素芳窦占军王佩佩段玉婷
胡梓璇, 赵 莉, 穆素芳, 窦占军, 王佩佩, 段玉婷, 熊 阳, 王 蓓△
(1山西医科大学基础医学院,山西 太原 030051;2山西医科大学第二医院,山西 太原 030001;3山西医科大学第二临床医学院,山西 太原 030051)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种常见的睡眠疾病,它的特点是睡眠时上气道反复塌陷引起呼吸暂停和/或低通气,导致慢性间歇低氧(chronic intermittent hypoxia,CIH)这种特殊的病理生理改变,产生类似于缺血-再灌注的损伤,最终导致多器官受损[1]。据统计,过去30 年中,OSA 的患病率显著上升[2]。目前我国OSA 患病人数高达1.76 亿[3],对社会医疗及患者个人造成严重的经济负担。
研究表明,OSA 可使心血管疾病的患病风险增加2~3 倍[4],这可能与其特有的病理改变CIH 导致的心脏结构和功能异常有关[5],但具体的分子机制尚不明确。心脏作为人体最活跃的生理器官,对缺血、缺氧极为敏感,耗氧量巨大。线粒体通过氧化磷酸化有效催化腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的生成,为心肌细胞提供能量,并产生活性氧(reactive oxygen species,ROS),同时还可通过不同机制介导细胞凋亡,在心脏的能量代谢中发挥着重要作用。研究证实,在缺氧条件下,心肌细胞线粒体分裂和融合的动态平衡可能被打破,导致线粒体功能障碍[6],从而引起细胞凋亡,造成心脏结构和功能的改变,但深入的研究仍鲜有报道。
AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)作为一种细胞内能量感受器[7],在低氧、低压等多种应激条件下,会随着AMP/ATP 比例的增加而被激活。AMPK 激活后,磷酸化的AMPK(phosphorylated AMPK,p-AMPK)上调过氧化物酶体增殖物激活受体γ 辅激活因子1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α),从而调控线粒体的合成[8]、自噬、损伤以及线粒体相关疾病[9]。目前有研究指出AMPK/PGC-1α激活可以改善心肌缺血再灌注造成的损伤[10],大量研究表明,CIH 导致心肌缺血、缺氧,因此我们推测AMPK/PGC-1α信号通路对CIH介导的心肌损伤也起着一定的调控作用。
内源性大麻素系统(endocannabinoid system)是一种内源性信号传导系统,在体内参与多种生理功能的调节[11]。目前已识别和克隆出多种具有生物活性的大麻素受体,其中发挥主导作用的是大麻素1型受体(cannabinoid type 1 receptor,CB1R)。CB1R是一种G 蛋白偶联受体[12],在心脏、大脑和血管等多种组织器官中广泛分布。我们课题组在前期研究中显示CB1R介导了OSA引起的肾脏损伤,随着CIH 时间的增加,肾脏线粒体分裂增多,碎片化程度增加,肾脏损伤加重,给予CB1R 拮抗剂后CIH 导致的肾脏损伤减轻[13]。因此,我们推测CIH 可通过引起CB1R表达的升高介导心肌细胞线粒体损伤,进一步导致心肌细胞的结构和功能障碍。本研究建立了OSACIH 大鼠心肌细胞模型,通过体外实验,观察不同时间CIH 以及给予CB1R 拮抗剂AM251 靶向封闭CB1R 后H9C2 大鼠心肌细胞及其线粒体的变化,并检测 CB1R、AMPK 和 PGC-1α 的表达水平,探讨CB1R 是否可通过影响AMPK/PGC-1α 通路参与CIH引起的大鼠心肌细胞结构及功能的改变,从细胞层面寻找其可能的保护机制,为OSA 相关心血管疾病的防治提供参考资料。
材料和方法
1 H9C2大鼠心肌细胞的培养
将H9C2大鼠心肌细胞(武汉普诺赛生命科技有限公司)置于含10%胎牛血清(Gibco)的高糖DMEM培养液(Gibco)中,在细胞培养箱中进行培养。当细胞密度达到70%~80%时用0.12%胰蛋白酶消化,将缓冲液吹打均匀进行传代和铺板。
2 方法
2.1 细胞实验分组及模型制备 将H9C2心肌细胞分为正常对照(normal control,NC)组、6 h CIH 组、18 h CIH 组及 18 h CIH+AM251 组 。H9C2 心 肌细 胞 以每孔2×105个的密度接种于6孔板中加入完全培养液进行培养,细胞放入BioSpherix A84 型细胞间歇低氧舱暴露在 CIH[14](使用 N2进行平衡,进行 25 min 的21% O2和35 min 的5% O2循环培养,并始终维持5%的CO2)中,根据前期预实验摸索将CIH 细胞模型分为6 h 和18 h 进行培养。18 h+AM251 组在暴露在18 h CIH 之前给予 500 nmol/L 的 AM251。NC 组放入正常37 ℃、5%CO2的细胞培养箱培养。
2.2 细胞凋亡 使用Annexin V-FITC/PI 细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司)检测细胞凋亡程度。H9C2 大鼠心肌细胞用胰酶消化收集。用 PBS 洗涤细胞 2 次(400×g离心 5 min)收集(1~5)×105个细胞。加入500 μL 的缓冲液来悬浮细胞;加入 5 μL 的 FITC 标记的 Annexin V 混匀后,再加入5 μL的PI,混匀。室温下避光、反应5~15 min;在1 h内,进行流式细胞仪的观察和检测。
2.3 线粒体膜电位检测 使用增强型线粒体膜电位检测试剂盒(enhanced mitochondrial membrane potential assay kit with JC-1;上海碧云天生物技术有限公司)进行检测。将H9C2 细胞种到6 孔板上,弃掉培养液,PBS 洗涤细胞,加入1 mL 细胞培养液和1 mL JC-1 染色工作液后充分混匀,37 ℃孵育20 min。孵育结束后用JC-1 染色缓冲液洗涤2 次,加入2 mL细胞培养液,在荧光显微镜下观察。正常细胞线粒体中JC-1以聚合物形式存在,呈明亮的红色荧光,绿色荧光很弱,可以通过荧光颜色的转变来检测线粒体膜电位的变化。线粒体膜电位较高时,可以产生红色荧光;在线粒体膜电位较低时,可以产生绿色荧光。
2.4 活性氧(reactive oxygen species,ROS)检测 将H9C2 细胞种到 6 孔板上,使用 ROS 检测试剂盒(北京索莱宝科技有限公司)进行检测。用无血清培养液按照1∶1 000 比例稀释DCFH-DA。去除细胞培养液,每孔加入1 mL稀释好的DCFH-DA。37 ℃细胞培养箱孵育20 min。孵育后消化细胞至1.5 mL的离心管,200×g离心5 min,用PBS 重悬,流式细胞仪(BD)检测。
2.5 Western blot实验 使用RIPA 裂解液提取细胞总蛋白,并使用BCA 法定量后,每个样品取20 μg 总蛋白进行SDS-PAGE(10%分离胶和5%浓缩胶),电转到PVDF 膜上,使用脱脂牛奶室温下封闭30 min,分别加入配制好的Ⅰ抗[CB1R 抗体(Thermo Fisher,1∶1 000)、AMPK 抗体(Abmart,1∶1 000)、p-AMPK(T172)抗体(Abmart,1∶1 000)和PGC-1α 抗体(武汉博士德生物工程有限公司,1∶1 000)],4 ℃孵育摇床过夜,洗膜后使用HRP 标记相应Ⅱ抗摇床上常温孵育30 min,ECL化学发光后曝光显影。
2.6 细胞免疫荧光染色 将细胞爬片放入24 孔板内,用多聚赖氨酸浸泡玻片5 min,37 ℃过夜烘干玻片,种H9C2大鼠心肌细胞于孔板的细胞爬片上培养4 h。CIH 处理后,加多聚甲醛固定15 min,再加入0.3% Triton X-100 处理15 min,加5%牛血清白蛋白封闭液封闭2 h。稀释Ⅰ抗(CB1R、p-AMPK 和PGC-1α)。将稀释过的Ⅰ抗加在玻片上,4 ℃过夜孵育。稀 释 Ⅱ 抗(Alexa Fluor 488 和 Alexa Fluor 594,Abmart,1∶300),加到细胞爬片上避光孵育2 h。在玻片上滴加DAPI(Abcam)染5 min 后滴加抗荧光淬灭封片剂(上海碧云天生物技术有限公司),将细胞爬片盖在载玻片上,在激光共聚焦显微镜和荧光显微镜下观察。
2.7 MitotTracker 染色 将 H9C2 细胞种到 12 孔板上,CIH 处理后,弃上清液,用PBS清洗2次,以1∶100比例稀释MitoTracker 染料(Thermo Fisher)和活细胞核染料(北京索莱宝科技有限公司)后,避光孵育20~30 min,在激光共聚焦显微镜下进行观察。
3 统计学处理
所有结果均以均数±标准差(mean±SD)表示,用GraphPad Prism 8.0 软件进行统计学分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 不同时间CIH 及靶向封闭CB1R 对H9C2 大鼠心肌细胞的影响
1.1 6 h CIH 对H9C2 大鼠心肌细胞有积极的保护作用 6 h CIH 组H9C2 大鼠心肌细胞凋亡较NC 组相比无显著差异(图1A、B、E),ROS 轻微升高(图1F)。MitoTracker 染色观察到,6 h CIH 组细胞线粒体的碎片化程度较轻,线粒体分裂增多,丝状线粒体增多(图2A、B)。JC-1 染色后线粒体红色荧光强度增高,绿色荧光强度减弱,线粒体膜电位水平较NC组显著升高(P<0.05),见图3。
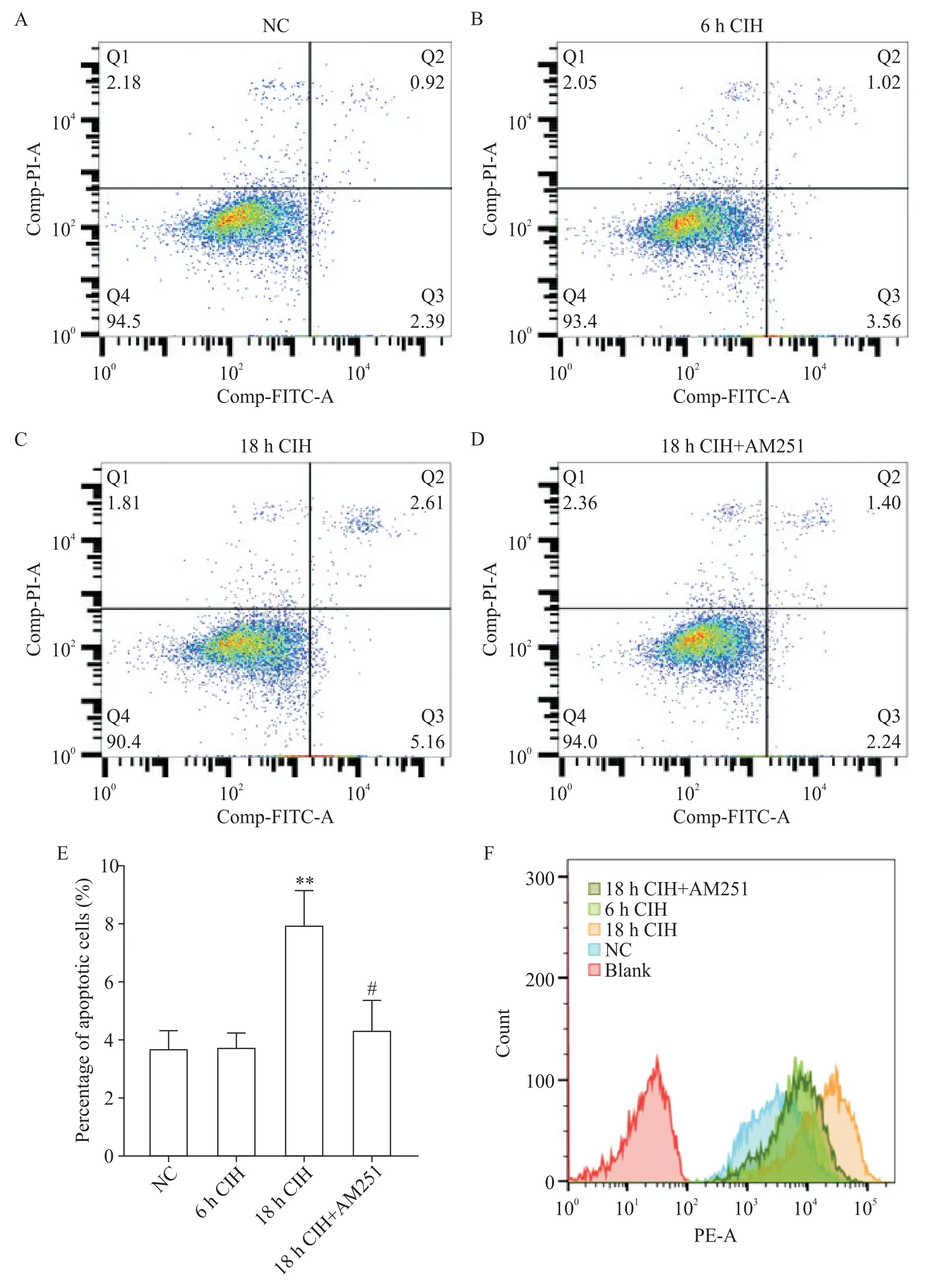
Figure 1. Detection of apoptosis and ROS in H9C2 rat cardiomyocytes in different experimental groups. A to D:the apoptosis of H9C2 rat cardiomyocytes was detected in different experimental groups;E:the percentage of apoptotic cells in different experimental groups;F:ROS in H9C2 rat cardiomyocytes was detected in different experimental groups. Mean±SD. n=3.**P<0.01 vs NC group;#P<0.05 vs 18 h CIH group.图1 不同实验组H9C2大鼠心肌细胞凋亡和ROS检测
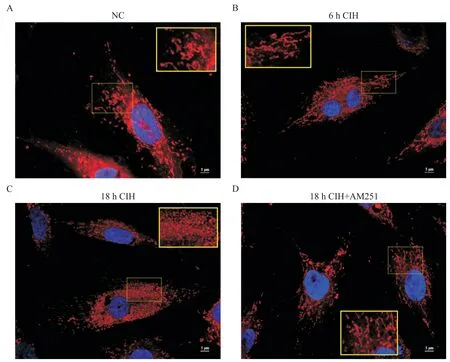
Figure 2. MitoTracker staining of H9C2 rat cardiomyocytes in different experimental groups(scale bar=5 μm). A:in NC group,the mitochondria were filamentous,spherical and rod-shaped,with different lengths;B:compared with NC group,the distribution of mitochondria in 6 h CIH group increased,including more filamentous and rod-shaped mitochondria;C:the mitochondria in 18 h CIH group were fragmented and the majority of them were spherical;D:compared with 18 h CIH group,the mitochondrial fragmentation in 18 h CIH+AM251 group decreased,and the shape and distribution of mitochondria were similar to those in NC group.图2 各实验组H9C2大鼠心肌细胞MitoTracker染色观察
1.2 18 h CIH 对H9C2 大鼠心肌细胞有损伤作用18 h CIH 组H9C2 大鼠心肌细胞凋亡程度较NC 组显著加重(P<0.01;图 1A、C、E),ROS 显著升高(图1F)。MitoTracker 染色可见线粒体碎片化程度加重(图2A、C)。JC-1 染色显示线粒体红色荧光强度减弱,绿色荧光强度增高,线粒体膜电位水平较NC 组显著降低(P<0.05或P<0.01),见图3。
1.3 靶向封闭CB1R 对18h CIH 条件下H9C2 大鼠心肌细胞有修复作用 18 h CIH+AM251 组细胞凋亡程度较18 h CIH 组显著降低(P<0.05;图1C、D、E),ROS 降低(图1F)。MitoTracker 染色可见线粒体的碎片化程度组减轻(图2C、D)。JC-1 染色显示较18 h CIH 线粒体红色荧光强度增高,绿色荧光强度减弱,线粒体膜电位水平升高(P<0.05 或P<0.01),见图3。
2 CB1R、AMPK、p-AMPK 和PGC-1α 在不同时间CIH处理的H9C2大鼠心肌细胞的表达情况
Western blot 结果显示,6 h CIH 组 H9C2 大鼠心肌细胞中CB1R 的表达显著增多(P<0.01),AMPK 和PGC-1α 的表达也有增加(P<0.05 或P<0.01);18 h CIH 组H9C2 大鼠心肌细胞中CB1R 的表达显著增多(P<0.01),AMPK 和 PGC-1α 的表达显著减少(P<0.01);相比于 18h CIH 组,18 h CIH+AM251 组心肌细胞中的 CB1R 表达显著降低(P<0.01),AMPK 和PGC-1α的表达显著增高(P<0.01),见图4。
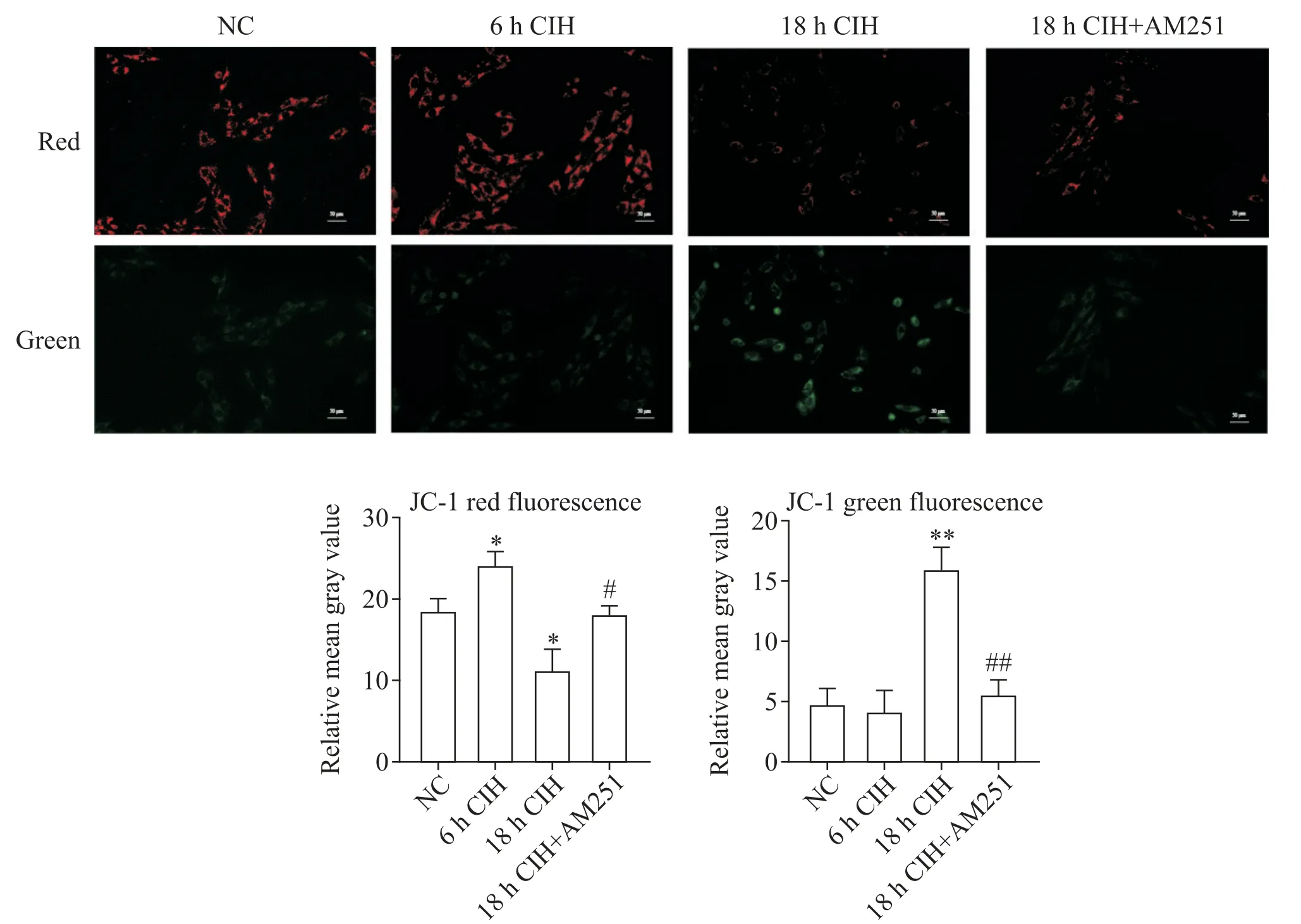
Figure 3. JC-1 staining of H9C2 rat cardiomyocytes in different experimental groups(scale bar=50 μm). Mean±SD. n=3.*P<0.05,**P<0.01 vs NC group;#P<0.05,##P<0.01 vs 18 h CIH group.图3 不同实验组H9C2大鼠心肌细胞的JC-1染色观察
细胞免疫荧光染色结果显示,6h CIH 组H9C2大鼠心肌细胞中CB1R 的表达显著增多(P<0.05),AMPK、p-AMPK 和 PGC-1α 的蛋白水平也显著升高(P<0.05 或P<0.01);而 18 h CIH 组 H9C2 大鼠心肌细胞中CB1R 的表达显著增多(P<0.01),AMPK、p-AMPK 和PGC-1α 的蛋白水平显著降低(P<0.01);相比于18 h CIH 组,18 h CIH+AM251 组心肌细胞中的CB1R 表达显著降低(P<0.05),AMPK、p-AMPK 和PGC-1α的蛋白水平显著升高(P<0.01),见图5。
讨 论
OSA 是心血管疾病的独立危险因素之一,针对OSA 进行有效治疗可以改善心血管疾病的预后、有效控制高血压、改善心功能、降低频发的心房颤动等,未经治疗的OSA 患者心血管疾病的患病风险增加[15]。持续气道正压通气(continuous positve air-way pressure,CPAP)作为目前临床最有效的治疗方式[16],因其昂贵的价格和较差的患者依从性,使OSA 的临床治疗处于“瓶颈期”,故为OSA 介导的心血管疾病开发一种新的药物可能对临床治疗继发性心血管疾病及减少医疗负担产生重大影响。
研究显示,CIH 对心血管疾病的发生发展有着消极的影响[17],但也有研究指出短期的CIH 对心血管有保护作用[18]。总之,目前国内外关于CIH 对心血管疾病影响的研究仍无统一定论。本研究在体外模拟OSA,通过细胞实验观察不同时间CIH 暴露下的H9C2大鼠心肌细胞及线粒体的变化,显示出不同程度的CIH 对H9C2 大鼠心肌细胞及线粒体作用不同。
本研究结果显示,短时间CIH 暴露下H9C2 大鼠心肌细胞线粒体膜电位较NC 组升高,线粒体功能增强,细胞ROS 轻度升高,但细胞凋亡与NC 组无显著差异。线粒体膜电位升高,可以促进细胞能量转换,并对线粒体进行氧化磷酸化、产生ATP 起到重要作用。适度ROS 升高可促进心肌预适应,也是缺氧-复氧后心肌保护的必要条件。所以,短时间的CIH 能够对心肌细胞及线粒体起到保护作用。随着CIH 时间的延长,我们观察到H9C2 大鼠心肌细胞出现损伤,细胞凋亡增多,ROS 水平显著增高,线粒体碎片化加重、膜电位降低,导致线粒体功能受损。这些结果显示,长时间的CIH 可对大鼠心肌细胞造成损伤。
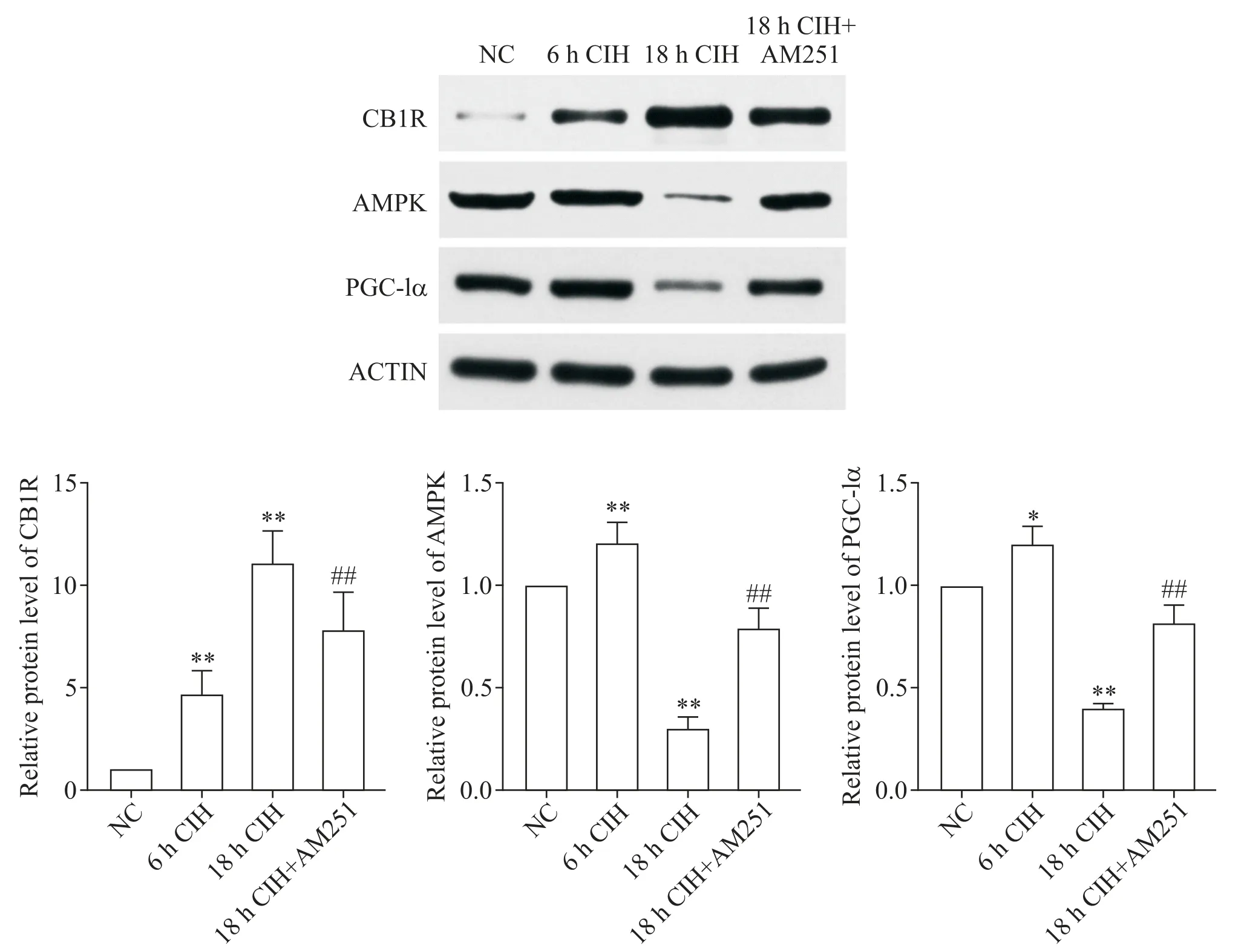
Figure 4. The expression of CB1R,AMPK and PGC-1α in H9C2 rat cardiomyocytes in different experimental groups was detected by Western blot. Mean±SD. n=3.*P<0.05,**P<0.01 vs NC group;##P<0.01 vs 18 h CIH group.图4 采用Western blot检测不同实验组H9C2大鼠心肌细胞中CB1R、AMPK和PGC-1α的表达情况
此外,我们检测到在短时间CIH 条件下,H9C2大鼠心肌细胞中 CB1R、AMPK、p-AMPK 和 PGC-1α的表达均有增高。长时间CIH 条件下,CB1R 表达升高,AMPK、p-AMPK 和 PGC-1α 的表达显著下降,而在长时间CIH 条件下给予CB1R 拮抗剂AM251 干预后,CB1R 表达下降,AMPK 和 PGC-1α 表达增高。可以看出,CB1R 对AMPK/PGC-1α 起到负性调控作用。结合文献报道,AMPK/PGC-1α 受多种因素影响,其中低氧可直接激活 AMPK/PGC-1α[19]。我们推测,短时间CIH 对AMPK 的直接激活作用超过了CB1R 升高对AMPK 的抑制作用,从而增加下游PGC-1α 的表达,促进心肌细胞线粒体的合成,代偿性地对心肌细胞起到积极的保护作用。但随着CIH 时间的延长,机体缺氧进一步加重,H9C2 大鼠心肌细胞中CB1R表达增多,抑制了AMPK/PGC-1α 信号通路的表达,引起心肌细胞及线粒体结构及功能的损伤。这些损伤可进一步导致心肌肥厚、心力衰竭和冠状动脉疾病等各种心血管疾病的发生。
使用 CB1R 拮抗剂 AM251 对 18 h CIH 条件下的H9C2 大鼠心肌细胞进行靶向封闭后,我们观察到,相较于单纯18 h CIH 组,AM251 干预后的大鼠心肌细胞形态有所恢复、线粒体膜电位升高、细胞凋亡减少、ROS 降低,同时我们也观察到H9C2 大鼠心肌细胞,CB1R 表达下降,AMPK 和 PGC-1α 表达增高。这些结果证明了CB1R 拮抗剂通过上调AMPK 和PGC-1α 的表达,对长时间CIH 损伤的大鼠心肌细胞及线粒体起到了一定的保护作用。
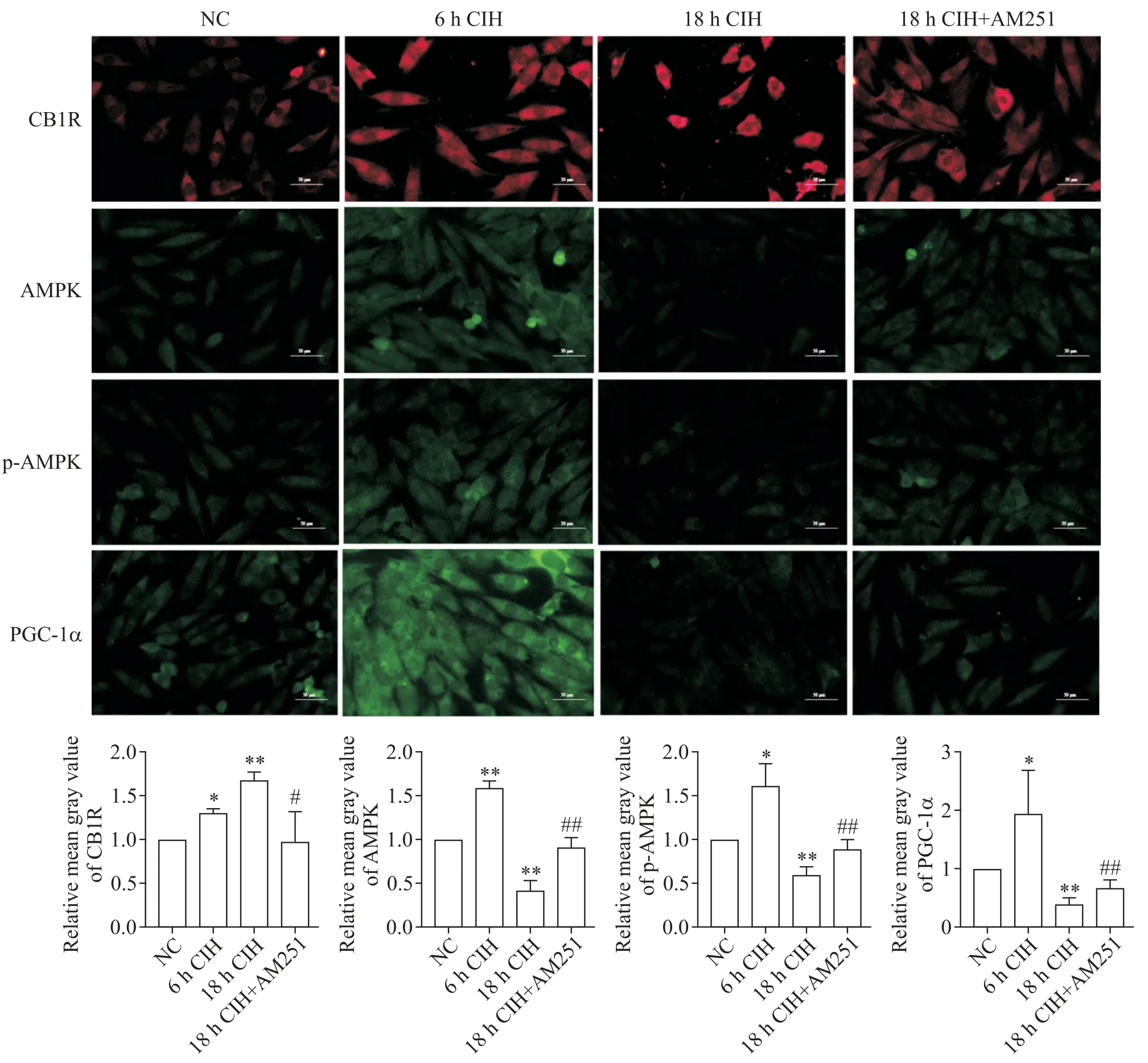
Figure 5. The protein levels of CB1R,AMPK,p-AMPK and PGC-1α in H9C2 rat cardiomyocytes in different experimental groups were detected by cellular immunofluorescence(scale bar=50 μm). Mean±SD. n=3.*P<0.05,**P<0.01 vs NC group;#P<0.05,##P<0.01 vs 18 h CIH group.图5 使用细胞免疫荧光检测不同实验组H9C2大鼠心肌细胞中CB1R、AMPK、p-AMPK和PGC-1α的蛋白水平
目前,国内外学者在CIH 介导心脏损伤的研究中,对CB1R 的报道尚属匮乏。本研究结果显示CB1R 参与了长时间CIH 导致的H9C2 大鼠心肌细胞损伤,并对AMPK/PGC-1α 信号通路起着负性调控作用,这使其可成为治疗OSA 介导的心血管疾病的新的靶点,并从细胞水平为临床OSA 相关心血管疾病的药物治疗提供了参考资料。
