应用膜片钳技术检测芍药苷及丹皮酚对多种离子通道电流的影响
2022-08-05苏敬泽魏执真
谭 弘,苏敬泽,韩 垚,魏执真
(1.北京宣武中医医院心内科,北京 100050;2.北京中医医院心内科,北京 100010)
膜片钳是一种通过记录离子通道的离子电流来反映细胞膜上离子通道分子活动情况的技术,近年来膜片钳技术发展迅速,为研究人员直接了解相关的门控动力学特征以及离子通道的通透性及生理特征等信息提供了方法和依据[1]。目前膜片钳技术已经广泛用于研究心肌细胞的离子通道活动,从而了解心肌细胞活性和受体功能的改变情况,帮助研究人员进一步明确相关药理作用机制,对心脏疾病的诊断和治疗提供理论依据支持[2],尤其在心律失常药物基础研究方面,膜片钳技术已成为最常用方法之一。
魏执真教授是国家级名老中医,北京中医医院心内科主任医师。调脉饮乃魏老总结多年临床实践经验所研制的用于治疗快速性心律失常的有效经验方,主要由牡丹皮、赤芍、太子参、麦冬、香橼等中药组成,功效以凉血清热,益气养心,行气通脉为主。调脉饮拆方实验研究发现加用凉血清热药赤芍、牡丹皮后与去赤芍、牡丹皮的行气通脉、益气养心组相比,对快速性心律失常的抑制作用更为显著,且能够降低心律失常的持续时间,表明2 种中药对心律失常具有明确的治疗作用,因此,本研究选择2 种中药的有效成分芍药苷和丹皮酚进行抗心律失常相关研究[3-4]。
芍药苷是一种单萜类糖苷化合物,是中药芍药的重要活性单体[5],具有解痉、抗血小板聚集、增加冠脉血流量及保护急性缺血心肌等作用[6-8]。丹皮酚又称牡丹酚,是中药牡丹皮和徐长卿的主要活性成分,具有安眠镇静,抗动脉粥样硬化,抗血小板聚集,降低血压等作用[9]。2 者皆为临床常用中药。本实验研究采用全细胞膜片钳技术观察芍药苷及丹皮酚对hERG、Iks、Katp、Cav 3.2、HCN2、HCN4 等离子通道的影响,探讨2 种药物在离子通道水平上的作用机制。
1 材料与方法
1.1 试验药物 芍药苷(批号:L07M9Q60533)与丹皮酚(批号:L15D9D77791)购自宣武医院,白色粉末状,纯度均≥98%,2~8℃保存。芍药苷用甲醇配制成2.04 mM 储液,用甲醇将供试品储液稀释成为1 mM 的稀释液,用10 mL 的细胞外液将稀释液稀释,配成1 uM,10 uM 液体。丹皮酚用乙醇配制成5.898 mM 储液,用乙醇将供试品储液稀释成为1 mMd 稀释液,用10 mL 的细胞外液将稀释液稀释,配成1 µM,10 µΜ 液体。供试品和阳性对照品储液保存在-20℃,供试品工作液及阳性对照品工作液需在实验当天配制,并在室温环境保存。
1.2 细胞及细胞培养 本研究采用心脏离子通道稳定表达的HEK293 或CHO 细胞系,分别表达基因如下:1)hERG(KCNH2)基因信息:NM_ 000238;2)IKs(KCNQ1/ KCNE1)基因信息:NM_000218 和NM_ 000219;3)KATP(KCNJ11/SUR2A)基因信息:NM_000525 和NM_ 005691;4)Cav 3.2(CACNA1H)基因信息:NM_ 021098;5)HCN2 基因信息:NM_ 001194;6)HCN4 基因信息:NM_005477。上述所有细胞均用含10%胎牛血清的DMEM 或F12 培养基,在37℃、5% CO2孵育箱中培养,以备膜片钳实验用。为了维持基因表达,细胞外液根据基因抗性加入0.8 mg/mL G418 或200 µg/mL Hygromycin B。为维持细胞的离子通道表达,细胞的密度均不超过80%。
1.3 干细胞诱导分化心肌细胞培养 干细胞诱导分化心肌细胞购于南京百寿生物科技有限公司(NovoCellTM)。在温度为4℃冰面上添加心肌细胞铺板液至完全覆盖培养皿/瓶中底部,37℃包被过夜。将用液氮保存的NovoCellTM 心肌细胞(20180915)以37℃水浴。消毒冻存管外表面后将细胞转移至离心管中,以 DPBS 稀释细胞悬液后,300 g 离心5 min。祛上清后加入心肌细胞复苏液(Plating Medium 400201),将混匀的细胞悬液接种到包被过的培养皿/瓶中,八字晃动使之均匀分布。5% CO2的37℃恒温培养箱中培养24~72 h 后,更换成心肌细胞培养基(Maintenace Medium 400305),每48 h 换液1 次。
1.4 膜片钳记录 毛细玻璃管经微电极拉制仪拉制成记录电极。在倒置显微镜下将玻璃电极接触到细胞上,之后快速给予一定的负压使细胞膜表面吸附至玻璃电极尖端,形成高阻封接。形成高阻封接后开始快速进行电容补偿,再继续给予负压直至吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容及串联电阻。未给予漏电补偿。
在倒置显微镜下进行记录,当记录电流保持3~5 min 稳定后开始给药处理,从低浓度到高浓度依次给药,每个药物浓度作用时间5 min 左右,决定给予下一个浓度的依据是前一个浓度能稳定1 min 左右的电流大小。利用重力给药系统将含不同浓度的测试化合物以及不含化合物的细胞外液按照浓度高低从低到高依次流经显微镜记录浴槽并作用于细胞,同时使用真空泵进行液体交换。每一个细胞在不含化合物的外液中检测到的电流作为自己的对照组。独立重复检测2个细胞。所有试验均在室温下进行。记录各种心脏离子通道电流的条件如下:
1.4.1 快速延迟整流钾电流(hERG)细胞外液(mmol/L)NaCl 140,KCl 3.5,MgCl21,CaCl22,Glucose 10,HEPES 10,NaH2PO41.25,NaOH 调节pH=7.4;细胞内液(mmol/L)KCl 20,K-Aspartic 115,MgCl21,EGTA 5,HEPES 10,Na2-ATP 2,KOH 调节pH=7.2。细胞holding电压钳制于-80 mV,之后钳制电压去极化至+30 维持2.5 s,之后恢复至-50 mV 维持4 s,每隔10 s 重复采集数据,观察对药物hERG 尾电流的作用。
1.4.2 缓慢延迟整流钾电流(Iks)细胞外液(mmol/L)NaCl 140,KCl 3.5,MgCl21,CaCl22,Glucose 10,HEPES 10,NaH2PO41.25,NaOH 调节pH=7.4;细胞内液(mmol/L)K-Aspartic 120,MgCl25,EGTA 5,HEPES 10,Na2-ATP 4,Na2-GTP 0.3,Phosphocreatine disodium salt 14,20 u/mL Creatine phosphor kinse,KOH 调节pH=7.2。细胞holding 电压钳制于-80 mV。钳制电压由-80 mV 去极化至+60 mV 维持5 s,然后阶跃至-40 mV 维持4 S,以此刺激出IKs 通道的尾电流,间隔20 s 重复记录,记录给药前后IKs 电流峰值的影响。
综上所述,体外冲击波联合扶他林乳胶剂可更好地发挥体外冲击波的物理生物学效应和扶他林消炎镇痛的效果,并产生叠加效应,从而显著提高OA患者的膝关节功能,减轻膝关节疼痛症状。但在临床应用过程中冲击波的冲击强度、频率以及治疗周期等参数还有待规范,并且本研究观察周期短,其长期疗效及治疗机制仍有待进一步研究。
1.4.3 ATP 敏感钾通道(KATP)细胞外液(mmol/L)NaCl 140,KCl 3.5,MgCl21,CaCl22,Glucose 10,HEPES 10,NaH2PO41.25,NaOH 调 节pH=7.4;细 胞内 液(mmol/L)KCl 20,K-aspartic 115,HEPES 10,MgCl21,EGTA 5,KOH 调节pH=7.2。细胞holding 电压钳制于-70 mV,之后阶跃至-110 mV 维持100 ms,执行Ramp 刺激至10 mV,维持1 000 ms,每隔10 s 重复采集数据,记录给药前后Katp 钾通道电流的影响。细胞外液中加入100 μM Pinacidil 激发Katp 电流。
1.4.4 T 型钙电流(Cav3.2)细胞外液(mmol/L)TEA-Cl 140,MgCl22,CaCl210,HEPES 10,Glucose 5,TEA-OH 调节pH=7.4;CsCl 120,MgCl21,HEPES 10,Mg-ATP 4,EGTA 10,Na2-GTP 0.3,CsOH 调节pH=7.2。细胞holding 电压钳制于-60 mV。钳制电压由-60 mV去极化至+10 mV 维持0.3 s,每隔20 s 重复采集数据,记录给药前后T 型钙通道电流峰值,并计算作用效应。
1.4.5 超极化激活的环化核苷酸门控通道电流(HCN2,HCN4)细胞外液(mmol/L)NaCl 75,KCl 60,HEPES 10,Glucose 10,NaH2PO41.25,MgCl21,CaCl2 2,NaOH 调节pH=7.4;细胞内液(mmol/L)NaCl 1,140 K-Gluconate,CaCl20.1,MgCl21,HEPES 10,EGTA 1,Mg-ATP 2,NaOH调节pH=7.2。细胞holding 电压钳制于-30 mV,钳制电压由-30 mV 阶跃至-120 mV 保持1 000 ms,最后恢复至holding 电压-30 mV,记录给药前后通道电流峰值的影响。
1.4.6 干细胞诱导分化心肌细胞动作电位 细胞外液(mmol/L)NaCl 140,KCl 3.5,MgCl21,CaCl22,Glucose 10,HEPES 10,NaH2PO41.25,NaOH 调节pH=7.4;细胞内液(mmol/L)KCl 20,K-Aspartic 115,MgCl21,EGTA 5,HEPES 10,Na2-ATP 2,KOH 调节pH=7.2。当形成全细胞封接后,转为电流钳模式,细胞膜电流钳制于0 pA,连续记录心肌细胞自发动作电位。
1.5 数据分析 试验数据由EPC-10 放大器(HEKA)进行采集并储存于PatchMaster(HEKA)软件中。首先将每一个药物浓度作用后的电流和空白对照电流标准化,然后计算每一个药物浓度对应的抑制率。对每一个浓度计算平均数和标准差,典型电流趋势图以及电流图利用IGOR 软件完成。
2 结果
2.1 芍药苷对各离子通道的抑制比例结果比较 见表1。
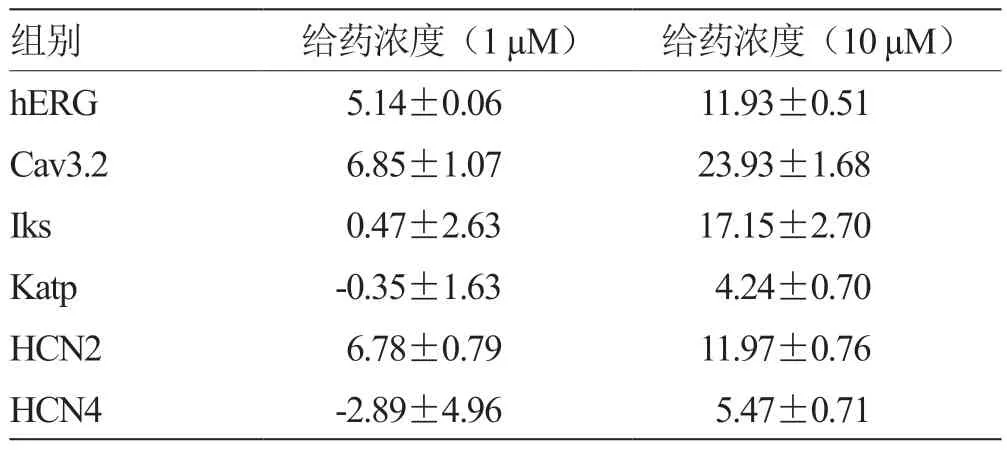
表1 芍药苷对各离子通道的抑制比例结果比较 %
2.2 丹皮酚对各离子通道的抑制作用结果比较 见表2。

表2 丹皮酚对各离子通道的抑制作用结果比较 %
2.3 2 种浓度药物对离子通道的抑制作用结果 见表3。

表3 2 种浓度药物对离子通道的抑制作用结果比较 %
结果显示2 组不同浓度的药物对离子通道的抑制作用具有显著性差异。10 uM 浓度的药物对离子通道的抑制作用明显优于1 uM。芍药苷及丹皮酚对离子通道的阻断作用皆具有浓度依赖的特点。针对不同的离子通道,芍药苷对Cav 3.2 离子通道的抑制作用较明显,如图1 所示,丹皮酚对IKs 通道的抑制作用较显著,如图2 所示。
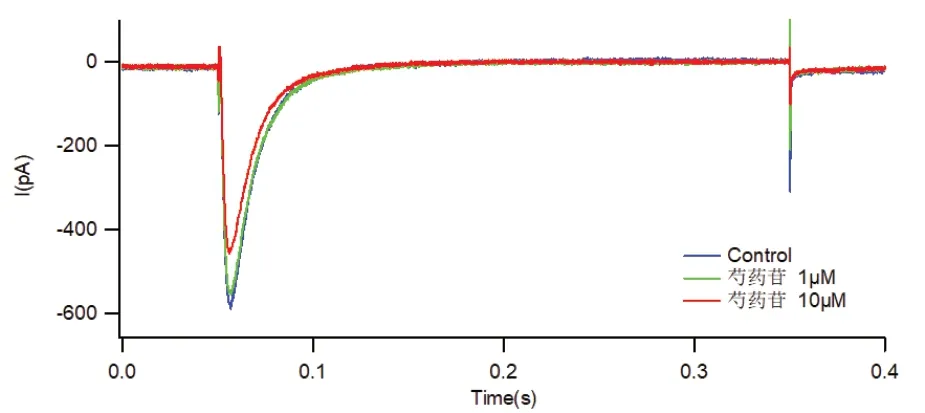
图1 芍药苷对Cav 3.2 通道作用
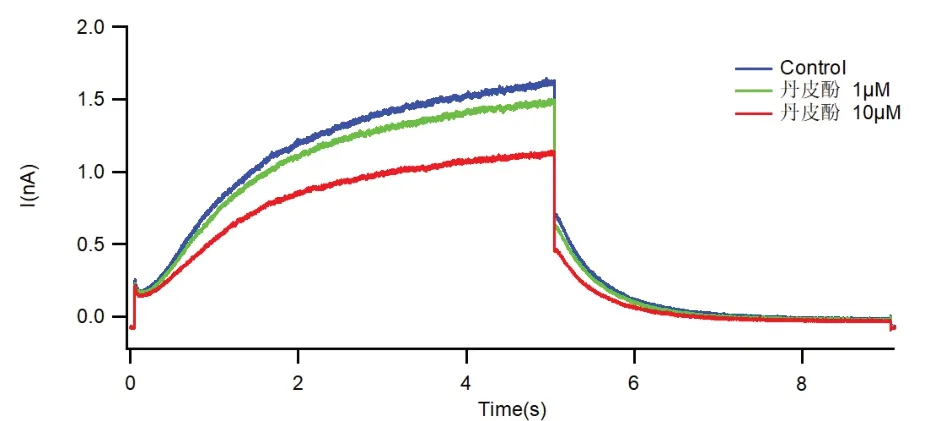
图2 丹皮酚对IKs 通道作用
3 讨论
芍药苷是中药芍药的主要有效成分之一。既往研究证明芍药苷对心肌L 型钙通道、钾离子通道IK1有确切的抑制作用,并且浓度越高阻滞作用越明显[10-11]。此次试验结果显示芍药苷对多个离子通道的电流均有一定的抑制作用,而且均呈浓度依赖性,尤其对Cav 3.2 离子通道峰值电流的抑制作用较显著。Cav 3.2 是T 型钙通道的一种,T 型钙通道多分布于心脏,神经和内分泌等系统。心肌细胞膜上主要存在L型及T 型2 种钙通道。T 型钙通道在窦房结、房室结及浦肯野纤维等心脏起搏和传导系统中分布较广泛,主要起到维持心脏自律性的作用,因此当心肌T 型钙通道的分布出现变化时,心肌细胞的自律性不能维持,往往导致心律失常的发生[12]。此次试验结果显示芍药苷对Cav 3.2 离子通道的阻断作用明显,因此可以对窦房结、房室结等传导系统起到一定的抑制作用,从而起到减慢心率,治疗快速性心律失常的作用。除了在维持心肌细胞自律性中发挥重要作用,T 型钙通道还与细胞增殖和生长关系密切[13-14],心肌肥大时 T 型钙通道表达明显增多。心肌细胞肥大病理改变常见于心衰患者,而在心衰患者中心律失常发病率极高,是导致患者猝死的主要原因之一。因此芍药苷可能具有抑制心肌重构效应,较适用于快速性心律失常合并心衰的患者。
丹皮酚是牡丹根的有效成分之一。既往研究证实,丹皮酚对心肌钙离子通道电流具有抑制作用[15],可以用于治疗心律失常[16]。本次研究结果显示丹皮酚对IKs 通道的抑制作用较为明显,并且也表现出浓度依赖性的特点。IKs 通道是钾离子通道的一种。钾离子通道主要在心肌动作电位的复极过程发挥作用,主要由IKr和IKs 2 种离子通道组成。IKs 通道为慢激活的延迟整流钾电流,是目前临床常用III 类抗心律失常药起效的重要作用靶点,主要作用于动作电位后期平台期。IKs阻断剂可以有效延长动作电位时程,起到抗心律失常的作用。有研究认为相对于IKr 阻断剂,IKs 阻断剂致心律失常副作用更低,安全性更高[17]。课题组前期结果已经证实调脉饮能够降低心肌LTCC β2的表达及L型钙通道活性,减少钙超载[3],还可以延长动作电位时程和动作电位有效不应期[18],结合本次研究结果课题组认为芍药苷和丹皮酚均为调脉饮的重要组成部分,其对Cav 3.2 通道和IKs 通道的抑制作用极有可能是调脉饮发挥抗心律失常作用的机制之一。本研究结果亦显示出2种中药对多个离子通道均有一定的抑制作用,因此调脉饮方抗心律失常作用应是通过多靶点联合作用,阻断多个离子通道电流活性实现的。
随着医疗技术的发展,射频消融、起搏器等治疗心律失常的方法已经广泛应用于临床,但由于有创的操作方式、价格昂贵、临床适应症等原因,药物仍是心律失常的一线治疗手段。传统西药虽然具有起效快、疗效明确的优势,但在发挥临床疗效作用的同时,也可产生多种不良反应,尤其药物致心律失常发生率较高,导致患者依从性低,增加临床治疗难度。并且西药以单离子通道阻断剂多见,作用靶点较单一,抗心律失常谱相对较窄,临床使用受限较多。相对于单离子通道阻断剂而言,多离子通道阻断剂具有更好的调节和控制作用,能够更好的促进离子通道功能恢复,致心律失常不良反应发生率较低[19],甚至还可以起到抑制心肌重构,改善患者预后,提高生活质量的积极作用[20]。因此在中草药中寻找更安全、更有效的防治药物,是开发抗心律失常药物的重要创新途径。
近年来由于膜片钳技术在中药研究中应用越来越广泛,越来越多关于中药对离子通道的调控作用被揭示出来。大量研究结果表明在抗心律失常方面,中药具有良好的治疗效果,并且适应症更广,应用前景广泛,副作用小,价格相对低廉,安全性亦更强。但由于中药作用靶点较多,作用机制复杂,仍需进一步的试验验证和数据挖掘。此次试验结果发现中药对离子通道的作用与药物浓度关系密切,即药物浓度越高对离子通道的阻断作用越明显,这也与之前许多相关试验结果相吻合。因此在以后的试验中应设立多个给药浓度,从而确定最有效的治疗浓度。目前中药临床应用多以复方为主,中药复方组成复杂,成分众多,存在多个中药单体可以同时发挥抗心律失常效应甚至增加协同作用的情况,而目前针对离子通道的研究主要以中药单体或中药拆方多见,因此要在今后的研究中增加不同的药对或药物组合,尤其是关于药物交叉作用的离子通道研究,以便更加精确找到中药抗心律失常的作用靶点,将对中医中药发挥治疗心律失常等心脏疾病具有极其重大的意义。
