纳美芬对单次蛛网膜下腔阻滞行剖宫产术后吗啡镇痛的影响
2022-08-05姚芳尚游
姚芳,尚游
(1.朝阳市第二医院,辽宁 朝阳 122000;2.锦州医科大学附属第一医院,辽宁 锦州 121000)
疼痛是一种主观极不愉快的感觉和情绪,是机体对有害刺激的一种本能反映。近年来随着医疗模式的转变,各级医院对治疗过程中疼痛的控制日益重视,目前疼痛已被医学界定为继血压、呼吸、脉搏、体温后的第五大生命体征[1]。术后疼痛的来源主要是手术创伤、生理性应激、镇痛药物迅速代谢及心理压力等。临床调查显示,80%以上的患者术后会发生急性疼痛,其中中重度疼痛约占75%,而术后无明显疼痛的患者不足20%的患者[2]。重度疼痛会影响呼吸、循环、免疫系统功能,对患者的身体恢复、功能转归和生活质量均会产生不同程度的负面影响,并可能引发心律失常、高血压、心脑血管意外等并发症,甚至转变为慢性疼痛[3]。剖宫产术后疼痛与其它外科手术后镇痛不同,其疼痛来源包括腹部切口疼痛、内脏牵拉疼痛及子宫收缩疼痛。两种疼痛在脊髓及以上水平的传导路径不同,所以对镇痛药物的反应程度不同。所以目前指南尚无统一的剖宫产术后镇痛方法,同时由于产妇需要照护新生儿、哺乳等,临床对剖宫产术后镇痛的要求较高。吗啡是阿片类强效镇痛药物,鞘内给药用药剂量小、镇痛效果确切、安全性高,临床常用于剖宫产术后镇痛。但其恶心、呕吐、成瘾性、皮肤瘙痒甚至呼吸抑制等不良反应发生率较高[4],给患者带来不佳的体验,影响产后恢复。吗啡具有双重模式,小剂量的吗啡与抑制性G-蛋白耦联的受体结合后可调高环磷酸腺昔-腺昔酸环化酶-蛋白激酶A信号传导通路,增加兴奋性阿片受体Gs数量,易导致痛觉过敏。所以临床在应用吗啡镇痛时可联合小剂量阿片受体拮抗剂纳洛酮,一方面可阻断阿片类药物所致的痛觉过敏,增强镇痛作用,还可降低术后不良反应。纳美芬是新一代吗啡特异性拮抗剂,研究显示作用时间是纳洛酮的10~20倍[5]。本研究观察小剂量纳美芬静脉给药对剖宫产术后蛛网膜下腔吗啡镇痛的影响,为临床提供参考,现报道如下。
1 资料与方法
1.1 一般资料
经院医学伦理委员会批准,入组患者知情同意,将朝阳市第二医院2020年1月至2020年12月的100例拟在单次蛛网膜下腔阻滞下行剖宫产术的产妇作为研究对象,采用数表随机法分为两组,对照组50例,年龄23~37岁,其中初产妇31例,经产妇19例;纳美芬组50例,年龄23~39岁,其中初产妇30例,经产妇20例;两组年龄、孕周、体质量指数(BMI)、剖宫产术时间、ASA分级构成差异均无统计学意义(P>0.05),见表1。
表1 两组产妇基线比较
1.2 纳入及排除标准
纳入标准:(1)年龄23~40岁,知情同意研究方法,签署知情同意书;(2)足月单胎,行剖宫产术者;(3)有腰麻适应症;(4)ASA分级Ⅰ~Ⅱ级;(5)实验室检查肝、肾功能及血常规正常,无凝血功能障碍者。排除标准:(1)有纳美芬过敏、阿片类药物依赖者;(2)术中发生大出血,或子宫收缩不佳者;(3)术中加用辅助镇痛药品者;(4)合并妊娠期糖尿病、妊娠高血压综合征者;(5)合并严重心、肝、肺、肾疾病者;(6)有药物滥用史、药物过敏史者;(7)脊柱畸形者;(8)有精神、神经类疾病者。
1.3 麻醉方法
两组产妇麻醉均由同一名麻醉医师实施完成。术前常规禁食禁饮,入室后常规心电监护,建立静脉通路,鼻导管吸氧。协助患者呈右侧卧位,选择L2~L3椎间隙作为穿刺点,成功穿刺后,置入腰麻针,回抽见脑脊液后,向蛛网膜下腔注入腰麻液,速度适当以0.2 mL/s速度为宜。腰麻液为用10%葡萄糖配置的0.5%重比重布比卡因(10 mg)与吗啡(0.2 mg)共计2.2 mL。协助产妇呈平卧位,针刺法测量麻醉平面达 T4~T6后开始手术。手术开始后每间隔3 min测量1次无创血压,当收缩压<90 mmHg或血压值<基础值的30%时,静脉注射15~30 mg麻黄素,当心率<50次/分钟时,静脉注射0.3~0.5 mg阿托品。手术结束时对照组产妇给予生理盐水5 mL静脉注射。纳美芬组给予0.1 μg/kg 纳美芬注射液5 mL 静脉注射。
1.4 观察指标
术后第3、6、12、24小时采用视觉模拟(VAS)由产妇根据剖宫产术后疼痛程度进行评价,评分标准0分:无痛;1~3分:平卧不动时无痛,但咳嗽翻身有轻至中度疼痛感;4分:平卧不动时有时断时续的可耐受的疼痛感;5分:平卧不动时有持续的,可耐受的疼痛感;6分:平卧不动时感觉的较重的疼痛感,勉强可能忍受;7分:平卧不动时有难以忍受的重度疼痛感;8分:术后持续疼痛难忍,大汗淋漓;9~10分:持续剧烈疼痛无法忍受。记录术后镇痛期间不良反应,包括恶心、呕吐、瘙痒的发生率。
1.5 统计学方法
2 结 果
2.1 两组剖宫产术后各时间点疼痛程度比较
两组剖宫产术后第3、6、12、24小时VAS评分比较差异均无统计学意义(P>0.05),见表2。
表2 两组术后各时间点VAS评分比较
2.2 不良反应比较
对照组恶心、呕吐、瘙痒的发生率分别为36.00%、12.00%、14.00%,纳美芬组恶心、呕吐、瘙痒的发生率分别为4.00%、0.00%、2.00%;纳美芬组3项不良反应发生率均低于对照组,组间比较差异有统计学意义(P<0.05)。两组下肢麻木发生率比较差异均无统计学意义(P>0.05),见表3。
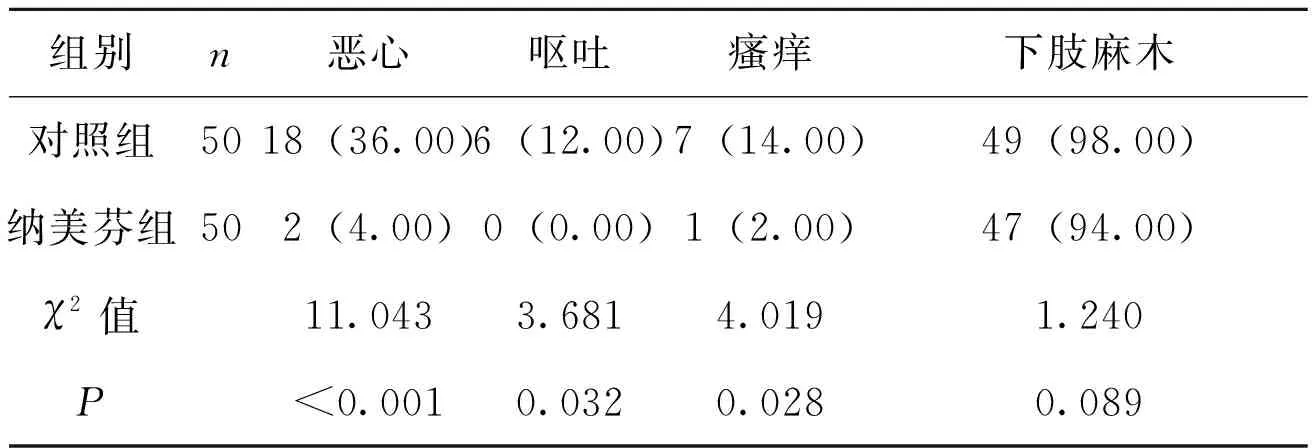
表3 两组不良反应发生率比较[n(%)]
3 讨 论
虽然剖宫产术后硬膜外腔自控镇痛具有较好的镇痛效果,但硬膜外导管长时间放置于硬膜外腔易引发一系列并发症,如感染、神经损伤。所以本研究于剖宫产术后采用单次蛛网膜下腔一次性进行给药,可避免硬膜外导管长时间放置引起的并发症。阿片类药物是一类异质性的化合物,注入后可与体内的阿片受体结合而发挥镇痛作用。吗啡是临床镇痛常用的阿片类药物,虽然临床反应其瘙痒、恶心、便秘甚至呼吸抑制等不良反应的发生率较高[6],但由于至今尚无其他药品可以替代。所以有学者提出联合应用小剂量阿片受体拮抗剂来减少吗啡的不良反应。纳洛酮是常用的阿片受体拮抗,研究显示,小剂量纳洛酮一方面可阻断阿片类药物所致的痛觉过敏,增强镇痛作用,还可降低术后不良反应。有研究[7]将全麻术后吗啡自控镇痛的患者随机分为两组,实验组给予0.25 μg/(kg·h)纳洛酮持续泵注,对照组给予等量的生理盐水持续泵注,结果两组患者术后VAS疼痛评分比较差异无统计学意义。但实验组患者不良反应发生率明显低于对照组,差异有统计学意义。武林鑫等[8]研究显示,术中输注0.1 μg/(kg·h)纳洛酮可抑制瑞芬太尼诱发的痛觉过敏。上述研究均提示小剂量的纳洛酮对阿片类药物有较好的拮抗作用,这一结果得益于阿片受体的双向作用模式,即大剂量的阿片受体拮抗可从抑制性G蛋白偶联的受体中把阿片类药物置换出来,发挥其拮抗作用;而小剂量或超低剂量的拮抗剂则只能从兴奋性G蛋白偶联的受体中置换出阿片类药物,从而降低不良反应,并增加阿片类药物的镇痛作用[9]。
纳美芬是新一代吗啡特异性拮抗剂,可通过静脉、口服等多种途径给药,无明显的首关消除作用和不良反应[10-11]。研究显示纳美芬的作用时间是纳洛酮的10~20倍,其药理作用是竞争性拮抗阿片受体μ、受体α、受体κ等[12]。临床证实小剂量纳美芬静脉注射可拮抗鞘内吗啡的不良反应而不影响其镇痛效果。本研究结果也显示,两组剖宫产术后第3、6、12、24小时VAS评分比较差异均无统计学意义(P>0.05)。脊髓背角胶质层的血流量小,小剂量纳洛酮和小剂量纳美芬静脉给药,药物浓度较低,均不会对吗啡硬膜外镇痛的效果产生影响。研究显示[13],微摩尔浓度的纳洛酮可以完全阻断阿片受体的抑制性,而阻断阿片受体的兴奋性则仅需皮摩尔浓度的纳洛酮,提示仅需小剂量的阿片受体拮抗剂就可拮抗阿片受体的兴奋性,而不对抑制性作用产生影响。分析其机制可能是小剂量阿片受体拮抗剂不会阻断Gi/Go耦联阿片受体抑制性作用,只是特异性阻断Gs耦联阿片受体的兴奋作用。动物实验研究也证实了这一观点[14]。纳美芬具有与纳洛酮相同的阿片受体拮抗作用,由于纳美芬本身并不拮抗吗啡的镇痛作用。所以两组术后吗啡的镇痛效果相当。两组不良反应比较显示,纳美芬组恶心、呕吐、瘙痒的发生率为分别为4.00%、0.00%、2.00%;均低于对照组的36.00%、12.00%、14.00%,差异有统计学意义(P<0.05)。由于纳洛酮对阿片药物的拮抗时间较短,药物动力学研究显示,纳洛酮静脉给药后2 min即可达最大拮抗效应,但作用持续时间仅为45~90 min,持续时间较短,不能在有效时间内拮抗吗啡的不良反应[15]。而纳美芬静脉注射半衰期大约11 h,作用时间大幅度延长,所以对照组术后恶心、呕吐、瘙痒等并发症发生率高于纳美芬组。但两组下肢麻木发生率比较差异均无统计学意义(P>0.05)。引起下肢麻木的原因可能是术中低浓度局部麻醉药的残余作用,与阿片药物的拮抗时间无关。
综上所述,纳美芬辅助剖宫产术后蛛网膜下腔吗啡镇痛不会影响吗啡镇痛效果,可降低术后不良反应发生率,是剖宫产术后镇痛的较好选择,值得临床推广。
