基于线粒体COⅠ基因的9个青鱼群体遗传变异分析
2022-08-04鲍生成包天杰王沈同徐晓雁代雅凡张家华李家乐沈玉帮
鲍生成 包天杰 王沈同 徐晓雁, 代雅凡 张家华 李家乐, 沈玉帮,
(1.上海海洋大学农业农村部淡水水产种质资源重点实验室,上海 201306;2.上海海洋大学上海水产养殖工程技术研究中心,上海 201306)
青鱼(Mylopharyngodon piceus)肉味鲜美、生长快,且具有较高的营养价值,是我国四大家鱼之一,在我国的珠江到长江、黑龙江都有分布,且在全国各地广泛养殖。但是近些年由于生态环境的破坏,我国青鱼的野生群体量严重下降[1,2],使得推进青鱼种质资源遗传多样性调查和研究工作尤为重要。线粒体DNA分子结构简单,可以自我复制,不易发生基因重组,进化速率较快。目前为止,已经广泛被应用到鱼类种群的遗传结构研究中,且青鱼的遗传进化研究中也有了一定的基础。
付晓艳等[3]最早于2004年对长江和珠江水系4个不同地点54尾青鱼样本的线粒体Cytb基因遗传多样性进行了分析,发现4个群体的遗传分化程度和遗传多样性水平都较低。谢启明等[4]运用线粒体Cytb基因与D-loop区两种分子标记分析了3个青鱼养殖群体的遗传结构,结果发现群体间遗传多样性较丰富,出现了高度分化,基因交流明显,且受到纯化选择作用。杨宗英等[5]基于mtDNA序列分析了长江中游5个野生青鱼群体的遗传结构,发现青鱼群体可能经历过种群扩张事件且各青鱼群体间遗传分化不明显。王丰等[6,7]使用自主开发的12个微卫星标记分析了4个野生群体及1个养殖群体青鱼的遗传结构,发现5个群体具有较高的遗传多样性,养殖群体与4个野生群体遗传距离较远。
对青鱼遗传结构的了解是保护种质资源的前提条件。当前以对于线粒体DNA开展青鱼的遗传多样性研究,主要是以D-loop区、Cytb基因为主,目前尚且没有以线粒体COⅠ基因为分子标记分析青鱼遗传结构的研究。本研究采用COⅠ基因为研究区域,通过测序对9个地理群体共271个样本进行研究,目的是通过分析群体间的遗传多样性和遗传分化程度,从而调查青鱼目前的种质资源状况和遗传关系,为青鱼种质资源的保护和创新奠定理论基础。
1 材料与方法
1.1 样本采集和DNA提取
本研究所用青鱼分别收集于湖北石首、湖南湘江、扬州邗江、浙江嘉兴、江西瑞昌和陕西新民四大家鱼原种,以及江苏吴江、广东佛山和广西西埌四大家鱼良种场(表1)。将收集到的青鱼样本剪其鳍条,保存在无水乙醇中并储存在-20℃冰箱。

表1 九个青鱼群体采集信息Tab.1 Sampling Information of nine populations of M.piceus
使用pall corporation的96孔过滤板进行DNA的提取[8],使用1%琼脂糖凝胶电泳检测其纯度,分光光度计Nanodrop 2000(Thermo Scientific,美国)检测A260/280值及浓度。
1.2 COⅠ基因序列引物设计及PCR扩增
引物设计根据NCBI中MT084757的COⅠ序列,使用Primier6设计引物,验证其特异性后,交至上海生工生物公司合成。引物序列为5′-GGAATAGT GGGAACCGCTCT-3′和5′-GATGGCAAATACGGC ACCTA-3′。
PCR扩增PCR反应体系20 μL,包含2×TaqPCR MasterMix(含染料) 10 μL,ddH2O 6.5 μL,上下游引物各(浓度为10 μmol/L)1 μL,模板DNA 1.5 μL。PCR反应程序:94℃预变性3min;94℃变性30s,52℃退火30s,72℃延伸15s,35个循环;72℃延伸10min,4℃保存。PCR产物送至上海生工生物公司进行测序。
1.3 数据分析
使用Sequencher 5.4.6[9]软件对测序结果进行多序列对比,使用DNASP5.0[10]软件分析群体的突变位点(S)、单倍型数(H)、单倍型多样性(Hd)、核苷酸多样性(π)、平均核苷酸差异数(K)、基因流(Nm),Network 5.0软件进行单倍型网络图的绘制,Arlequin3.5[11]软件计算遗传分化指数、分子方差变异(AMOVA)分析,使用MEGA 5.0[12]软件进行群体间遗传距离的计算及进化树的构建。
2 结果
2.1 序列分析
对 9个青鱼群体的个体进行扩增和测序,将得到的序列结果进行校正、拼接、删除两端多余的序列后得到的COⅠ基因长度为1003 bp。4 种碱基在9 个群体的分布基本一致,A、C、G和T的平均含量分别为26.34%、27.26%、19.00%和27.39%,A+T含量(53.73%)高于G+C(46.27%)含量。COⅠ基因序列包含6个变异位点,全部为转换位点,且以A/G之间的转换为主。
2.2 遗传多样性分析
江苏邗江群体的单倍型最多,有7种单倍型,湖北石首、湖南湘江群体有5种单倍型,广西西埌群体、江西瑞昌群体和江苏吴江群体有4种单倍型,陕西西安群体和广东佛山群体有3种单倍型。9个群体的单倍型多样性为0.403—0.847,江苏邗江群体的单倍型多样性最高,为0.847(Hd>0.800),除广东佛山外其他青鱼群体单倍型多样性也较高(0.500<Hd<0.800),而广东佛山群体遗传多样性最低,为0.403。9 个群体的核苷酸多样性为0.00109—0.00244,青鱼群体整体核苷酸多样性较低,江苏邗江群体的核苷酸多样性最高 (π=0.00244),而广东佛山的核苷酸多样性最低(π=0.00109)。江苏邗江群体中的平均核苷酸差异数最多为 1.86207,广东佛山群体最少为0.83131(表2)。
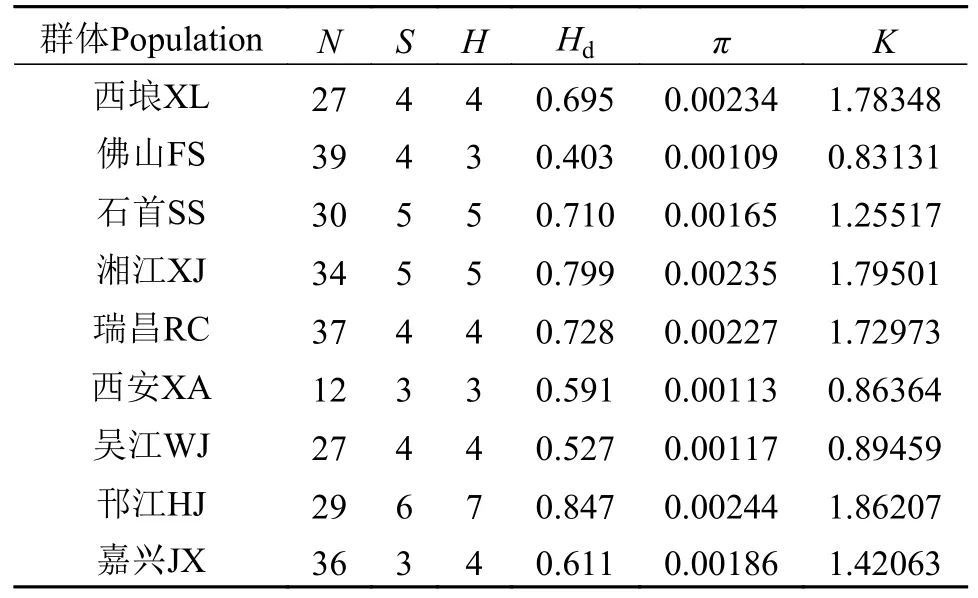
表2 青鱼群体COⅠ基因遗传多样性参数Tab.2 Genetic diversity parameters of COⅠ gene in M.piceus population
2.3 青鱼群体遗传分化及系统发育
基于Kimura2-paramester模型计算了9个青鱼群体的种内和种间遗传距离(表3)。佛山群体与西安群体、吴江群体,西安群体与吴江群体间的遗传距离最小为0.001,其余群体间遗传距离相同,且大多集中在0.002。西埌与湘江、邗江群体,瑞昌与湘江群体间的遗传距离最大为0.003,在本实验中,青鱼各群体间的遗传距离在0.001—0.003,远未达到亚种的分化标准[7]。
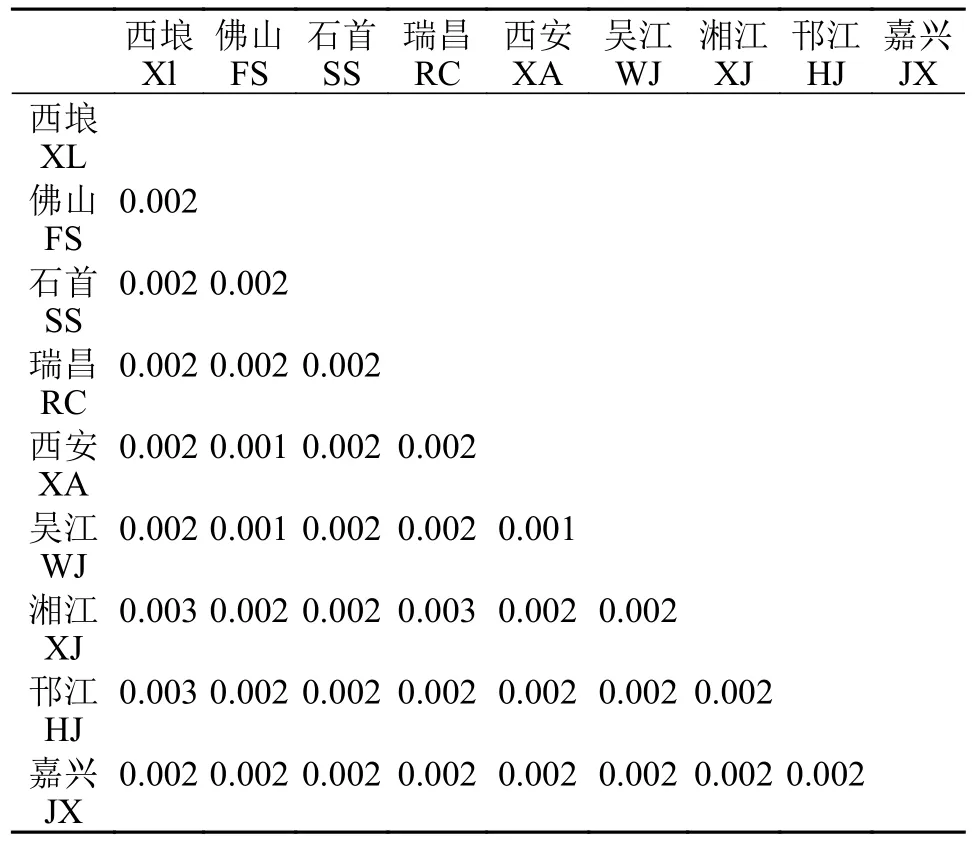
表3 基于COⅠ基因序列的青鱼群体间的遗传距离Tab.3 Genetic distance between populations of M.piceus based on COⅠ gene sequence
计算了COⅠ基因的群体间Fst指数,并且计算了群体间的基因流Nm(表4)。结果显示:9个群体间的Fst遗传分化系数1为-0.0033—0.23445,基因流Nm为0.51604—1.13224,9个青鱼群体间存在一定的遗传分化,也存在一定的基因交流[13]。

表4 青鱼9个群体间COⅠ遗传分化和基因流Tab.4 Pair wise Fst of COⅠ between 9 M.piceus populations
NJ进化树显示(图1),江苏邗江群体与湖南湘江群体聚成一个分支,再与浙江嘉兴群体聚成一支,广东佛山、陕西西安、江苏吴江聚为一支,广西西埌与江西瑞昌聚为一支,再与湖北石首聚为一支,两支姐妹分支聚集在一起,最终与浙江嘉兴,湖南湘江,江苏邗江群体聚在一起。
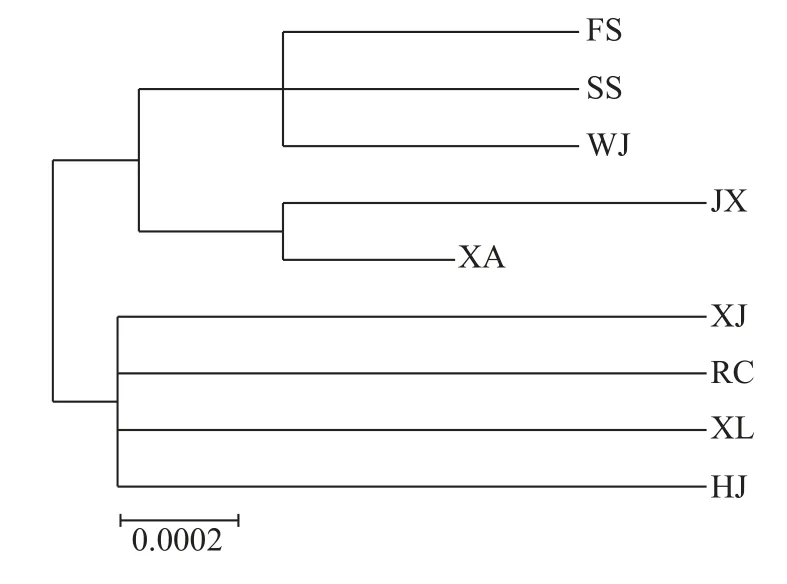
图1 基于COⅠ基因序列构建的青鱼9个群体NJ进化树Fig.1 NJ evolutionary trees of nine M.piceus populations of M.piceus based on COⅠ gene
在9个青鱼群体间COⅠ序列的分子变异(AMOVA)结果中(表5),青鱼群体间遗传变异占比为9.67%,群体内遗传变异占比为90.33%,9个青鱼群体的遗传变异主要来源于群体内。
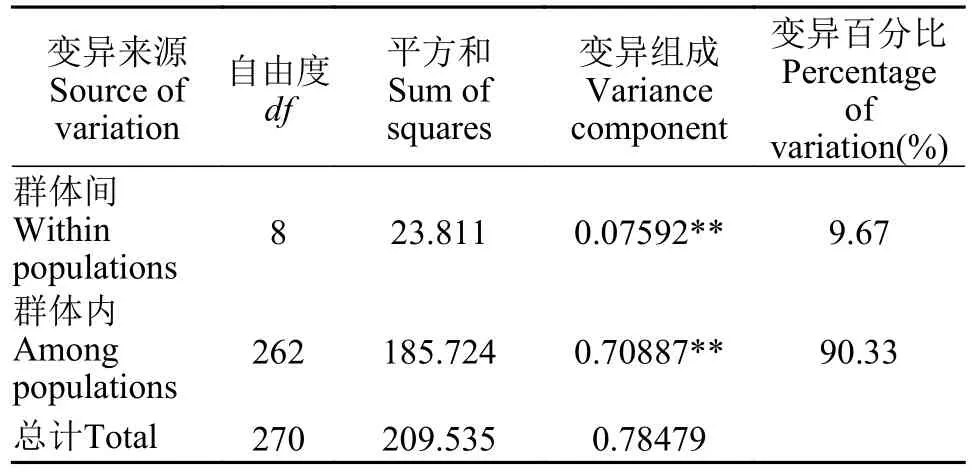
表5 青鱼群体间 COⅠ 基因的 AMOVA 分析Tab.5 AMOVA analysis of COⅠ gene in populations of M.piceus
2.4 单倍型分析
271尾青鱼COⅠ序列共检测到7个单倍型,编号为Hap1—Hap7,其中Hap4在9个群体中都有分布,其次是Hap1和Hap3在8个群体中有分布,Hap2在7个群体中有分布,Hap5在3个群体中有分布,Hap6、Hap7在两个群体中有分布,没有发现独享单倍型(表6)。图 2展示的是使用基于Median-joining法构建的单倍型网络图,网络的中间位置一般是古老的单倍型,其余单倍型可以通过单一突变和多步突变相连接,在古老单倍型周围呈现出星状分布[10],单倍型Hap4在9个群体中都有分布,并且处于单倍型网络的中央,因此可能是较为原始的单倍型,由单倍型网络图以及单倍型在各个群体中的分布可知,单倍型的地理分布与青鱼群体的地理位置分布没有明显的相关性。

表6 七种单倍型在青鱼9个群体中的分布Tab.6 7 Haplotypes distribution of COⅠ gene in 9 M.piceus populations

图2 九个群体青鱼COⅠ基因单倍型网络图Fig.2 The haplotype network of M.piceus based on COⅠ gene in 9 populations
3 讨论
对青鱼群体的遗传多样性进行研究是保护青鱼种质资源的前提条件,具有较高的遗传多样性的种群的生存概率越高。目前,COⅠ基因已经被广泛地应用到了水产动物的群体遗传研究中[14—16]。
3.1 青鱼的遗传多样性
对9个青鱼地理群体共271个个体线粒体COⅠ基因区段的遗传多样和单倍型进行了研究。青鱼群体的总体单倍型多样性较高,但是核苷酸多样性较低,与谢启明等[4]利用线粒体Cytb基因分析得出的结果相近。就遗传多样性而言,湘江群体高于瑞昌群体,与方耀林等[17]得到的结果一致。付晓燕等[3]通过对青鱼线粒体Cytb基因的分析,发现珠江水系广东云浮的遗传多样性比长江水系的青鱼遗传多样性要低。本研究中来自良种场的养殖群体广东佛山青鱼单倍型多样性和核苷酸多样性都比其他青鱼群体低,也说明了广东地区青鱼的遗传多样性可能偏低。来自良种场的养殖群体江苏吴江群体遗传多样性低于其他野生群体,与Zhou等[18]发现的结果相一致,此外,这也与王沈同等[19]分析结果一致。
与单倍型多样性相比,核苷酸多样性的累计时间要更长,在一定程度上更能反映群体的遗传多样性,本研究中除了广东佛山群体表现出低Hd低π型,其余群体均表现出高Hd低π型(Hd>0.05,π<0.005)型,根据Grand等[20]的理论,我们推测表现出广东佛山群体可能经历过瓶颈效应,而高Hd低π型的8个群体经历过快速的种群扩张事件。由于某些原因,在短时间内,8个种群的数量急剧增加,从而导致单倍型多样性的急剧增加,但是核苷酸的变异速度要慢得多,没有足够充足的时间来积累核苷酸变异,因此表现出高Hd低π型。
3.2 青鱼的群体遗传分化
群体间的遗传分化程度可以用遗传分化指数来表示[21],通常认为Fst<0.05为低度遗传分化;当0.05<Fst<0.15时为中度的遗传分化;当0.15<Fst<0.25时为高度的遗传分化,当Fst>0.25时遗传分化极大。在本研究中,9个群体间的Fst值在-0.0033—0.23445,群体间的遗传分化在低度至高度之间,主要存在于低度和中度分化水平。推测由于青鱼的洄游性,每年洄游至产卵场产卵的繁殖行为,使得各个群体之间产生了一定的基因交流,从而削弱了环境对群体分化的影响,使得野生群体之间分化不明显。
在通常情况下,基因交流的概率会随着地理距离的加大而减小,也更容易出现遗传分化。但是也有研究发现由于环境的作用,遗传距离与地理距离也会存在没有明显相关性。朱晓东等[22]发现鲢群体间的遗传距离与地理距离的远近没有明显的相关性,刘红艳等[23]研究发现黄颡鱼(Pelteobagrus fulvidraco)群体间遗传距离与地理距离也无明显相关性。王丰等[6]使用微卫星分析了青鱼的遗传结构,其结果显示,江苏吴江群体与江苏邗江、浙江嘉兴群体的遗传距离较近,但是其遗传距离反而较远,推测可能是由于太湖拥有大面积的湖泊环境,而其他4个群体不存在类似的水文条件。本研究发现广西西埌群体和江西瑞昌、浙江嘉兴群体地理距离较远,但遗传距离较近,广东佛山群体和江苏吴江群体也是如此。相反广西西埌群体和广东佛山群体的地理距离较近,遗传距离却较远。系统发育树同时也证实了这种情况,而在单倍型的统计中也发现,单倍型的分布与青鱼群体的地理位置分布没有明显的相关性,可能与其特殊的水域环境或来源有关。
本研究通过分析9个青鱼群体的遗传变异,发现9个群体的遗传多样性总体较低,遗传分化程度在低度至高度之间,主要表现在低度和中度分化,群体之间有着一定的基因交流,为青鱼种质资源的保护和开发提供了重要的理论依据。
