藻类连续培养体系的构建与优化及其在产毒和无毒微囊藻竞争中的应用
2022-08-04左俊曾佳颖杨丝雨宋立荣甘南琴
左俊 曾佳颖 杨丝雨 宋立荣 甘南琴
(1.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉 430072;2.中国科学院城市环境研究所城市环境与健康重点实验室,福建省流域生态重点实验室水生态健康组,厦门 361021;3.中国科学院大学,北京 100049)
藻类培养模式主要包括批次培养、半连续培养和连续培养。批次培养是指在一个封闭的反应器内加入一定数量的培养基后,接种藻种进行培养的一种培养方式,由于批次培养中底物的消耗和代谢废物的积累,藻类一般表现为S型生长曲线,具有明显的延迟期、对数生长期、稳定期和衰亡期[1]。半连续培养主要是在藻类培养过程中,当藻细胞达到一定浓度后,收获一定量的藻液,补充等量培养液继续培养[2]。半连续培养有利于藻细胞保持良好的生长状态[3],主要是为了能够重复地取得大量均一的培养藻细胞以供生化研究之用。连续培养是在藻类的整个培养期间,通过一定的方式使藻类能以恒定的比生长速率生长并能持续生长下去的一种培养方法。恒化培养是连续培养的一种类型,它是以恒定的流速使营养物质浓度恒定而保持培养物生长速率恒定的方法。这种培养方法常通过控制某种营养物的浓度,使其成为限制因子,而其他营养物均为过量。这样,培养物的生长速率将取决于限制性因子的浓度。随着培养物的生长,细胞密度会随时间的增长而增高,而限制因子的浓度又会随时间的增长而降低,两者相互作用的结果使得培养物的生长速率恰好与恒速加入的新鲜培养基流速相平衡。目前连续培养已经成为室内研究藻类生理特性的重要培养方式。
由于水体富营养化及全球气候变化,全球范围内水生态系统蓝藻水华暴发的频率、范围和强度呈现逐渐增加的趋势,这些水华蓝藻能够产生对人及水生动植物有害的次生代谢物,损害水生态系统的功能,降低水资源的利用,带来巨大的健康风险[4—7]。在蓝藻水华监测和预警方面,现阶段聚焦于外部环境参数如理化因子和气象条件上的变化,忽略了特定藻类在生理生态学层面上的动态响应方式,因此难以准确地预测预报[8]。微囊藻水华是我国最为严重的蓝藻水华之一[4,5],亟需通过生理生态学方法揭示其水华生消机制[8]。然而在自然水体中,产毒与无毒微囊藻存在竞争关系,但其驱动因素尚不明晰。目前有关产毒与无毒微囊藻竞争的研究主要集中在营养盐N、P的变化、光照强度和CO2等方面[9]。但这些研究多以批次培养为主,少有连续培养的报道。在批次培养中,由于营养物质的消耗和有害代谢产物的累积,微囊藻的生长容易受到阻碍。但在天然湖泊等水体中,N、P等营养物质被消耗之后,在生物地球化学循环作用下,短期内可以迅速恢复。因批次培养中的营养物与野外水体之间存在显著的差异,导致批次培养得到的实验结果用于解释野外水体中蓝藻水华发生的机理时存在局限性。而在连续培养模式下,微囊藻的生长不会受到营养盐的限制和有害代谢产物的影响,其生长速度、代谢活性都处于相对恒定的状态,此时微囊藻生长变化只受到实验单一或者复合因子的影响,而不会被其他因子干扰。因此,连续培养将成为研究产毒和无毒微囊藻竞争的主要培养手段[10,11]。
本研究通过微生物发酵罐,加装外置环形光源,构建藻类连续培养系统,并通过优化参数,获得最优培养条件,为室内开展藻类竞争试验提供合适的培养模式。在此基础上开展光强对产毒微囊藻与无毒微囊藻影响的试验,为探究产毒微囊藻与无毒微囊藻的竞争演替机制提供技术支撑。
1 材料与方法
1.1 藻株和培养条件
本实验所用的铜绿微囊藻(Microcystis aeruginosa)PCC 7806及其突变株PCC 7806mcyBmutant,由法国巴斯德蓝藻藻种库(Pasteur Culture collection of Cyanobacteria,PCC,France)提供。两株藻种都是无菌株,前者是野生型产毒株,后者是人工无毒突变株。藻种培养条件为:温度25℃,光强35 μmol/(m2·s)(冷光源),光暗比12h∶12h,M9培养基(改良自BG11[12])。M9培养基中除了NaNO3和NaHCO3外,其他成分同BG11。M9培养基配制时,不添加NaHCO3,灭菌后通过无菌滤器过滤除菌后,将NaHCO3加入灭菌后的培养基中。最后补加400 μL已用无菌滤器除菌的1 mol/L的HCl溶液,使得M9最终pH为8.5。
1.2 基本构造
实验室开展的连续培养在BioFlo/CelliGen 115发酵罐(Eppendorf,EP)和BLBIO-5GJL发酵罐(百伦,上海)中进行。发酵罐主要包括罐体、检测探头、控制台、循环水浴及样品处理组件等(图1)。EP罐体为3 L,百伦罐体为5 L,实验时培养液占比在0.6(v/v)左右。发酵罐在搅拌和通气作用下,使培养液不断混匀。发酵罐温度由温度探头实时测定,并经控制台调配罐底的加热装置和外部夹套的冷却循环水来达到平衡。罐体还有溶氧探头、pH探头和消泡探头。补料泵A和出料泵B都由发酵罐主机控制,以恒定的速率泵入或泵出培养物。通过设置补料泵A的工作效率,如一个周期为60s,工作10s,停50s,从而达到控制泵入体积的目的(泵入体积=恒速泵速率×工作时间×工作效率)。新鲜培养基进入培养系统后,培养罐体内的液面会上升,当液面上升接触到液位探头后,触发液位探头启动出料泵B,将培养液从发酵罐底部泵出培养体系。这样通过补料泵A的持续泵入和出料泵B的自动泵出,达到平衡,保持培养体积恒定。稀释率为每天泵入的新鲜培养基体积与培养体系总体积的比值。通过设置补料泵A的工作效率,调整泵入的体积,进而实现对稀释率的精确调控。当藻细胞比生长速率与连续培养稀释率相等时,培养系统进入稳定状态,此时细胞密度保持恒定。
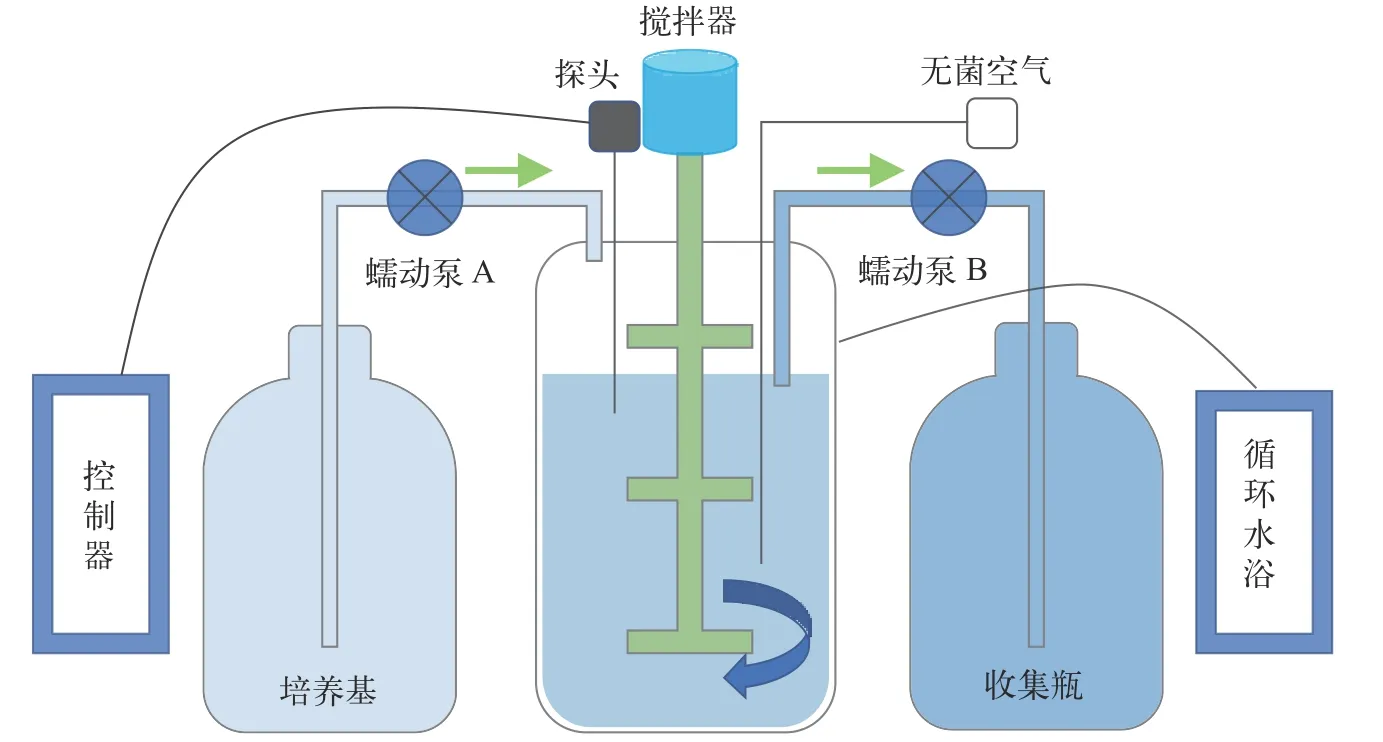
图1 发酵罐连续培养示意图Fig.1 Schematic diagram of continuous culture
1.3 培养条件和参数设置
连续培养温度设置为25℃,光照35 μmol/(m2·s),光暗比为12h∶12h,培养基为M9。EP发酵罐培养体积为1.8 L,百伦发酵罐培养体积为3 L。发酵罐的稀释率为0.075或0.15/d,通气量为0.4 L/min,搅拌速度为50 rpm。起始接种量为(2—4)×106cells/mL,首先进行4d的预培养,然后在第4天开始连续添加新鲜培养基。
1.4 实验设计
通过优化补加培养基的时间、接种密度和稀释率对连续培养条件进行优化。起始按1∶1的比例接种产毒藻株PCC 7806和无毒藻株PCC 7806mcyB-,在选定天数取样,测定细胞密度。连续培养条件优化共设计3个实验。实验一:起始接种密度为2×106cells/mL,稀释率为0.15/d时,设置了3个补加培养基的时间:分别在第4、第6和第7天开始通入新鲜培养基。实验二:起始接种密度为4×106cells/mL,稀释率为0.15/d时,设置了2个补加培养基的时间:分别在第0和第4天开始通入新鲜培养基。实验三:起始接种密度为4×106cells/mL,在第4天开始连续,设置2个稀释率分别是0.075/d和0.15/d。
随后开展了长周期和短周期培养过程中PCC 7806与PCC 7806mcyB-mutant竞争实验。长周期实验培养70d,短周期实验培养22d。通过测定细胞数变化和无毒株比例变化,评价优化后短周期培养下的实验结果。通过条件优化和竞争实验结果分析最适培养体系。
在优化出最适培养体系后,我们还探索了不同光强在连续培养条件下对产毒藻和无毒微囊藻竞争的影响。实验一共设置了4组光强,分别为5、15、35和80 μmol/(m2·s)。实验周期为16d,每隔2天取样,样品备测。
1.5 细胞计数
每份初始藻液取1 mL加入10 μL鲁哥试剂进行固定,设置3个平行。固定的样品经振荡混匀后,吸取10 μL加到血球计数板(上海求精)计数室,在普通光学显微镜(Eclipase E200,Nikon,Japan)下计数。每个样品计数3次,每次均记录上下2个计数室计数结果,样品中藻细胞浓度由6次记录的数据平均值计算得到。初始藻样中细胞密度通过3个样品平行计算平均值得到。
1.6 DNA提取
藻样过0.2 μm的碳酸径刻蚀膜(Nuclepore Track-Etch Membrane,Whatman,GE,USA),收集细胞,并立即存放在-20℃冰箱,用于后续DNA提取。用MP FastDNA SpinDown Kit(MP Biomedicals,LLC,France)提取基因组DNA,操作流程参照试剂盒说明书。DNA的浓度和纯度使用超微分光光度计(NanoDrop 8000,Thermo Fischer Inc.,USA)进行测定。
1.7 标曲制备
以PCC 7806mcyB-mutant的基因组DNA作为定量产毒微囊藻和总微囊藻的标准。通过已知的DNA数量(以细胞数目来表示)与qPCR得到的Ct值(达到的阈值所需要的循环数)进行线性回归,得到回归曲线(标曲)[13]。将10 mL细胞密度为3.4×107cells/mL的PCC 7806mcyB-mutant抽滤到0.2 μm的碳酸径刻蚀膜上,随后提取基因组DNA。将提取的DNA进行10倍的梯度稀释,得到7个(含原液)不同梯度的DNA样品,细胞密度分别为3.4×106到3.4 cell/μL。qPCR生成的数据由iQ5(version 3.0,Bio-Rad,Hercules,CA)软件通过最大相关系数方法计算得到Ct值,即软件自动选取阈值,使得标准曲线的相关系数(R2)最大。
1.8 双通道qPCR测定
Dittmann等在产毒铜绿微囊藻PCC 7806的mcyB基因中插入氯霉素抗性基因(Chloramphenicol resistance cassette,Cm),获得了无毒的PCC 7806mcyB-突变体[14]。在双通道荧光定量qPCR测定中,通过PC(PC-IGS,藻蓝蛋白基因 PC中两个蛋白亚基之间的基因间隔区域)和Cm分别定量竞争体系中总微囊藻和无毒微囊藻的数量,得到无毒微囊藻的比例。其中定量PC的探针序列是CY-5-5′-CCGCTG CTGTCGCCTAGTCCCTG-3′BHQ-2,正向引物序列是PC188F:5′-GCTACTTCGACCGCGCC-3′,反向引物序列是PC254R:5′-TCCTACGGTTTAAT TGAGACTAGCC-3′[15]。而定量Cm的探针序列为FAM-5′-ACCGTGTGCTTCTCAAATGCCTGAG GC-3′-TAMRA,正向引物序列为5′-GTTTATTGA CTACCGGAAGCAGTG-3′,反向引物序列为5′-CACGGGGAGAGCCTGAGC-3′[16]。
PCR反应在伯乐荧光定量PCR仪(Bio-Rad,Hercules,CA)上进行,该仪器配备有iQ5实时荧光检测系统和处理软件,能够支持多通道荧光检测。PCR反应总体系是20 μL,在96孔板(Bio-Rad)中进行。总体系包括10 μL 2×iTaq Universal Probes Supermix(Bio-Rad)预混液,1 μL BSA(牛血清蛋白,3 mg/mL),2 μL DNA样品,0.4 μLPC的正反向引物和0.2 μLCm的正反向引物,最后补充无菌水至20 μL。PCR程序先在95℃预变性5min,随后进行40个循环:95℃,15s;62℃下退火1min;72℃,30s。每个PCR样品均设置3个平行,并添加不含DNA的无菌去离子水作为阴性对照。
1.9 数据分析
所有数据使用PASW Statistics 18.0(SPSS Inc,USA)进行统计分析,图片使用Origin 2019b(Origin-Lab,USA)绘制。
2 结果
2.1 微囊藻连续培养条件的构建与优化
培养基补料时间的优化起始接种密度为2×106cells/mL,稀释率为0.15/d时(如图 2A),在细胞接种后,经过短时间的适应后,细胞数快速增加。不同处理下连续培养系统进入稳定期的细胞密度无显著差异,但进入稳定期的时间有显著差异。第4天开始补加培养基最先达到稳定,在第14天进入稳定期;第6天补料组在第16天进入稳定期,而第7天补料组在第18天才进入稳定期。这表明培养基补加时间越晚,连续培养系统进入稳定期的时间就越慢。

图2 连续培养中不同补料时间处理下微囊藻细胞的生长曲线Fig.2 Growth curves of Microcystis when supplemented with medium on different days under continuous culture
起始接种密度为4×106cells/mL,稀释率为0.15/d时(图2B),第0天开始补加培养基的实验组,在第14天进入稳定期,且细胞密度为3×107cells/mL;而第4天补料组在第10天就达到稳定,稳定期的细胞密度在4.3×107cells/mL。这表明,接种时就开始补加培养基,会推迟连续培养进入稳定期的时间,而且稳定期细胞密度比较低。比较培养基不同补加时间的结果表明,第4天开始补充新鲜培养基到连续培养系统较为合适。
藻种起始接种密度的优化第4天开始补加培养基,稀释率为0.15/d时(图3A),起始接种密度为4×106cells/mL的处理组在第12天进入稳定期,而起始接种密度为2×106cells/mL的处理组在第16天才达到平衡。不同接种密度的处理组进入稳定期后的细胞密度无显著差异。

图3 连续培养中不同接种密度处理下微囊藻细胞的生长曲线Fig.3 Growth curves of Microcystis with different inoculum densities under continuous culture
第6天开始补加培养基,稀释率为0.15/d时(图3B),起始接种密度为1×106cells/mL的处理组在第20天进入稳定期,而起始接种密度为2×106cells/mL的处理组在第16天进入稳定期。两个处理组在稳定期的细胞密度无显著差异。不同起始接种密度结果表明,较低的接种密度会推迟连续培养进入稳定期的时间,但过高的接种密度需要大量藻种。综合来看,起始接种密度为4×106cells/mL时比较合适。
稀释率的优化起始接种密度为4×106cells/mL,培养基在第4天补加时(图4),稀释率为0.075/d时,细胞生长缓慢,连续培养在20d后逐渐进入稳定期,细胞密度仅2.2×106cells/mL,而稀释率为0.15/d时,细胞生长较快,在第10天就进入稳定期,稳定期细胞密度在4.3×106cells/mL。在连续培养达到稳定时,细胞比生长速率等于稀释率。当稀释率较低时,细胞生长较慢,在达到稳定时,细胞密度也较低。当稀释率过高时,细胞比生长速率低于稀释率,会导致系统无法进入稳定期。

图4 连续培养中不同稀释率处理下微囊藻细胞的生长曲线Fig.4 Growth curves of Microcystis with different dilution rates under continuous culture
2.2 连续培养条件下产毒与无毒微囊藻混合培养条件的优化
混合培养中产毒与无毒微囊的定量测定产毒株PCC 7806与无毒株PCC 7806mcyB-在混合培养过程中的比例通过双通道探针法qPCR来测定。如图 5所示,在双通道竞争PCR中,PC和Cm基因与细胞数之间均具有极显著的相关性,两者的回归曲线分别为:y=-3.336 lg(x)+40.425(R2=0.999,n=3,P<0.001)和y=-3.537 lg(x)+40.165(R2=0.997,n=3,P<0.001)。式中x表示样品中 DNA 的量(以细胞数的对数值表示),y表示样品的Ct值。两者的扩增效率E分别为99.4%和91.8%。在所有的样品测定过程中,PC和Cm基因的扩增效率在91%—102%,扩增曲线的相关系数R2均大于0.995,表明双通道探针法qPCR可以用来定量和区分产毒株PCC 7806和无毒株PCC 7806mcyB-。
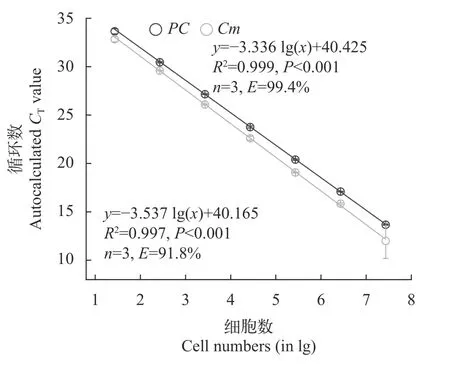
图5 双通道qPCR中无毒株PCC 7806 mcyB- PC和Cm基因扩增的标准曲线Fig.5 Standard curves for PC and Cm genes based on predetermined concentrations of DNA (given as log10 cell number equivalents)of the non-toxic Microcystis strain PCC 7806 mcyB-,amplified by multiplex real-time PCR
产毒株与无毒株在长周期培养下的竞争状况长周期培养在第6天开始持续、恒定补充新鲜M9培养基到发酵罐中。初始接种密度为1.0×106cells/mL。在接种后,总细胞数快速增加,在20d左右达到最大值,其后近40d培养中,细胞数目一直维持在4.5×107cells/mL左右,没有显著变化(图6)。产毒株比例在接种后逐渐降低,最后稳定在15%左右,而无毒株比例则逐渐上升,最后稳定在85%左右。细胞比例变化在20d左右达到平衡,随后一直保持不变。这说明在连续培养系统达到稳定后,细胞密度在较长时间内维持不变,而且产毒株与无毒株以不同优势共存,两者比例也长时间保持不变。
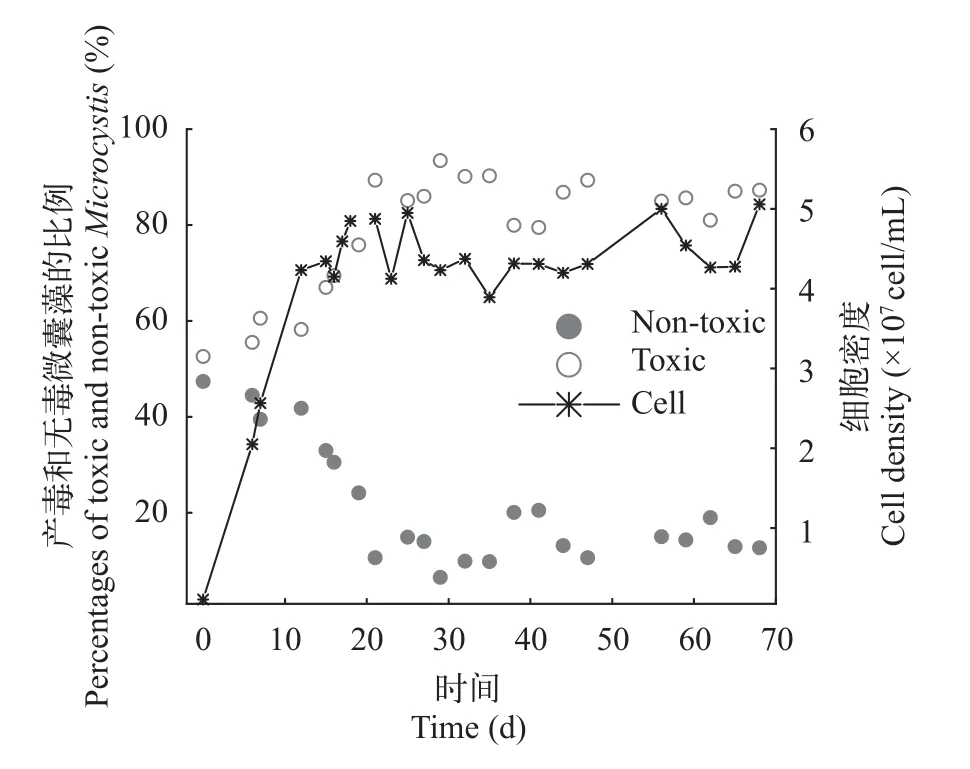
图6 长周期的连续培养条件下产毒微囊藻(PCC 7806)与无毒微囊藻(PCC 7806 mcyB-)中细胞比例变化和总细胞数变化Fig.6 Percentages of the toxic Microcystis (PCC 7806) and nontoxic Microcystis (PCC 7806 mcyB-) and total cell density in competition under continuous culture for a long time
产毒株与无毒株在短期培养下的竞争状况当初始接种密度为1.0×106cells/mL时,连续培养系统在20d左右才达到平衡。为了缩短实验周期,在优化后的培养条件下进行竞争实验。接种密度为4.0×106cells/mL,并在第4天开始补充培养基。如图 7所示,在改变初始接种量后,竞争体系在第10天左右就达到了稳定,此后细胞比例和细胞数都没有显著变化。在达到稳定后,产毒株比例维持在20%左右,无毒株比例维持在80%,这与长周期培养下的结果一致。这说明连续培养达到稳定后,产毒与无毒株竞争格局不再随时间发生变化。

图7 短周期连续培养条件下产毒微囊藻(PCC 7806)与无毒微囊藻(PCC 7806 mcyB-)竞争中细胞比例变化和总细胞数变化Fig.7 Percentages of the toxic Microcystis (PCC 7806) and nontoxic Microcystis (PCC 7806 mcyB-) and total cell density in competition under continuous culture for a short time
产毒株与无毒株竞争过程中溶解氧和pH变化如图 8所示,在光照周期为12h∶12h作用下,溶氧(DO)呈现明显的周期变化,白天(照光时)升高,晚上(黑暗时)降低,开始补充培养基之前,DO呈现逐渐升高的趋势,在第5天开始补充新鲜培养基后,DO开始下降,随后趋于稳定,从10天左右开始,其波动范围不再显著改变。pH变化在光合作用影响下,也呈现出周期性波动,变化趋势和DO一致,即pH先升高,在第5天通入新鲜培养基后开始下降,随后趋于稳定,从第10天左右开始pH变化维持在9.3—9.5,不再显著改变。DO和pH变化表明,连续培养系统进入稳定期后,二者随光周期变化保持周期性变动,其变化范围保持不变。

图8 连续培养条件下产毒微囊藻(PCC 7806)与无毒微囊藻(PCC 7806 mcyB-)竞争中pH(A)和溶氧(B)变化Fig.8 Variations on pH (A) and DO (B) in competition between toxic Microcystis PCC 7806 and non-toxic Microcystis PCC 7806 mcyB- under continuous culture
综合长周期和短周期培养实验结果及胡丽丽[17]的实验数据,我们将连续培养的初始接种量设定为(3.0—4.0)×106cells/mL,稀释率为0.15/d。新鲜培养基在第4天加入,此时连续培养在10d左右就可以达到平衡。当竞争体系达到稳定后,细胞比例不再变化,因此,在后期开展的实验中,将实验周期设定为14—16d。
2.3 光照对产毒与无毒微囊藻竞争态势的影响
在建立连续培养体系后,我们探究了不同光强对产毒和无毒微囊藻竞争的影响(图9)。在35 μmol/(m2·s)的光照(对照组)下,无毒株比例逐渐增加,随后稳定在80%左右,而产毒株比例则下降至20%左右。在高光下[80 μmol/(m2·s)],仍然是无毒株占据80%左右比例。在低光[15 μmol/(m2·s)]和弱光[5 μmol/(m2·s)]下,无毒株和产毒株都维持在初始比例,没有发生显著改变,但在弱光下,无毒株比例有下降的趋势。综合来看,光充足时,无毒株占绝对优势,而光限制时,无毒株和产毒株无明显差异。虽然在不同光强处理下,无毒株比例变化有明显差异,但是在所有处理组中,无毒株和产毒株仍旧以不同优势共存,没有出现消亡现象。
3 讨论
藻类生理生态学研究对于揭示蓝藻水华暴发、维持及衰亡机制具有重要意义。传统的批量培养模式往往会受到营养盐消耗和有害代谢物质积累等的影响,而连续培养更接近于野外水体营养的变动,减少其他非控制因素对蓝藻细胞生长产生的影响。本研究利用发酵罐构建了一套藻类连续培养系统。以产毒微囊藻PCC 7806及其无毒突变株PCC 7806mcyB-为培养材料,对连续培养的各项参数进行了优化。在藻种接种到培养基后,需要短暂的适应过程,因此起始补料时间会影响培养系统进入稳定期的时间。过短,如第0天,或者过长,如第7天,都会延迟系统进入稳定期的时间(图2),而第4天开始进行补料比较合适,此时培养系统能够较快进入稳定期。起始接种密度优化结果表明,提高接种密度,可以加快培养系统进入的时间(图3),但过高的接种密度需要消耗大量的藻种,结合本研究结果,4×106cells/mL的起始接种密度较为合适。在系统进入稳定期后,藻细胞的比生长速率与稀释率相等,所以稀释率不仅影响系统进入稳定期的时间,还决定了稳定期的细胞密度。稀释率较低时,系统进入稳定期较慢,且稳定期时细胞密度也比较低;而提高稀释率时,系统可以较快进入稳定期(图4)。藻类在一定稀释率范围内进行连续培养时,生物量(稳定期时的细胞密度)会随着稀释率的增加而增加,而当稀释率超过临界值之后,藻细胞未能充分生长便被带出培养系统,生物量反而会随着稀释率的增加而下降。大量研究表明,藻类连续培养时都存在一个最佳稀释率,例如杜氏盐藻(Dunaliella salina)和三角褐指藻(Phaeodactylum tricornutum)的最佳稀释率为0.15/d,而栅藻为0.31/d,藻细胞在最佳稀释率下培养时,系统达到稳定后的生物量明显高于其他稀释率下的生物量[18—21](图4)。综合补料时间、起始接种密度和稀释率,我们得到了连续培养的最适培养条件:第4天开始补料,起始接种密度为4×106cells/mL,稀释率为0.15/d。
建立连续培养系统并优化后,我们探究了产毒与无毒微囊藻在连续培养下的竞争格局。但产毒微囊藻与无毒微囊藻混合培养后,传统方法无法将其区分。而qPCR定量方法,可以针对特异性序列对靶基因进行定量。因此,我们采用了双通道探针法qPCR来测定无毒微囊藻和总微囊藻。该方法通过特异性探针来监测PCR反应进程,与传统染料法相比,大大提高了特异性,而且缩短了时间和人力成本,仅需一次测定就可以得到无毒株和产毒株的比例;而且已经被证明可以精确定量室内培养和野外样品中产毒微囊藻的比例[9]。本研究中PC和Cm基因的扩增曲线显示双通道探针法qPCR可以精确定量产毒和无毒微囊藻(图5)。随着分子生物学技术的发展,探针合成成本逐渐降低,荧光定量PCR仪也将更加普及,未来双通道qPCR定量检测产毒蓝藻将成为主流。
测试了qPCR定量产毒和无毒微囊藻效果后,我们开展了产毒微囊藻PCC 7806及其无毒突变株PCC 7806mcyB-的竞争实验。在长周期(70d培养)的培养中,系统达到稳定后,产毒株与无毒株的比例不再发生变化,并且可以长时间维持稳定(图6)。为了缩短连续培养周期,我们在优化后的培养条件下,开展了短周期的竞争实验,此时连续培养在10d左右就进入了稳定期,而且稳定期时产毒株和无毒株比例与长周期一致(图6—7),这表明优化后的实验竞争体系可以表征产毒与无毒微囊藻的竞争格局。后续竞争实验在此条件下,只需要进行14—16d即可。
利用优化的连续培养系统,我们开展了不同光强对产毒与无毒微囊藻竞争影响的实验。在35和80 μmol/(m2·s)光强下,无毒株占据优势;而在15和5 μmol/(m2·s)光强下,无毒株和产毒株没有优势差异(图9)。Kardinaal等[22]发现在25 μmol/(m2·s)光强下,无毒株占据优势,甚至能够替换产毒株,但Van de Waal等[10]则发现在25 μmol/(m2·s)光强下,产毒株占据明显优势。由于Kardinaal等[22]的研究和本研究中用到的藻株都出现在Van de Waal等[10]的研究中,因此产毒株和无毒株在不同光强下竞争的差异,不能简单归因于藻株差异。PCC 7806mcyB-突变株是在mcyB片断插入氯霉素抗性基因[14],从而使得mcyB基因失活,不能合成微囊藻毒素,其他的遗传基因保持不变。Hesse等[23]分析PCC 7806及其突变株PCC 7806mcyB-的差异,发现不同光照强度下两株藻生长的生长并没有显著性差异,只是突变株相对野生型PCC 7806而言,其色素的含量有所下降。虽然微囊藻毒素合成被认为是耗能过程,但是这部分耗能可能相对比较低[24],而且PCC 7806mcyB-突变株虽然不能合成毒素,但是mcyABC等基因的转录过程不受影响[25],这部分活动也需要能量。因此,产毒株因为合成MCs耗能而在各种限制条件下相对于无毒株占据优势的假说也无法解答光限制下的差异。通过更多藻株进行实验可能有助于解答产毒株与无毒株在竞争中的差异。

图9 在连续培养条件下不同光强处理中产毒微囊藻(PCC 7806)与无毒微囊藻(PCC 7806 mcyB-)细胞比例的变化Fig.9 Percentages of the toxic Microcystis (PCC 7806) and non-toxic Microcystis (PCC 7806 mcyB-) in competition under continuous culture when treated with different lights
综上所述,在不同因素作用下,产毒与无毒微囊藻竞争的结果往往存在巨大差异,这可能和藻株差异有关,而其实质是微囊藻属基因组具有很强的柔性和可塑性。比较基因组学研究表明铜绿微囊藻拥有一个巨大的,开放的泛基因组,核心基因组约占到每个基因组大小的(48.4±4.6)%[26]。不同微囊藻藻株基因组在基因组成、数目与排列等方面都有较大差异,每株微囊藻均包含有数百至上千个藻株特有基因,而各藻株的核心基因数目只有2100个左右,少于各藻株基因总数目的1/2,这些结果可能解释微囊藻不同藻株间的表型多样性[27]。基于此,开展室内产毒与无毒微囊藻竞争实验时,选取多株藻株进行实验,可能得到更科学的结果。
4 结论
本研究利用发酵罐构建了藻类连续培养系统。通过对补料时间、起始接种密度和稀释率的优化,得到了最优培养条件。在光照为35 μmol/(m2·s)的连续培养条件下产毒微囊藻PCC 7806及其无毒突变株PCC 7806mcyB-以1∶1接种后会达到平衡,但两者以不同的优势度(即无毒株占据优势)长期稳定共存,而且通过优化后的培养体系,可以表征产毒与无毒微囊藻的竞争格局。在优化的连续培养条件下,当光充足时[35和80 μmol/(m2·s)],无毒株在连续培养中占据优势;而光限制时[15和5 μmol/(m2·s)],无毒株和产毒株维持初始接种比例不变。
