基于人工培养的浮萍快速无性繁殖营养条件研究
2022-08-04高晓钰曹特倪乐意张霄林丑庆川
高晓钰 曹特 倪乐意 张霄林 丑庆川
(1.中国科学院水生生物研究所淡水生态和生物技术国家重点实验室,武汉 430072;2.中国科学院大学,北京 100049)
近年来,随着全球能源物质和高蛋白动物饲料短缺,传统的农作物如小麦、玉米等带来碳水化合物的同时也增加了对粮食耕地的竞争[1],科研人员正在寻求一种替代、可再生、更持续的能源物质和优质饲料[1,2]。因此,探索新型非食品原料以促进可持续生物能源生产及饲料开发成为一种新的趋势[3—5,6]。研究发现,浮萍科(Lemnaceae)植物具有快速吸收水体氮磷、可耐受多种不同污染物[7,8]等优势,并含有丰富的淀粉和蛋白质,且年生物质产量远高于玉米、小麦和大麦等大多数淀粉作物[4,9]。因此,利用浮萍的快速生长特性吸收富营养水体中的营养物质,并将其转化为有价值的植物生物质能源[10],必将是今后浮萍资源化开发利用的主要发展方向。
浮萍科植物(Lemnaceae),通常简称浮萍,是世界上最小的水生被子植物[11,12],在全球各地均有分布,它们大多漂浮生长在水流相对平缓的湖泊、河湾和池塘等水面上。浮萍亚科共有青萍(Lemna)、紫萍(Spirodela)、少根紫萍(Landoltia)、无根萍(Wolffia)和扁无根萍(Woffiella)5个属,共37种[13,14]。各个属之间大体上可以通过根的数目和叶的形状进行区分。浮萍科主要的繁殖方式是无性繁殖,即母体通过发芽产生子叶状体[5,15],在氮磷等营养物质充足的前提下,浮萍近乎以指数级繁殖速率增长,但倍增时间因品种和生长环境而异[5],且随着种群密度的增大繁殖速率逐渐降低。浮萍通过吸收其生长环境中的氮磷等营养物质实现无性繁殖,目前国内外关于浮萍生长规律的研究中,因培养基种类和氮磷的存在形式及比例不同,导致浮萍的生长存在差异[16],而优化浮萍人工培养技术以实现短期内收获最大生物量,进而用于污染水体修复和生物质能源资源化利用等十分重要。基于此,本研究选取了水生植物培养常用的Hoagland和Hunter两种培养基,于室内进行浮萍无性繁殖人工培养,以期选择出最适合浮萍生长繁殖的培养条件,从而为浮萍可持续再生的资源化利用提供参考。
1 材料与方法
1.1 种质资源采集
本研究所用S.polyrrhiza和L.minor于2019年5月采自武汉东湖(N 30°32′,E 114°21′)。主要通过叶的形状、颜色和根的数目进行区分,L.minor叶片正反面皆为绿色、叶膜质和单根,而S.polyrrhiza叶片正面紫色、反面绿色、叶革质和多根(图1)。采集后用流动自来水冲洗掉浮萍上的碎屑和小型无脊椎动物等残留物[17]。随后将浮萍置于实验室可接受自然光照射的水箱中生长1周,待其适应后开始人工培养。
1.2 实验设计
本研究通过配制人工培养液来模拟富含无机氮磷的水体,探究S.polyrrhiza和L.minor在不同浓度培养液中种群生物量和叶状体数的生长变化,初步确定浮萍生长的最适培养条件。
根据已有的研究[18—20],本研究选用Hoagland(表1)和Hunter(表2)两种培养基[19,20],分别设置原液、稀释5倍和稀释10倍3个浓度梯度,每个浓度设置3个重复。选取长势良好、生长健壮的S.polyrrhiza和L.minor各5株放入培养皿(直径9 cm,高1.5 cm)内,液面高度为培养皿高度的2/3。由于培养液会自然蒸发,故每天补充蒸馏水到培养皿高度的2/3,每隔2天更换新鲜培养液,从而保证培养液中各个组分浓度稳定和防止藻类、菌类滋生。每次更换培养液的同时将浮萍在滤纸上静置5min吸干表面水分,称量鲜重并逐个测定叶状体数[21]。人工培养所用培养箱为智能型人工气候箱(MGC-350HP型),光照设定为二级,光照强度为8000—10000 lx[22],昼夜温度分别为(25±1)℃和(17±1)℃,光暗时间比16h∶8h[19]。由于S.polyrrhiza叶状体在13d以后出现肉眼可见的黄化,有的个体甚至死亡,故停止浮萍的培养,培养期为13d。
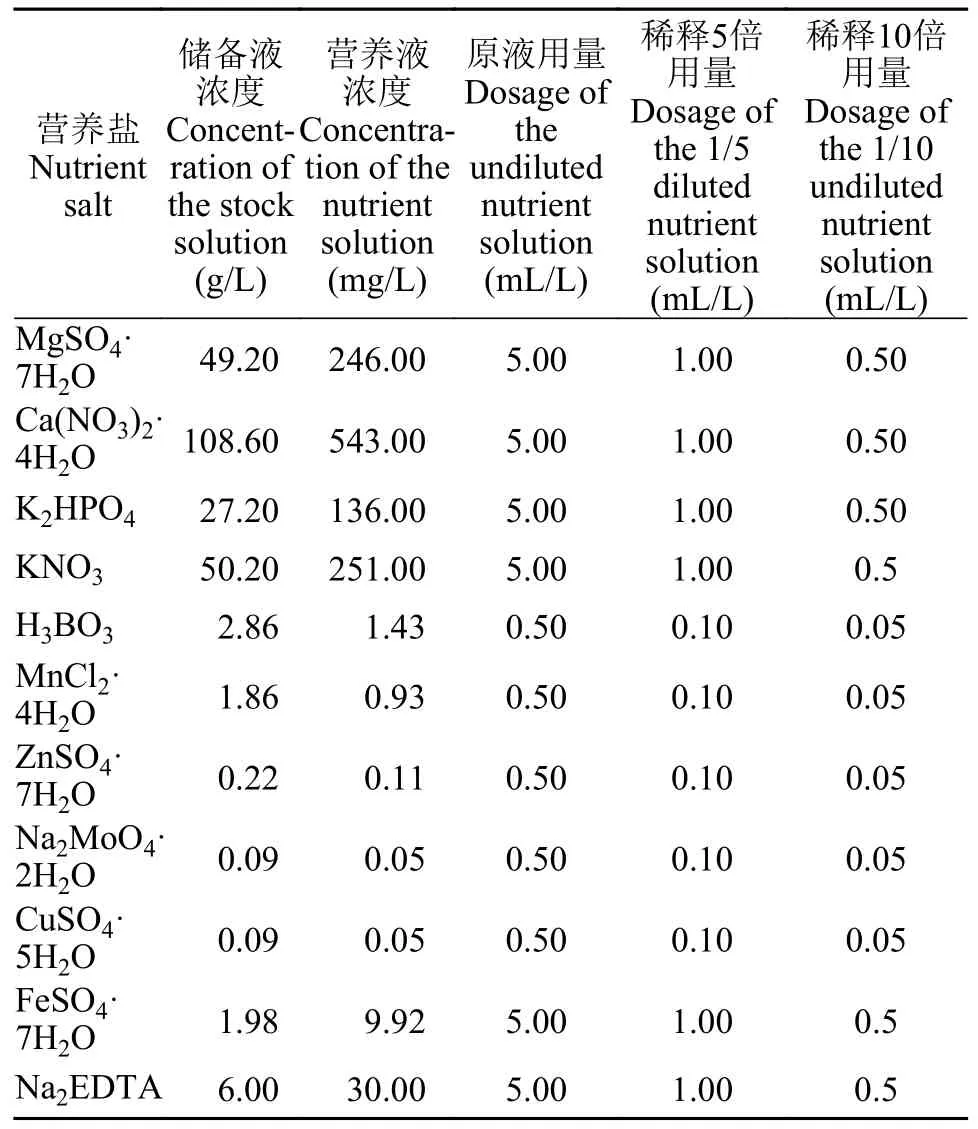
表1 Hoagland培养基及稀释后的浓度配方Tab.1 The formula of Hoagland medium and diluted concentrations
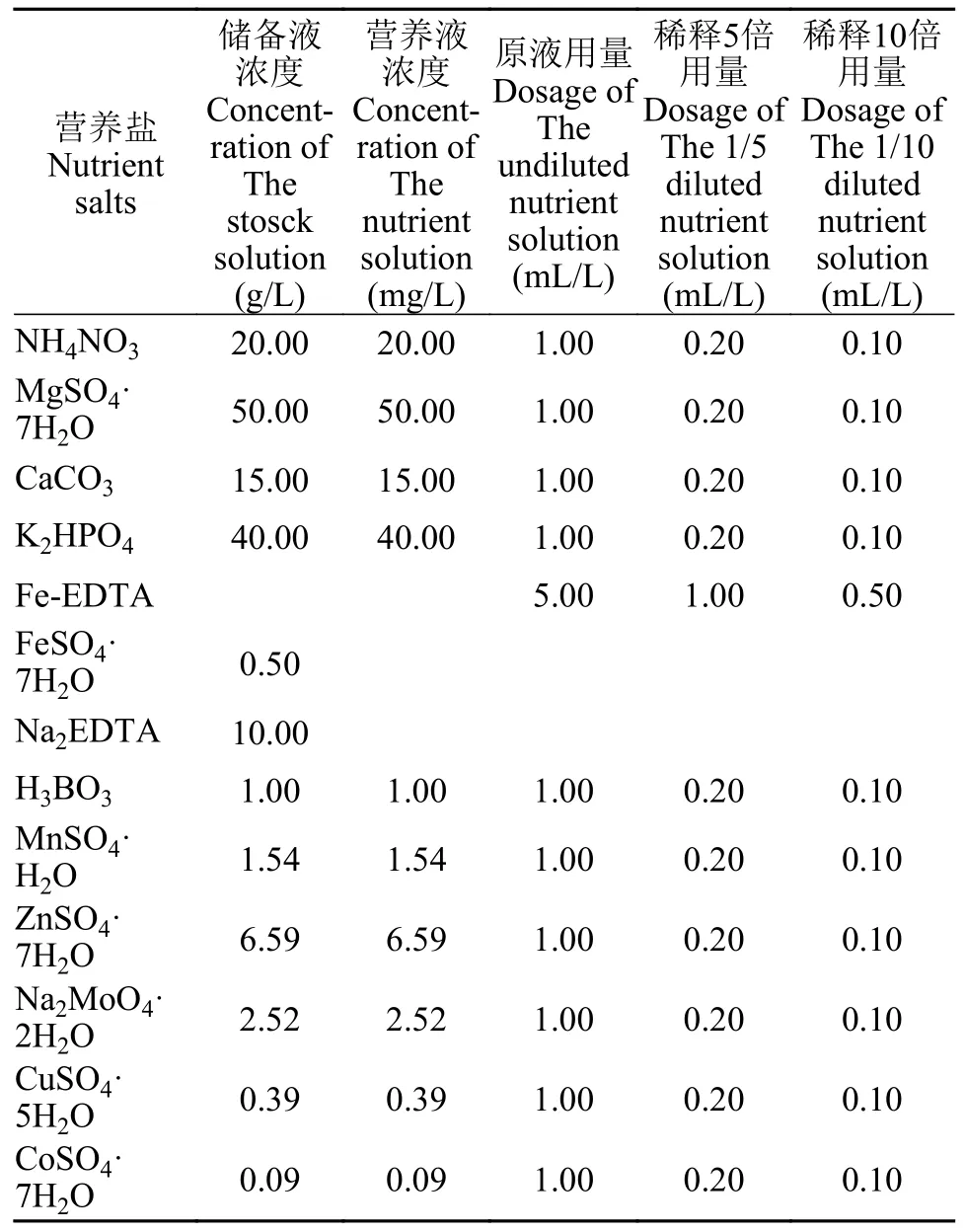
表2 Hunter培养基及稀释后的浓度配方Tab.2 The formula of Hunter medium and diluted concentrations
1.3 生长指标的测定
鲜重(Fresh Weight,FW)在培养期内,每隔2d测定浮萍的鲜重。利用漏斗网从培养皿内捞取聚集在一起的浮萍,滤去水分(无水滴出现),将待测浮萍平铺放置在事先铺好的吸水滤纸上,静置5min吸干表面吸附的水分,用电子天平(METTLER TOLEDO,精度为0.0001 g)对培养皿内的浮萍进行称重记录,鲜重测量完成后立即将浮萍放入更换好的新培养液中继续生长[19,21]。
叶状体(Frond)浮萍叶片组织结构高度退化,其叶通常被称为“叶状体”(Frond),是一些具有最小分化组织的集合体。成熟的株体从叶状体边缘分生新芽孢,母体脱离后形成新的叶状体分株,数代相连。每隔2d更换新鲜培养液的同时,将待测的浮萍放在电子显微镜下方,进行逐株叶状体计数。
种群生长参数根据公式(1)和(2)分别计算浮萍种群鲜重、叶状体数的相对增长率(RGR)和倍增时间T[23,24]。
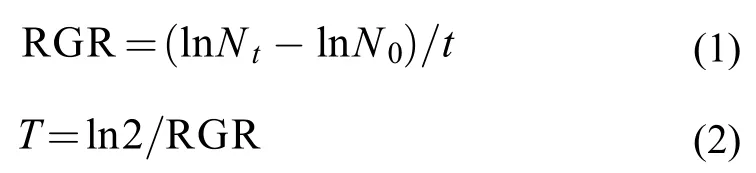
1.4 数据分析
首先,通过绘制浮萍培养期内鲜重、叶状体数变化趋势图,以观察出不同浮萍品种和培养条件下的生长差异;再利用公式(1)和(2)进行种群生长指标(鲜重和叶状体)RGR和倍增时间的计算,从而比较出两种浮萍在不同培养水平下无性繁殖的具体差异;其次,采用双因素方差分析探究S.polyrrhiza和L.minor在不同培养液中生物量和叶状体数变化是否具有显著性差异(P<0.01),并运用多重比较(LSD)探究两类培养基的不同浓度水平间是否具有显著性差异(P<0.05)。最后,计算浮萍的鲜重叶状体生长比,比较浮萍在不同培养基营养水平下的繁殖策略。所有统计分析和图表绘制均使用IBM SPSS 22和Origin 2017软件进行。
2 结果
2.1 浮萍种群鲜重变化趋势
S.polyrrhiza和L.minor在Hoagland和Hunter培养基中培养13d后,鲜重的变化趋势存在显著差异(图2)。S.polyrrhiza的鲜重在Hunter培养基各浓度下的增长率高于Hoagland培养基(图2a)。S.polyrrhiza种群鲜重在Hoagland原液、1/5 Hoagland和1/10 Hoagland培养液中起始阶段均呈增长趋势,所达最高增长率分别为14.8%、33.8%和75.5%,培养到8d后鲜重均逐渐下降,种群个体在表观上呈现黄化,继而死亡;而在Hunter 培养液各水平中,S.polyrrhiza鲜重在整个培养期内始终呈增长趋势,Hunter原液、1/5 Hunter和1/10 Hunter培养液的增长率分别达到318.1%、272.1%和171.2%。
S.polyrrhiza在Hunter培养水平下的鲜重RGR值高于Hoagland各培养水平(表3),即在Hoagland原液、1/5 Hoagland和1/10 Hoagland培养液中S.polyrrhiza鲜重的相对增长率RGR分别为-0.01、0.02和0.03,而在Hunter原液、1/5 Hunter和1/10 Hunter培养液中RGR为0.08、0.10和0.11,而在相同的培养时间内,RGR越大,种群增长越快,RGR为负值表明植株已受毒害并逐渐死亡,说明S.polyrrhiza在Hoagland原液中种群逐渐死亡,而在Hunter培养液中种群鲜重增长较快。从种群增长倍数和倍增时间可看出,S.polyrrhiza在1/5 Hoagland培养液中,最好的生长表现为20d内倍增数为1.60,而Hunter培养液中6d倍增数即达到4.20。因此,Hunter培养液较Hoagland培养液更有利于S.polyrrhiza的生长。
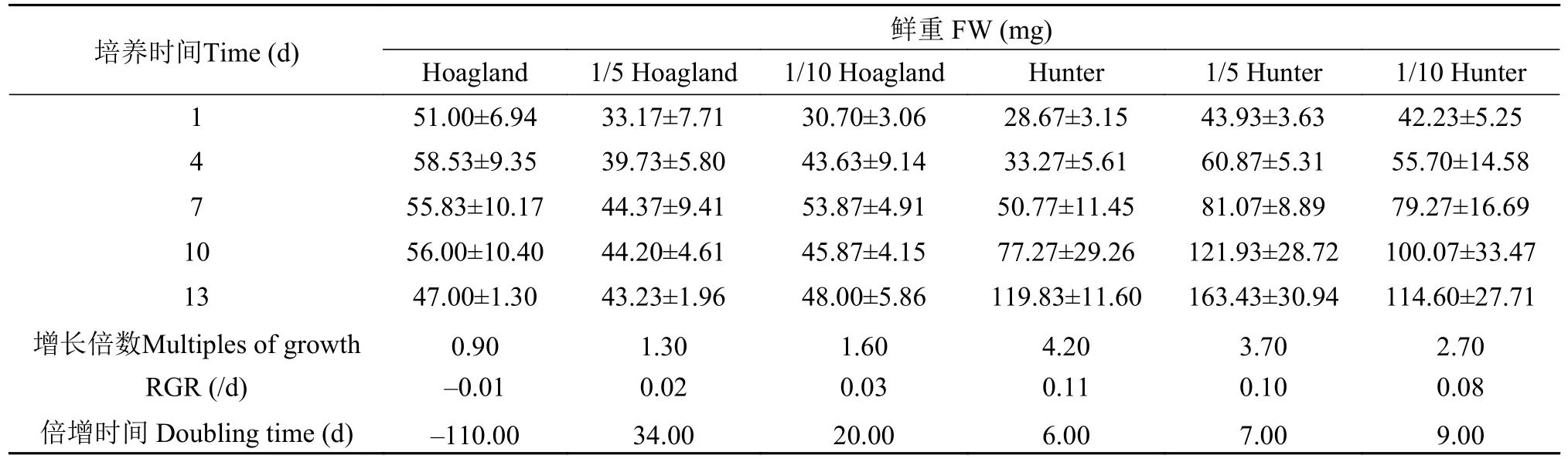
表3 不同培养条件下紫萍种群鲜重变化(平均值±标准差)Tab.3 Fresh weight variation of S.polyrrhiza population under different nutritional conditions (mean±SD)
同样,L.minor鲜重在Hunter各培养水平下增长率高于Hoagland各水平(图2b)。L.minor种群鲜重在Hoagland原液、1/5 Hoagland和1/10 Hoagland培养液的起始增长阶段达最高增长率分别为37.3%、95.2%和167.5%,而在8d后鲜重却逐渐下降;但在Hunter 培养液各水平中,L.minor鲜重培养期间内一直增长,Hunter原液、1/5 Hunter和1/10 Hunter培养液的增长率分别达到895.2%、469.1%和396.3%。
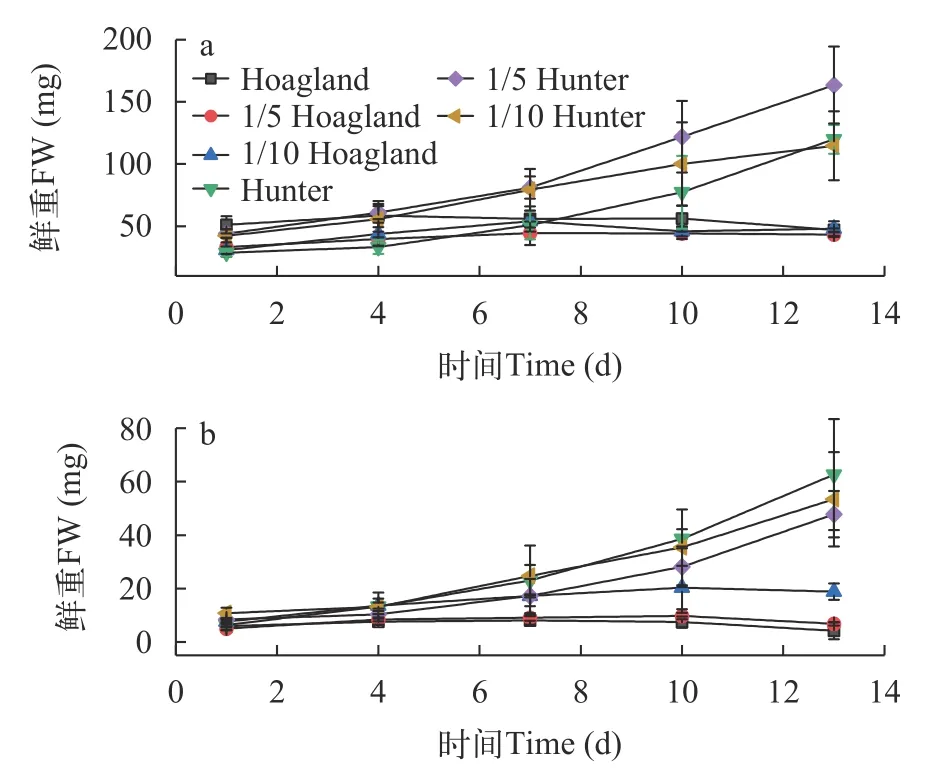
图2 紫萍和青萍在不同培养条件下的鲜重变化Fig.2 Variation of fresh weights of L.minor (a) and S.polyrrhiza(b) under different nutritional conditions
L.minor鲜重RGR在Hoagland 培养液3种培养水平下分别为-0.03、0.02和0.07,而在3种Hunter培养液中的RGR分别为0.12、0.13和0.18(表4),说明L.minor在Hoagland原液中逐渐死亡,而在Hunter培养液中鲜重生长较好。从种群增长倍数和倍增时间来看,L.minor在1/5 Hoagland培养液中,最好的生长表现为10d内倍增数为2.5;在Hunter原液培养基中第4天倍增数即达到9.90。结果表明Hunter各培养液较Hoagland培养液同样更有利于L.minor的生长。
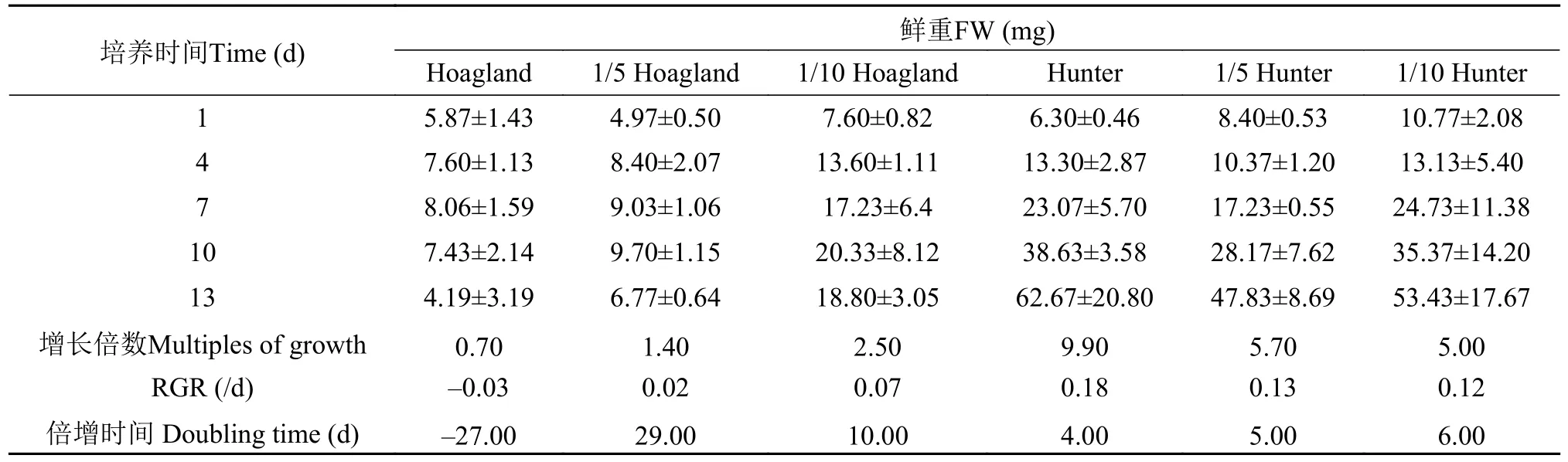
表4 不同培养条件下青萍种群鲜重变化(平均值±标准差)Tab.4 Fresh weight variation of L.minor population under different nutritional conditions (mean±SD)
双因素方差分析表明(表5,P<0.01)培养基类型及其营养水平所占的方差变异百分比较高为83.3%,物种所占方差变异百分比为3.7%,而物种和培养基交互作用所占方差变异百分比为6.5%,这说明浮萍品种和培养基类型对鲜重相对增长率具有极显著的影响,两者之间的交互作用影响也较为显著。在两类培养基的不同营养水平下L.minor的总体鲜重增长趋势高于S.polyrrhiza(图3);LSD多重比较表明Hunter培养液的3种培养条件和Hoagland培养液的3种培养条件具有显著性差异,其中Hunter原液的营养环境对于两种浮萍鲜重RGR更为有利(图3)。
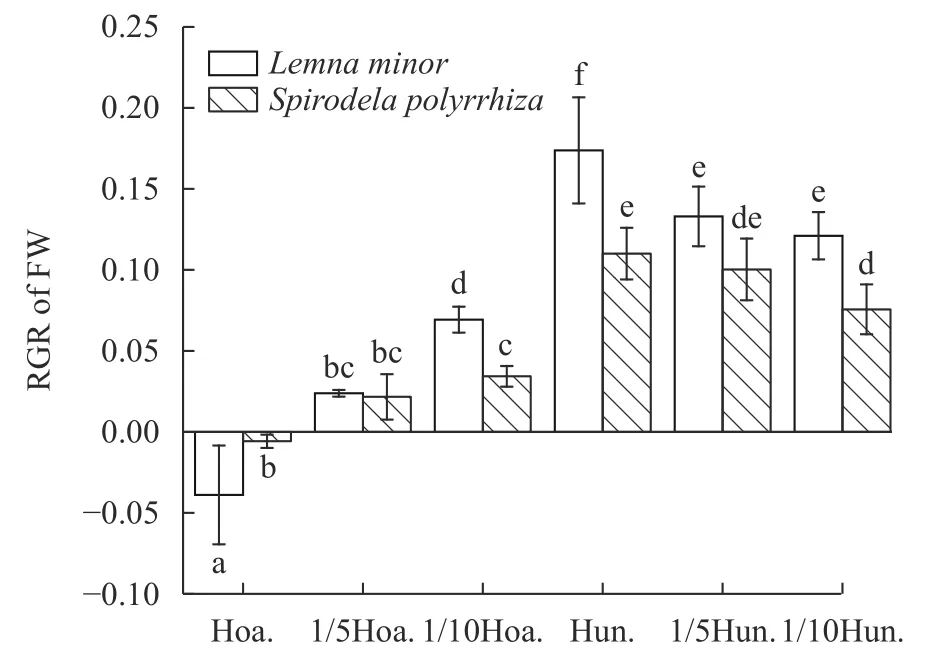
图3 青萍和紫萍鲜重RGR在不同培养条件下的多重比较Fig.3 Multiple comparison of fresh weight RGR of L.minor and S.polyrrhiza under different nutritional conditions
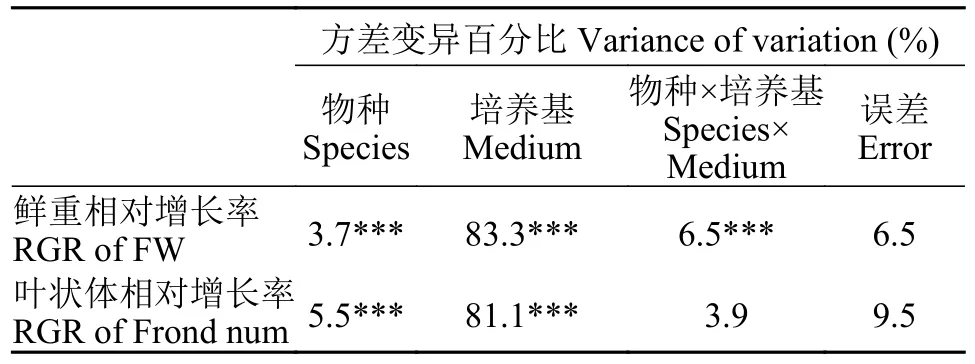
表5 青萍和紫萍鲜重相对增长率、叶状体数相对增长率双因素方差分析Tab.5 Two-factor analysis of variance of the RGR of fresh weight and frond number of L.minor and S.polyrrhiza
2.2 浮萍种群叶状体数变化趋势
S.polyrrhiza和L.minor在Hoagland和Hunter培养基中培养13d后,叶状体数存在类似鲜重的变化趋势(图4)。S.polyrrhiza的叶状体在Hunter培养基各浓度下增长率高于Hoagland培养基(图4a)。S.polyrrhiza种群叶状体数在Hoagland原液、1/5 Hoagland和1/10 Hoagland培养液中起始增长阶段达到的增长率分别为60.0%、59.2%和113.8%。7—8d后,种群叶状体呈现明显的黄化,叶状体无性繁殖速率下降,叶片出现死亡;而在Hunter各培养水平下呈持续增长趋势,Hunter原液、1/5 Hunter和1/10 Hunter培养液的增长率分别达到484.7%、440.2%和300.1%,均表现数量上的翻倍。
叶状体相对增长率RGR值表明,S.polyrrhiza在Hunter培养水平下的叶状体RGR值同样高于Hoagland各培养水平(表6)。Hoagland原液、1/5 Hoagland和1/10 Hoagland培养液中叶状体数RGR分别为0.03、0.04和0.06,1/10Hoagland培养液在6d后才开始翻倍;而Hunter原液、1/5 Hunter和1/10 Hunter培养液中的RGR分别为0.11、0.13和0.14,原液中叶状体数量在1—2d后即开始翻倍增长。这表明在相同培养期内,S.polyrrhiza叶状体数的变化具有与鲜重类似的生长规律,即Hunter培养液更适合S.polyrrhiza叶状体的生长。
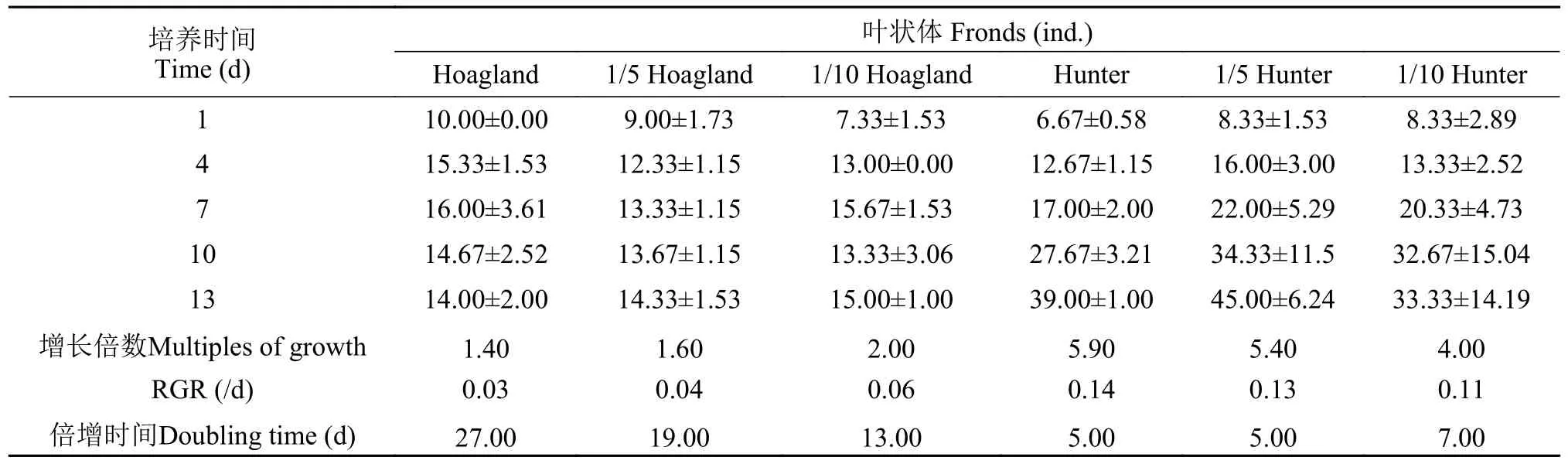
表6 不同培养条件下紫萍种群叶状体变化(平均值±标准差)Tab.6 Variation of fronds of S. polyrrhiza population under different nutritional conditions (mean±SD)
L.minor种群叶状体在Hunter各浓度下增长率也高于Hoagland(图4b)。其在Hoagland原液、1/5 Hoagland和1/10 Hoagland培养液中叶状体繁殖数所达最高增长率分别为256.5%、242.3%和238.8%;而在Hunter各培养水平下呈持续增长趋势,Hunter原液、1/5 Hunter和1/10 Hunter培养液的增长率分别达到1102.8%、753.8%和740.2%,显著高于Hoagland培养基叶状体的增殖率。
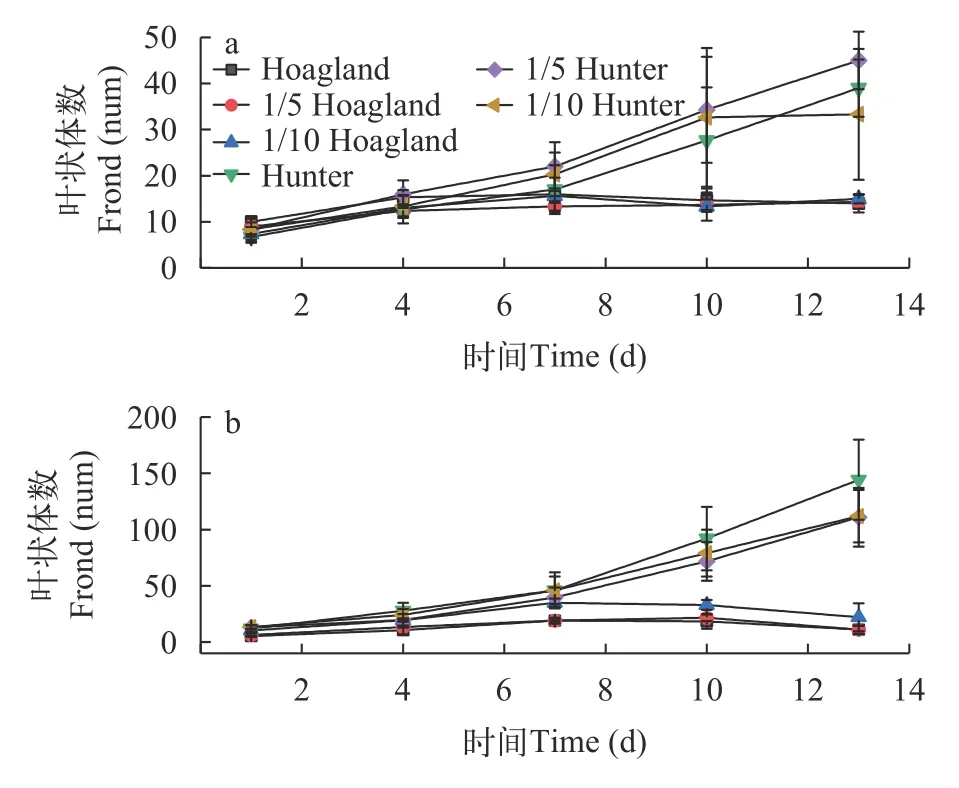
图4 青萍和紫萍在不同培养条件下的叶状体数变化Fig.4 Variation of the number of fronds of (b) and (a) under different nutritional conditions
叶状体相对增长率RGR值表明,L.minor在Hunter培养水平下的叶状体RGR值高于Hoagland各培养水平(表7)。Hoagland原液、1/5 Hoagland和1/10 Hoagland培养液中叶状体数RGR值分别为0.06、0.04和0.06,而Hunter原液、1/5 Hunter和1/10 Hunter培养液中RGR值分别为0.16、0.17和0.19。从叶状体增长倍数和倍增时间可看出,L.minor的叶状体数在1/10 Hoagland培养液中,12d培养期的增长倍数为2.10,而在Hunter原液中,叶状体数在第4d增长倍数即达到12.00,表明L.minor叶状体在Hunter中生长更好。
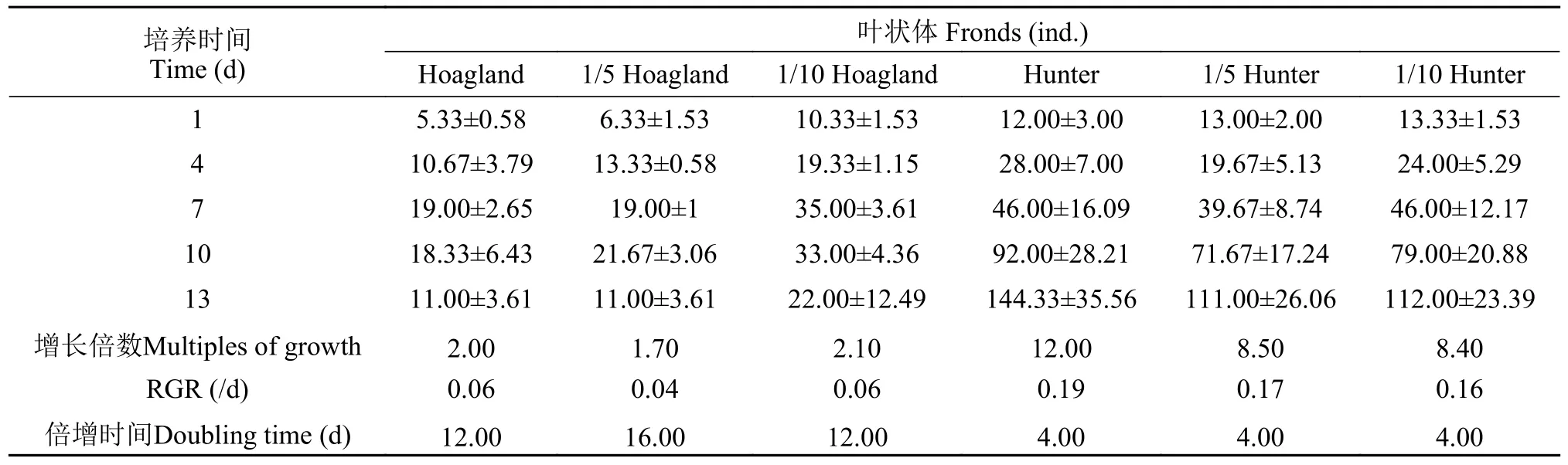
表7 不同培养条件下青萍种群叶状体变化(平均值±标准差)Tab.7 Variation of fronds of L.minor population under different nutritional conditions (mean±SD)
双因素方差分析结果表明(表5,P<0.01),培养基类型及其营养水平所占的方差变异百分比为81.1%,物种所占方差变异百分比为5.5%,而物种和培养基之间的交互作用影响不显著,说明培养基类型及其营养水平和浮萍品种对叶状体的增长具有极显著的影响。进一步做6种培养水平的多重比较(LSD)表明两种浮萍叶状体数增殖在Hoagland培养液3种培养条件下无显著差异,而在3种Hunter培养液条件下具有显著差异的,其中L.minor的叶状体在培养期内的相对增长率要高于S.polyrrhiza,在Hunter原液中达到最大(图5)。

图5 青萍和紫萍叶状体RGR在不同培养条件下的多重比较Fig.5 Multiple comparison of frond number RGR of L.minor and S.polyrrhiza under different nutritional conditions
2.3 浮萍的繁殖策略
两种浮萍在不同类型培养基及其营养水平下,对鲜重和叶状体的资源分配策略不同。在培养期内,紫萍分别在Hoagland培养基原液、稀释1/5和1/10的3种营养水平下,其鲜重比叶状体数的比值均呈下降趋势,且1/5 Hoagland和1/10 Hoagland营养液中紫萍叶状体分株数增加更快(图6a),表明为了适应生长环境中占主导因素的氮磷等营养水平变化,紫萍种群扩大种的适合度,优先选择繁衍后代,增大对叶状体分株数的投资,使得叶状体数目增加的速度快于鲜重,从而导致鲜重和叶状体二者的比值呈现下降趋势。紫萍在Hunter培养基及其不同氮磷营养水平下生长时,其中Hunter原液的紫萍叶状体分株速率要快于1/5 Hunter和1/10 Hunter,说明在Hunter氮浓度较高的环境下,诱导了紫萍快速繁殖子代来提高种群的存活力和适合度。
同样,青萍种群的生活史也表现出相似的规律(图6b)。在培养期内,青萍在Hoagland培养基原液、稀释1/5和1/10的3种营养水平下生长,其中Hoagland原液的氮磷等营养浓度对于青萍种群的胁迫力最大,致使子代叶状体繁殖速率最快即鲜重叶状体比值最低,达到延续种群生存的目的。而在1/10 Hoagland营养液中,由于营养的稀释,诱导青萍种群以母体生长为主,进而鲜重增加快于叶状体的繁殖速率。青萍在Hunter培养基及其不同氮磷营养水平下生长时,鲜重叶状体比值波动不大,整体上均以叶状体数的繁殖为主。
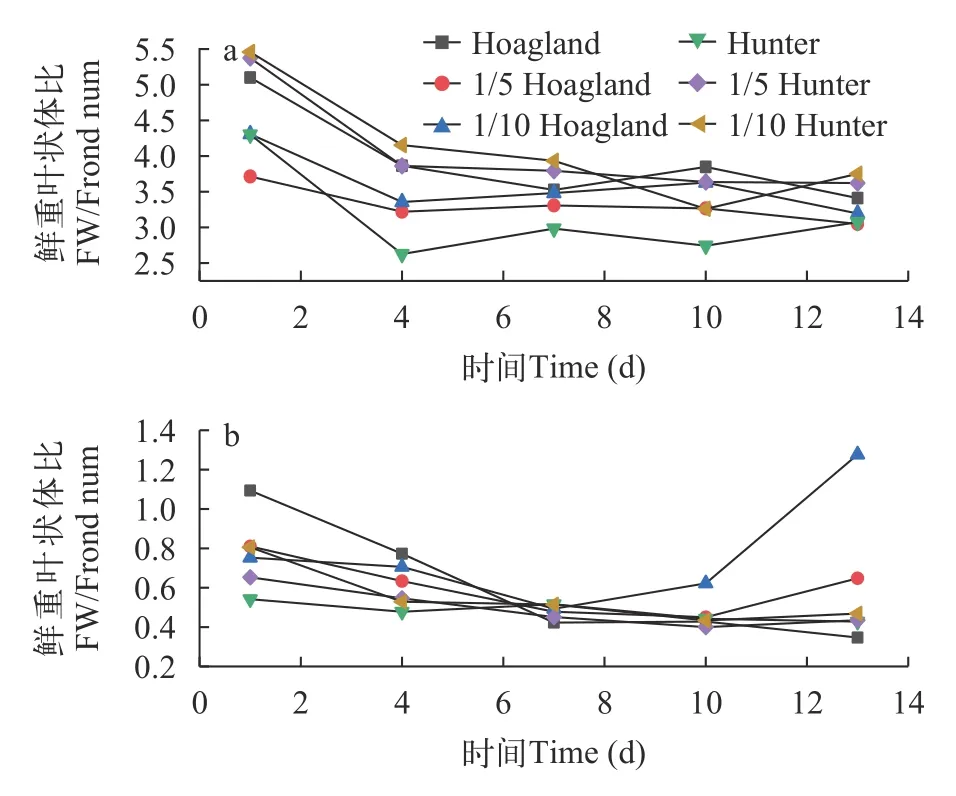
图6 紫萍和青萍在培养期内鲜重叶状体比值变化Fig.6 Variation of the ratio of fresh weight and frond number of L.minor (a) and S.polyrrhiza (b) during cultivation period
3 讨论
本研究认为L.minor和S.polyrrhiza两种浮萍的鲜重和叶状体无性繁殖在Hoagland和Hunter两种类型培养基及其不同浓度水平下具有显著差异。人工培养过程中L.minor在Hunter原液的长势最好,种群个体数呈现指数型增长,收获的鲜生物量最大。陈晓等[25]用Steinberg和Hunter培养液室内培养紫萍和青萍,发现两种浮萍在Steinberg培养液的生长情况较好,而在Hunter培养液生长受到抑制作用,于斌等[23]的研究认为稀脉浮萍、少根紫萍和紫萍在Hoagland培养液中的生长好于Hunter培养液,而与本研究用Hunter培养液获取的L.minorRGR和S.polyrrhizaRGR相当。导致优势培养基差异的原因可能是:(1)浮萍的种间差异性,故对培养液中氮磷等营养盐吸收转化效率不同[13,16];(2)培养方式的不同,连续培养需定期补充养分和水分,而本研究每隔2天即更换新鲜培养液,两种培养方式的不同可能导致培养液生化指标变化[12];(3)浮萍的最佳生长pH为6.50—7.50,pH的升高可引起浮萍体内NH3的解离,当大量的NH3通过扩散作用快速穿过细胞时就会对细胞膜造成伤害,因此高浓度的NH3会对植物生长产生抑制作用,同样NH4+浓度升高也能产生较强的抑制作用[7]。所以连续培养可能会使培养过程中pH过大而导致浮萍NH3中毒,本研究已尽可能避免了这一问题发生。另外,培养初始时采用培养容器的容积不同会影响浮萍的初始生长密度,而浮萍层在培养液表面的覆盖密度过高或过低都会影响浮萍的生长[26]。对于本研究结果Hunter营养液培养浮萍的效果好于Hoagland培养液,一方面可能由于Hoagland各组分营养浓度较高,抑制了浮萍的生长;另一方面可能是Hunter在合适的pH和营养浓度下,丰富的氮源更有利于浮萍的鲜重和叶状体分株的增加。研究表明青萍能够生长的氨氮浓度介于7—84 mg/L,最佳氨氮浓度为28 mg/L,可见青萍富集氨氮的能力较强。在培养过程,青萍的生长速度快于紫萍,表明青萍更能适应不同营养水平的培养液。通过与大量文献中涉及的浮萍培养条件相比较,可把本研究所探究的营养条件(温度、光照和Hunter营养液浓度等)作为广布种L.minor的较优培养条件,继而实现短时间内收获较大浮萍鲜生物量和叶状体数,为进一步资源化利用提供原材料。
