土壤氨基糖及影响其积累的因素综述
2022-08-04马玲玲杨世福林钊凯唐旭利
马玲玲, 杨世福, 林钊凯, 唐旭利
土壤氨基糖及影响其积累的因素综述
马玲玲1,2,3, 杨世福1,2,3, 林钊凯4, 唐旭利1,3,*
1. 中国科学院华南植物园, 广州 510650 2. 中国科学院大学, 北京 100049 3. 中国科学院退化生态系统植被恢复与管理重点实验室, 广州 510650 4. 华南农业大学林学与风景园林学院, 广州 510640
微生物残留物是陆地生态系统土壤有机碳(soil organic carbon, SOC)的主要来源之一, 其在土壤中的积累动态强烈影响着土壤碳库的周转。土壤氨基糖(soil amino sugars, ASs)作为目前已知的表征微生物残留物的生物标志物, 由于微生物异源性和稳定性, 通常被用来建立微生物群落与生态系统物质循环之间的联系。回顾了氨基糖作为微生物残留物指标的原因与应用, 通过简单比较多种微生物生物量指标, 加深对微生物残留物指标的理解。并且基于现有研究, 总结出土壤氨基糖积累因素的相关研究进展, 指出将来的研究应在关注微生物残留物多因素影响积累机制的同时, 扩大研究范围, 以期为未来全球气候变化等情况下更精确的碳汇估算、更科学的农业耕作、森林管护等工作提供有效的理论依据。
氨基糖; 土壤碳库; 土壤结构; 微生物过程; 微生物残体
0 前言
土壤是陆地生态系统最大的碳库, 碳储量为植被的3—4倍, 其碳库的轻微变化都可能对大气CO2造成巨大的影响[1]。土壤碳库也是地球生命物质的基础[2], 但是土壤碳库来源宽泛、成分复杂, 限制了人们对其进一步了解。微生物是土壤的重要组分, 被认为是土壤物质循环的关键调节者[3]。土壤中的异养微生物群落通过消耗环境中的有机质获得能量和营养, 维持正常的生命活动, 得到自身的生长繁殖。与此同时, 大量的微生物残体和微生物分泌物以稳定的非活性有机物质形态在土壤中持续积累, 并在生态系统固碳等方面发挥着重要的生态功能[4–5]。Liang 等(2017)基于微生物群落在土壤碳封存中扮演的角色提出了“微生物碳泵(microbial carbon pump, MCP)”的概念, 并结合微生物分泌物在土壤中的进一步固存, 将微生物来源物质在土壤有机质(soil organic matter, SOM)长期形成中的积累过程定义为“埋葬效应”, 这使我们关注到植物源碳通过微生物途径的转化过程, 并且需要重新审视微生物在土壤碳稳定方面的贡献[6]。
传统的碳循环模型(如CENTURY 等[7]), 将微生物纳入活性碳库(liable soil carbon pool)。与惰性碳库(passive soil carbon pool)相比, 活性碳库具有周转时间短、代谢旺盛的特点, 并且由于微生物进行异养呼吸消耗大量的碳, 因此长期以来学术界都认为微生物在有机碳累积方面贡献甚微。近年来, 随着研究方法的发展和微生物残留物指标的应用, 越来越多的学者开始关注到了微生物残留物指标在评估土壤碳库组成、质量和动态变化中扮演的角色。有研究证明, 相比于仅占土壤有机碳库1%—5%左右的微生物生物量碳[7], 土壤微生物代谢产物及残体可以达到近40倍的微生物生物量, 贡献近50%的可提取有机碳组分、近80%的土壤有机氮[8–9]。大量研究表明, 微生物残体是构成土壤碳库的重要组分, 加深土壤中微生物残体的研究对理解土壤碳库复杂动态日趋重要[10–14]。目前微生物介导碳稳定的机理尚不明确, 还存在如何定量评估微生物维持土壤碳稳定性的作用、微生物残留物是否形成稳定性碳组分等关键问题尚未解决。利用生物标志物手段开展微生物残体的相关研究, 是目前常用的有效做法, 该方法的应用也将对上述问题的解决提供强有力的推动作用。鉴于微生物残留物在生态学中的研究因研究对象不同而较为分散, 缺乏规律性的研究结果。本文选择氨基糖作为微生物残留物生物标志物, 介绍其来源与应用, 并通过比较多种微生物生物量研究手段加深对微生物残留物指标的认识。同时, 为厘清微生物残体和稳定碳库的关系, 试图总结当前国内外对土壤氨基糖控制因素的研究前沿, 并对未来的研究方向提出几点建议和展望, 期望以此来推动微生物残体和土壤氨基糖等概念在生态系统物质循环等方面研究的发展。
1 氨基糖作为微生物残留物的生物标志物
1.1 氨基糖作为微生物残留物生物标志物的原因与应用
完整的活性微生物细胞通常由细胞壁、细胞膜、细胞质和细胞核(或DNA 的集中区域)构成(图1)[15]。在革兰氏阳性菌、革兰氏阴性菌、真菌和古菌中, 细胞结构组成各不相同, 目前生态环境领域通常利用不同微生物细胞组分或结构的差异, 达到区分环境中微生物群落组成的目的。常用的环境基因组测序方法就是根据环境中DNA、RNA 等遗传物质组成的差异分析反映微生物群落组成、结构或代谢状况[16]。微生物的生物膜结构也存在差异性。细菌的细胞质膜由磷脂(占20%—30%)和蛋白质(占50%—70%)组成, 真菌细胞质膜除了具有与原核细胞类似的构造和功能外, 含特有的麦角甾醇, 在磷脂和脂肪酸种类上也存在物种特异性。麦角甾醇和磷脂脂肪酸在微生物死亡后快速降解, 利用磷脂脂肪酸和麦角甾醇可以作为活性微生物量的指示标志物。微生物细胞壁结构和组成在不同微生物类群中也存在差异。除少数不含细胞壁的细菌外, 多数细菌的细胞壁都是位于胞外紧贴胞膜的一层无色透明、坚韧而有弹性的结构, 基本骨架由肽聚糖构成。肽聚糖分子由肽和聚糖两部分组成, 肽有四肽尾和肽桥两种, 聚糖则由N-乙酰胞壁酸(N-acetyl muramic acid, NAM)和N-乙酰葡糖胺(N-acetyl-Glucosamine, NAG)相互间隔连接而成。除了肽聚糖以外, 细胞壁结构中还含有脂多糖、磷脂和多种蛋白组分, 革兰氏阳性菌细胞壁中还含有磷壁酸。古菌的细胞壁由多糖(由N-乙酰葡糖胺和N-乙酰塔罗糖胺糖醛酸以β-1,3糖苷键交替间接成的假肽聚糖)、糖蛋白或蛋白质构成。真菌细胞壁的主要成分为多糖, 另外有少量的蛋白质和脂质。不同真菌细胞壁中的多糖种类不同(表1), 低等真菌中以纤维素为主, 酵母菌以葡聚糖为主, 高等陆生真菌则以几丁质(由N-乙酰-葡糖胺通过β-1,4-糖苷键组成的大分子聚合物)为主[15,17]。与其他大分子物质不同的是, 细胞壁组分中的肽聚糖和几丁质可以相对稳定的在土壤中积累, 构成土壤碳库的重要组分[8]。当微生物死亡后, 细胞破碎, 除细胞壁以外的大多数细胞物质不稳定, 在土壤中滞留的时间很短, 释放到环境中后很快被降解。相比而言, 坚硬而富有弹性、大小相对均匀的细胞壁碎片则可以通过附着在矿物表面或被土壤团聚结构包裹等留存在土壤中, 构成土壤中的微生物残留物或微生物残体(microbial remains or microbial residues)[5]。
鉴于土壤物质的复杂性, 目前运用微生物标志物(microbial biomarker)的手段区分土壤黑箱中微生物残体的分子构成和其他来源物质的分子结构是常用的有效手段[18]。土壤中的氨基糖(amino sugars, ASs)正是表征微生物残留物的生物标志物。氨基糖是细胞壁肽聚糖和几丁质的基本组成单位, 广泛存在于土壤真菌、细菌以及一些土壤低等动物(节肢动物)中, 但不存在于植物细胞的组分[19–20]。自然界氨基糖种类多样, 通过气相色谱法或液相色谱法, 可以定量的分析出土壤中的四种氨基糖, 包括葡糖胺(Glucosamine, GluN)、胞壁酸(Muramic acid, MurN)、半乳糖胺(Galactosamine, GalN)和甘露糖胺(Mannosamine, ManN)(图2)[13–14,21]。其中, 葡糖胺是葡萄糖第2位碳上的羟基被氨基取代后的氨基单糖, 是真菌细胞壁中几丁质、壳多糖的基本组成单位[22–23], 在细菌肽聚糖中也发现以2:1的摩尔比与胞壁酸结合[24–25]。细菌肽聚糖是胞壁酸目前已知的唯一起源, 胞壁酸发生乙酰基化反应, 生成 N-乙酰胞壁酸(N-acetyl muramic acid), 进而构成细菌细胞壁中肽聚糖的基本骨架[26]。半乳糖胺在土壤中含量丰富, 目前在真菌[27]、细菌[28]和古菌[29]中均有发现[30]。甘露糖胺来源广泛, 由于在土壤中含量较低而研究较少[14,31–32]。在多数研究中, 将测得的四种氨基糖的加和作为氨基糖总量。研究表明, 氨基糖占土壤有机氮组分的5%—12%, 构成有机碳组分的2%[33–34], 经过土壤物理隔离或矿质吸附后可以减小土壤有机组分的周转率, 导致该部分残留物在土壤中持续存在[35–36]。在多数生态领域研究中, 将葡糖胺和胞壁酸作为主要研究对象, 用二者的比值指示真细菌残留物比例, 也有少数学者尝试确定他们的转化系数, 使之更便于计量微生物残体在土壤中的贡献[37]。
1.2 多种微生物生物量研究手段的比较
目前测定土壤中微生物生物量的方法很多, 主要原理是基于细胞组成成分的不同, 通过测定特定微生物成分来计算微生物生物量。常用的方法有基因测序法、氯仿熏蒸法、三磷酸腺苷法、磷脂脂肪酸法(PLFAs)、麦角甾醇法等, 但是多数方法都是基于活性微生物生物量展开。氯仿熏蒸法是目前最普遍的微生物生物量测定方法。经氯仿熏蒸后, 微生物细胞内容物释放到土壤, 导致土壤可提取碳氮等物质增加, 进而计算出活性微生物量碳氮。该方法可以同时计算出微生物生物量碳、氮、磷和硫等多种物质, 与同位素研究相结合, 则可以进一步研究环境中的物质循环转化[38], 但是无法区分不同微生物类群的贡献。磷脂脂肪酸方法(PLFAs)利用不同磷脂代表不同的微生物类群, 可以计算出微生物的总量和群落组成。尽管如此, 由于土壤活性微生物群落易受采样点底物变化和环境异质性影响, 还是有不少学者建议, 最好同时采用以上两种方法, 以便验证测定结果的准确性。
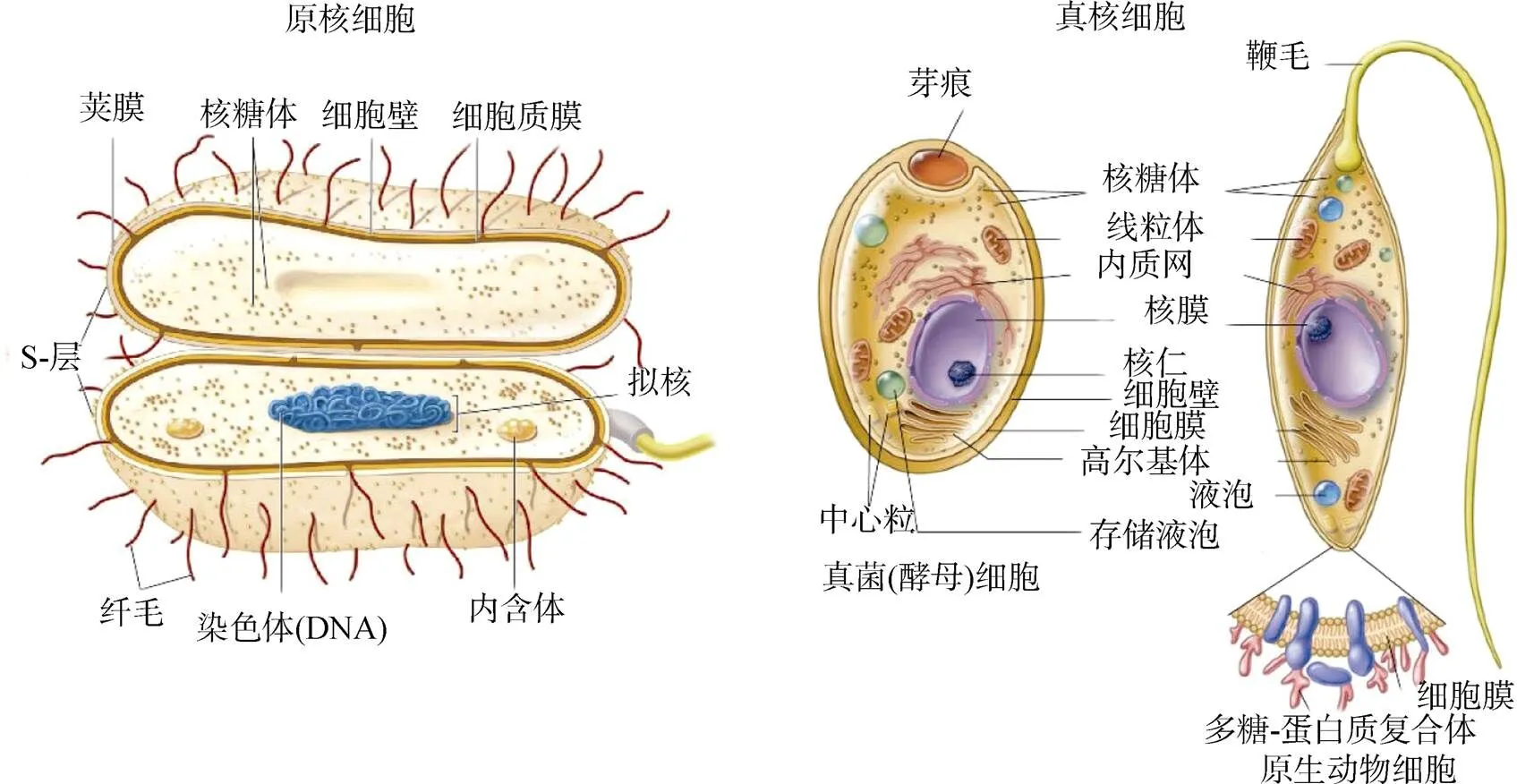
图1 原核和真核微生物细胞结构图[15]
Figure 1 The structure of prokaryotic and eukaryotic cells[15]
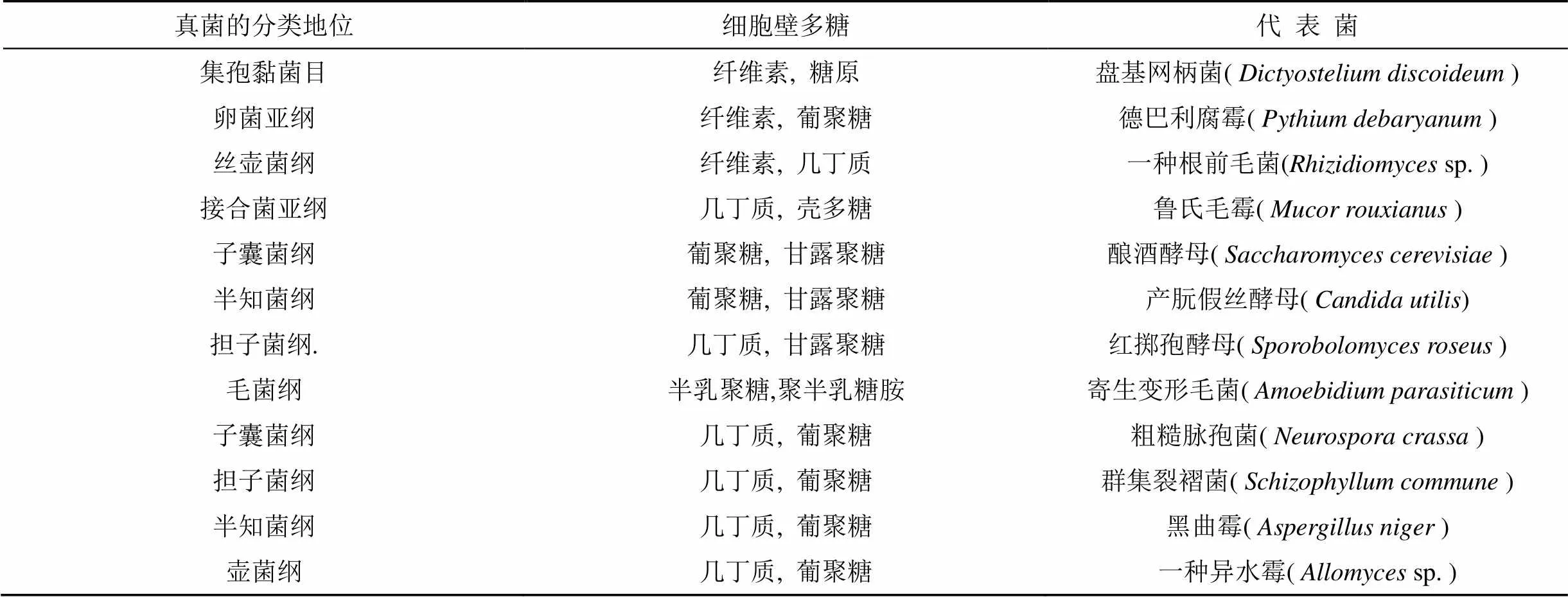
表1 不同分类地位真菌的细胞壁多糖[17]
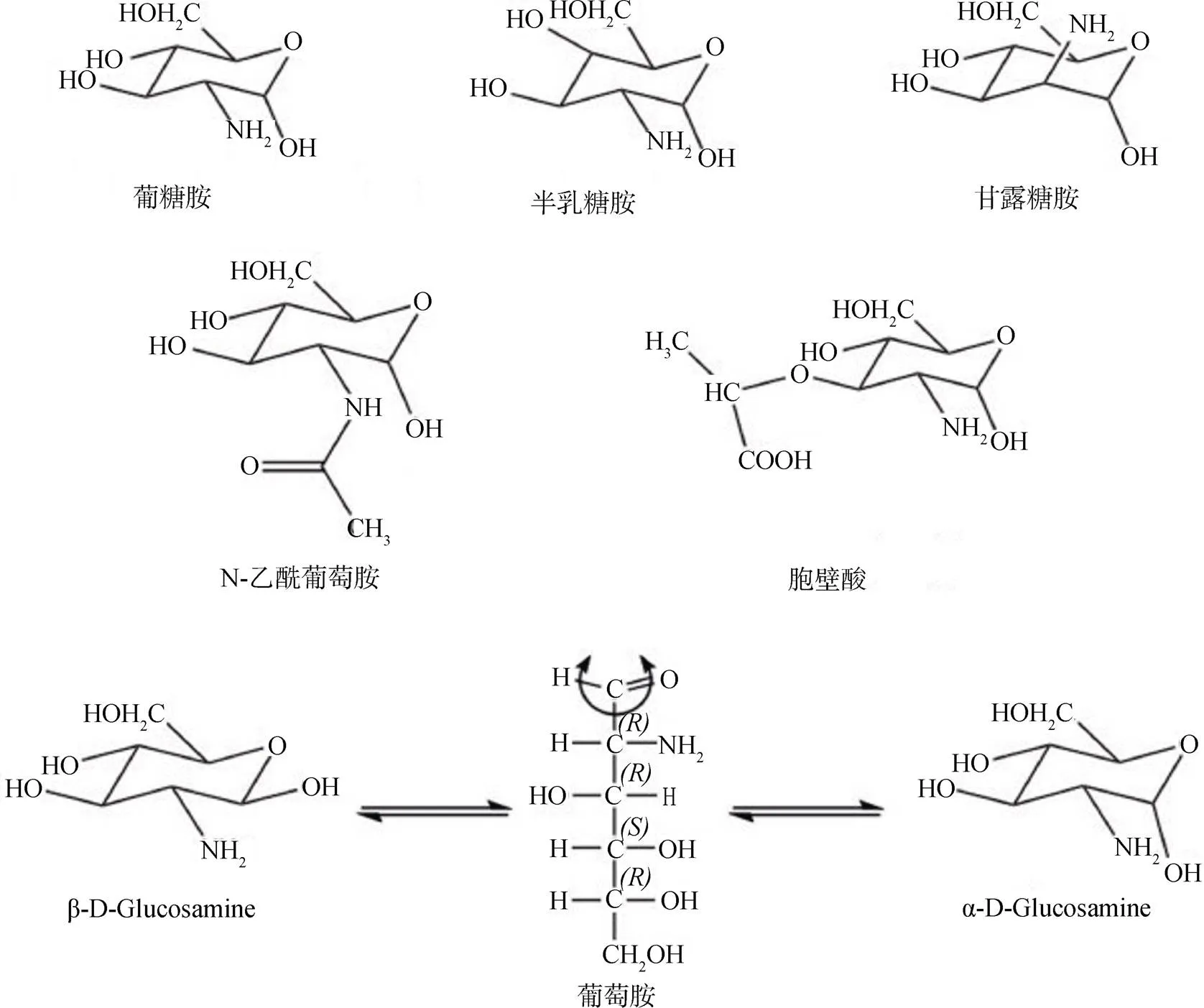
图2 几种主要的氨基糖单体及其同分异构体[36]
Figure 2 Several major amino sugar monomers and isomers[36]
活性微生物参与土壤碳氮循环, 可以逐步将易分解底物分解、加工甚至衍生成稳定含碳化合物, 因此, 相比易受环境影响的瞬时活性微生物指标,不断积累的微生物残留物更能有效指示微生物对物质循环的贡献[6]。在研究活跃的土壤根际微生物时, 采用氯仿熏蒸、麦角甾醇和氨基糖方法同时测定, 发现近50%的土壤有机质由死亡细菌真菌的残留物组成, 而活体微生物指标仅占6%[37]。也有分析表明, 表层土壤中的氨基糖可以比PLFAs含量高3—64倍[10]。另外, 氨基糖指标在区别出来自于微生物的土壤碳组分的同时, 还能对来自细菌和真菌的微生物残留物加以区分, 这对于理解微生物群落结构在物质循环中的作用、预测土壤生物群落对全球变化的响应至关重要。
2 影响土壤氨基糖积累的因素分析
尽管微生物残体具有相对稳定的结构, 可以在土壤中累积, 成为土壤有机组分, 但由于其分子组成含有大量的碳氮, 在一定情况下可以作为微生物可利用碳源、氮源而被分解吸收。因此, 土壤中以氨基糖为代表的微生物残体库并非呈直线累积的趋势, 与其他土壤碳库形态一样, 氨基糖在土壤中的积累和周转取决于其输入和输出之间的动态变化。微生物的生长繁殖直接决定氨基糖的输入, 尽管输入到土壤中的微生物残留物具有一定的抗分解性, 且易于受到环境中的物理或化学保护, 但是仍不可避免会被微生物代谢分解和再利用。另外, 淋溶作用也会导致部分ASs从生态系统中逃逸。因此, 氨基糖在土壤中的积累受多种生物与非生物因素调控, 其合成与分解平衡由微生物群落主导。任何影响微生物群落活性、种群数量以及群落结构的因素, 如植被、水热条件、养分可利用性、土壤物理化学性质等, 都可能以直接或间接的方式对氨基糖的积累产生影响。在此, 分别从生物和非生物因素的角度, 介绍当前土壤氨基糖积累的影响因素研究进展。
2.1 生物因素对土壤氨基糖积累的影响
2.1.1 微生物
有关氨基糖及其与生物因素的关系相关研究多从微生物和植物的角度开展。微生物通过体外和体内两种途径将原始分解底物转化为土壤碳。微生物残体作为微生物群落对分解底物的“体内作用途径”产物在土壤中沉积, 直接受到微生物群落状态的影响[6]。长久以来, 微生物群落为应对不同环境形成了多样的生活史策略, 通过自身生长、资源获取来应对环境胁迫, 对环境产生特异性适应[39]。在不同的生境中, 受微生物群落结构、种群大小、代谢能力差异的影响, 微生物介导碳周转过程呈现特异性响应, 微生物残体的积累也因此产生差异。在森林中的研究发现, 土壤微生物残留物贡献的差异可以一定程度上反映出微生物优势类群, 比如, 细菌残留物对阔叶林土壤碳库的贡献大于针叶林, 原因正是受微生物群落对资源的利用策略的影响, 阔叶林中有更多的细菌, 导致细菌残留物的贡献增加[24]。微生物残留物的分解离不开土壤中代谢酶的作用, 研究发现, 在可利用氮含量较低的情况下, 氨基糖总量对β-N-乙酰氨基葡萄糖苷酶有负响应; 对亮氨酸氨基肽酶有正响应。说明在微生物可利用氮较低时氨基糖能作为氮源被利用, 但是相比更易于获取的氨基酸等氮源, 并不会被优先分解[40]。
2.1.2 植被和凋落物
植物与微生物共同作为生态系统中活跃的生命主体, 植物生产供给微生物生命活动所需的底物和能量, 微生物活动帮助植物获取有益的营养元素, 通过频繁的物质和能量交换, 共同促进生态系统的良性发展。陆续有研究表明, 不同的植被类型、植物多样性以及生物量等均可以对微生物群落产生重要的影响。比如, 鼎湖山三种典型亚热带森林土壤中微生物量呈现季风常绿阔叶林>针阔叶混交林>马尾松林的趋势, 与3种森林植物多样性、生产力水平以及与该地区土壤有机碳库大小的趋势一致[41]。井艳丽等比较了落叶松纯林和落叶松-赤杨混交林内土壤氨基糖的积累状况, 结果表明含有固氮树种赤杨的混交林具有更高的微生物残留物水平, 且土壤全氮是驱动土壤中氨基糖发生变化的主要因子。说明高的植物多样性可以提高微生物对碳的转化, 以微生物残体形式“埋葬”更多的碳[42]。Liang 等的实验室培养结果也有相似的结论, 添加不同物种的植物材料对氨基糖积累的结果产生差异[43–44]。在地表凋落物的相关研究中发现, 凋落物层普遍存在更多的氨基糖[10]。不同生态系统中的凋落物受生产者(植物)自身特性影响呈现巨大的差异, 在分解者(微生物)的转化下, 最终转化为更趋同的普通化合物(如氨基糖等)或其他惰性碳库的组分[6,45–48]。因此地表凋落物中活跃的微生物群落受凋落物的数量和质量的强烈影响。王宝荣等研究了在辽东栎()枯落叶分解过程中叶际氨基糖等指标变化特征, 发现枯落叶叶际具有高于土壤的氨基糖含量, 随着枯落叶分解的进行, 氨基糖总量上升, 葡糖胺与胞壁酸的比值与枯落叶中C:N的变化趋势一致, 反映了随着凋落物分解过程中, 凋落物质量的变化引起微生物群落结构的变化, 高质量的枯落叶对应了更高比例的细菌群落, 导致更多细菌残体积累[49]。
2.2 非生物因素对土壤氨基糖积累的影响
2.2.1 水热条件
通常微生物群落组成及动态受土壤水热环境和理化性质的强烈影响。作为微生物生命活动的产物, 土壤氨基糖的量和质也因上述非生物因素不同而异。已有研究对不同生态系统中氨基糖与水热条件、土壤理化性质的关系进行了广泛探讨。韩永娇等采用室内培养法研究了葡萄糖与氮肥添加条件下棕壤中不同微生物来源氨基糖的响应[50]。结果表明, 干湿交替改变了土壤中微生物的群落结构, 细菌残留物标志物胞壁酸的转化更容易受到干湿交替处理的影响。在自然生态系统中, 关于土壤碳循环各个过程受到温度、湿度、土壤水分渗透等影响的研究较多。如土壤水分渗透率是凋落物分解产物从凋落物层输送到土壤矿质层的关键因子[51], 遗憾的是, 目前还没有相关文献关注到经过淋溶、水分渗透作用下的微生物残体碳库的变化。微生物残体碳库在土壤垂直和水平方向上的迁移转化研究尤为重要。已有的土壤氨基糖与水热条件关系的研究多集中于区域尺度上氨基糖随水热变化呈现的差异。如北美草原的相关研究表明, 随着年平均降雨量的增加, 真菌氨基糖含量呈增加趋势, 细菌胞壁酸含量呈下降趋势。氨基糖与年均温呈抛物线关系, 中温条件(10—15 ℃)下最高[52]。Xia等通过中国东部地区水稻土中微生物残体水平量化研究, 发现胞壁酸及其对SOC的贡献从寒冷干燥地区向温暖湿润地区呈现增加趋势; 而真菌残体水平在不同温度带间没有明显变化趋势。引起变化的主要原因是由温度和降水主导[11]。目前, 通过探讨环境因子对土壤微生物群落、土壤呼吸、凋落物分解等的影响来阐述土壤有机碳循环关键环节的研究较多, 而且大部分集中于温带地区, 研究对象以农田、草原生态系统为主[53–55]。相比之下, 鲜有从环境因子影响微生物残体积累和矿化的角度研究土壤碳循环机理。未来随着全球气候变化情势复杂, 更深入了解环境因子对土壤微生物影响的机理将有助于预测未来全球变化下生态系统的碳汇功能走向, 制定更合理的土地利用策略。
2.2.2 土壤物理性质
土壤物理性质主要包括土壤容重、孔隙状况、土壤颗粒组成等能够反映出土壤物理结构、养分水分固持状况的多项指标[56]。近年来人们越来越认识到受物理保护的土壤有机质在固碳和保持土壤肥力上有重要作用, 对土壤物理结构的研究升温[57]。有研究表明小粒径的黏粒土壤和微团聚体中有更多的微生物量、更稳定的微生物副产物, 从而存留更多的有机质[58–60]。这是因为与其他土壤组分相比, 黏粒具有更大的比表面积, 能增加对有机质分子的吸附能力; 土壤微团聚体结构通过在微生物和酶及其底物之间形成物理屏障, 减缓了由微生物引起的有机质的周转[61–63]。目前很多研究报道了土壤物理结构影响氨基糖的积累。比如, 北美草原表层土壤有机质中氨基糖的浓度随土壤颗粒的变小而增加, 黏粒中氨基糖的含量显著上升[31]。同样Turrion等发现森林砍伐主要影响较粗质地的砂砾中的氨基糖含量, 证明黏粒中含有较高的微生物生物量和微生物副产物, 并且黏粒组分可以有效保护有机质免受环境扰动的影响[64]。应注意的是, 不同的微生物产物被黏壤土稳定的量存在差异[65]。
2.2.3 土壤化学性质
土壤微生物的活性受底物特性的直接影响。面临微生物和底物化学计量特征的巨大差异, 微生物通过调整自身化学计量特征、群落结构、胞外酶比例、元素利用效率等几种机制作出响应, 改变获得能量和资源的投资策略[66]。受底物有效性差异影响, 微生物群落对底物的选择性利用将导致氨基糖的积累产生差异[67–69]。李响等运用同位素标记技术跟踪土壤氨基糖动态, 探讨了不同底物形态对氨基糖形成的影响。结果表明, NH4+向氨基糖的转化显著高于NO3-, 反映出微生物对NH4+的选择性利用[70]。在农田生态系统中加入酰胺态氮如尿素的时候, 则会导致微生物残体的降解[71]。说明微生物残留物作为氮源被微生物重新利用时, 极易受到土壤中可利用氮形态差异的影响。在连续时间尺度上土壤养分的异质性将导致微生物群落产生不同的适应策略。因此, 理论上生态系统物质循环过程产生的微生物残留物也体现了微生物群落长期适应环境养分异质性的结果, 这恰恰是活性微生物指标所不能及的。
土壤的其他化学成分如重金属、矿质元素通过与有机质分子发生化学螯合和物理吸附等作用, 或通过对活性微生物群落的抑制来保护有机底物不受酶的分解[72]。具有较大比表面积的非晶型铁氧化物和有机质紧密结合, 可以降低有机物的周转速率[73–74]; 活化的重金属和Al等元素与有机碳耦合形成大分子络合物, 改变含碳化合物的化学氧化特性, 从而延缓土壤有机碳的分解[75]。目前, 作为有机质的重要组分, 氨基糖和土壤矿质元素的相互作用机制尚不明确。凋落物层微生物对铁、铝、锰矿物响应的结果表明, 随着凋落物分解的进行, 氨基糖总量增加, 随着培养时间的延长, 细菌产物相对于真菌产物的累积量增加。不同矿物质对氨基糖积累的影响存在差异, 含锰氧化物促进氨基糖的积累, 铁铝氧化物抑制细菌氨基糖的合成[76], 这与Miltner和Zech对矿物质影响凋落物分解的研究有相似的趋势[77–78]。新的研究表明, 当前的大多数地球系统模型由于未考虑矿物表面有机质吸附、底物和微生物过程的动态作用, 导致高估了土壤碳储量对全球变暖的响应[79]。微生物残留物指征微生物群落对物质循环的贡献, 同时本身又代表了SOM的重要组成, 全球变化形势赋予复杂土壤环境下的微生物响应以深刻意义, 深入理解矿质表面的微生物动态显得尤为迫切。
2.3 多因子交互对土壤氨基糖积累的影响
在以往关于有机碳周转和积累的研究中多关注于单一因子产生的影响。事实上, 自然界中的任何变化都是由多种生态因子共同作用的结果, 无法将某一变量独立剥离出去。对于作为微生物残留物的生物标志物——氨基糖, 同样如此, 多种因素的共同作用形成了特定区域内土壤氨基糖的积累状态。近来的许多研究也相继表明, 未来氨基糖积累机制的研究正朝着多因子交互作用影响的方向发展。Ma等在蒙古草原的研究表明, 在影响氨基糖积累的12类环境变量中, 干旱指数对氨基糖的影响在结构方程模型中是唯一的显著路径, 而植物生物量、微生物群落等环境变量均非显著路径[80]。Li等在农田中的研究也探讨了物理、生化和微生物因素控制农田土壤中氨基糖的积累机制, 关注到多种因素的共同作用对氨基糖积累的影响, 发现在不同的农业管理措施下, 氨基糖的积累机制存在一定的趋同。并且, 土壤的物理保护作用对胞壁酸积累的影响较大, 而微生物活性、养分供应等对葡糖胺积累的影响更大[40]。
3 研究展望
目前, 对于微生物残体的相关研究仍处于起步阶段, 将微生物残体相关概念应用到生态系统物质循环领域中的研究报道在国内外极少。尽管通过磷脂脂肪酸(PLFAs)等活性微生物生物量指标指示某一个状态下的微生物群落特征和微生物对碳氮循环的贡献非常直观, 但是依据瞬时的微生物群落信息来建立与长期的有机质周转之间的联系具有的说服力却十分有限[81]。微生物群落可以通过调整其生物量、活性以及群落结构等适应不断变化的外界环境或异质性大的生存条件[82–85], 说明微生物群落状态的瞬时响应无法用来准确衡量长期的物质周转中微生物的贡献[86–87]。土壤中稳定遗留的氨基糖等微生物残留物是微生物介导有机碳周转过程中通过自身的增殖、代谢和死亡等生命活动的积累产物[84,88], 可以代表长期土壤有机碳形成过程中相当数量的微生物来源物质[24,81,89]。因此, 使用氨基糖等指标可以建立微生物和长期的物质周转之间的关系, 更准确评估微生物的生态作用。微生物残体作为土壤碳库的重要组成部分, 它在不同环境下的积累状况也深刻影响到未来土壤碳库的动态变化。综上所述, 本文回顾了氨基糖作为微生物残留物标志物的原因与应用, 总结当前土壤氨基糖积累的影响因素研究相关进展, 我们认为未来在对土壤碳库、微生物残体或氨基糖等相关研究时应着重关注:
(1)微生物残体碳库在深层土壤中的作用。根据目前已知, NPP 在生态系统内的垂直分配受植物根系和生态系统类型的影响, 在草原、灌丛、农田和森林中产生不同的植被碳配置[90–91], 进而影响着不同深度土壤有机质的分布。因此受微生物可利用底物垂直分布的影响, 微生物生物量和残留物积累在不同植被类型不同深度土层, 将呈现不同的分布格局[81]。目前已有研究关注到微生物生物量残体对深层土壤碳储存有较大的贡献, 但具体的机理研究仍存在许多空白[10,81]。未来随着全球气候的变化, 探讨土壤有机碳的周转和固存将更离不开深层土壤碳库的作用[92]。
(2)扩大研究区域, 增加对森林生态系统和低纬度地区的相关研究。森林生态系统是陆地生态系统的主体, 碳储量占整个陆地植被碳储量的80%以上[93–94]。已有研究表明, 位于低纬度地区的老龄林仍保持较高的土壤有机碳增长速率, 但影响老龄林碳收支的地上地下过程机理仍不清晰[95]。当前关于微生物残体的大量研究仍聚焦于农田和草地生态系统, 对于森林生态系统, 尤其是低纬度的热带和亚热带地区的森林的研究相对缺乏, 加强土壤微生物残体的研究可能有助于当前一系列问题的解决。
(3) 关注多因子对氨基糖积累效应的研究。现有的研究缺乏对微生物残体的积累(包括产生和矿化)的多角度探究。正确认识微生物残体在土壤有机碳库中的地位, 深入探讨微生物残体的积累机制, 将有助于摸清生态系统在长期演化过程中微生物残体对土壤有机碳固存和周转的贡献, 更深入了解微生物在生态系统物质循环中起到的作用, 为更精确的评估生态系统碳汇功能以及土壤碳汇潜力的科学估算提供数据支持; 进而在生态恢复工作、解释成熟森林土壤固碳机理及土壤微生物响应全球变化的机制等相关研究提供理论基础。
[1] SCHMIDT M W I, TORN M S, ABIVEN S, et al. Persistence of soil organic matter as an ecosystem property[J]. Nature, 2011, 478(7367):49–56.
[2] JACKSON R B, LAJTHA K, CROW S E, et al. The ecology of soil carbon: pools, vulnerabilities, and biotic and abiotic controls[J]. Annual Review of Ecology, Evolution, and Systematics, 2017, 48(48): 419–445.
[3] ROMERO-OLIVARES A L, ALLISON S D, TRESEDER K K. Soil microbes and their response to experimental warming over time: A meta-analysis of field studies[J]. Soil Biology and Biochemistry, 2017, 107: 32–40.
[4] SIX J, FREY S D, THIET R K, et al. Bacterial and fungal contributions to carbon sequestration in agroecosystems[J].Soil Science Society of America Journal, 2006, 70(2): 555–569.
[5] MILTNER A, BOMBACH P, SCHMIDT-BRUCKEN B, et al.SOM genesis: microbial biomass as a significant source[J]. Biogeochemistry, 2012, 111(1/3): 41–55.
[6] LIANG Chao, SCHIMEL J P, JASTROW J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2(8):1–6.
[7] PARTON W J, SCHIMEL D S, COLE C V, et al. Analysis of factors controlling soil organic-matter levels in great-plains grasslands[J]. Soil Science Society of America Journal, 1987, 51(5): 1173–1179.
[8] LIANG Chao, CHENG Guang, WIXON D L, et al. An absorbing Markov chain approach to understanding the microbial role in soil carbon stabilization[J]. Biogeochemistry, 2011, 106(3): 303–309.
[9] SIMPSON A J, SIMPSON M J, SMITH E, et al. Microbially derived inputs to soil organic matter: Are current estimates too low[J]? Environmental Science and Technology, 2007, 41(23): 8070–8076.
[10] NI Xiangyin, LIAN Shu, TAN Siyi, et al. A quantitative assessment of amino sugars in soil profiles[J]. Soil Biology and Biochemistry, 2020, 143: 1–10.
[11] XIA Yinhang, CHEN Xiangbi, HU Yajun, et al. Contrasting contribution of fungal and bacterial residues to organic carbon accumulation in paddy soils across eastern China[J]. Biology and Fertility of Soils, 2019, 55(8): 767–776.
[12] DING Xueli, CHEN Shengyun, ZHANG Bin, et al. Warming increases microbial residue contribution to soil organic carbon in an alpine meadow[J]. Soil Biology and Biochemistry, 2019, 135: 13–19.
[13] INDORF C, DYCKMANS J, KHAN K S, et al. Optimisation of amino sugar quantification by HPLC in soil and plant hydrolysates[J]. Biology and Fertility of Soils, 2011, 47(4): 387–396.
[14] ZHANG Xudong, AMELUNG W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils[J]. Soil Biology and Biochemistry, 1996, 28(9): 1201–1206.
[15] 马田. 植物和微生物来源有机碳在草地土壤中的分布与积累机制[D]. 北京: 中国科学院植物研究所, 2019: 1–9.
[16] THOMAS T, GILBERT J, MEYER F. Metagenomics - a guide from sampling to data analysis[J]. Microbial informatics and experimentation, 2012, 2(3): 1–12.
[17] 沈萍, 陈向东. 微生物学[M]. 北京: 高等教育出版社, 2006.
[18] LIANG Chao, AMELUNG W, LEHMANN J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578–3590.
[19] PRAVDIC N, DANILOV B. Unsaturated amino-sugars in the preparation of a new type of Nucleoside .1. isolation and identification of products in the reaction of 2-Acetamido-3,4,6-Tri-0-Acetyl-1,5-Anhydro-2-Deoxy-D-Arabino-Hex-1-Enitol with theophylline[J]. Carbohydrate Research, 1981, 97(1): 31–44.
[20] STEVENSON F J. Isolation and identification of amino-sugars in soil[J]. Soil Science Society of America Journal, 1983, 47(1): 61–65.
[21] JOERGENSEN R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biology and Fertility of Soils, 2018, 54(5): 559–568.
[22] CHEN J K, SHEN C R, YEH C H, et al. N-acetyl glucosamine obtained from chitin by chitin degrading factors in[J]. International Journal of Molecular Sciences, 2011, 12(2): 1187–1195.
[23] 牛腾飞, 李江华, 堵国成, 等. 微生物法合成N-乙酰氨基葡萄糖及其衍生物的研究进展[J]. 食品与发酵工业, 2019, 46(1): 274–279.
[24] SHAO Shuai, ZHAO Yu, ZHANG Wei, et al. Linkage of microbial residue dynamics with soil organic carbon accumulation during subtropical forest succession[J]. Soil Biology and Biochemistry, 2017, 114: 114–120.
[25] YADAV V, PANILAITIS B, SHI Hai, et al. N-acetylglucosamine 6-Phosphate deacetylase (nagA) is required for n-acetyl glucosamine assimilation in gluconacetobacter xylinus[J]. PLoS One, 2011, 6(6): e18099.
[26] 胡婕伦, 刘丽萍, 傅博强, 等. 胞壁酸研究进展[J]. 中国食品学报, 2019. 19(4): 295–300.
[27] BARDALAYE P C, NORDIN J H. Galactosaminogalactan from cell-walls of aspergillus-niger[J]. Journal of Bacteriology, 1976, 125(2): 655–669.
[28] SRADNICK A, INGOLD M, MAROLD J, et al. Impact of activated charcoal and tannin amendments on microbial biomass and residues in an irrigated sandy soil under arid subtropical conditions[J]. Biology and Fertility of Soils, 2014, 50(1): 95–103.
[29] NIEMETZ R, KARCHER U, KANDLER O, et al. The cell wall polymer of the extremely halophilic archaeon[J]. European Journal of Biochemistry, 1997, 249(3): 905–911.
[30] ENGELKING B, FLESSA H, JOERGENSEN R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil[J]. Soil Biology and Biochemistry, 2007, 39(8): 2111–2118.
[31] ZHANG Xudong, AMELUNG W, YING Ya, et al. Amino sugar signature of particle-size fractions in soils of the native prairie as affected by climate[J]. Soil Science, 1998, 163(3): 220–229.
[32] 郭金强, 袁华茂, 宋金明, 等. 氨基糖单体碳氮同位素的分析及其应用[J]. 应用生态学报, 2020,31(5): 1753–1762.
[33] AMELUNG W. Nitrogen biomarkers and their fate in soil[J]. Journal of Plant Nutrition and Soil Science, 2003, 166(6): 677–686.
[34] HU Yuntao, ZHENG Qing, WANEK W. Flux analysis of free amino sugars and amino acids in soils by isotope tracing with a novel liquid chromatography/high resolution mass spectrometry platform[J]. Analytical Chemistry, 2017, 89(17): 9192–9200.
[35] MIKUTTA R, KAISER K, DORR N, et al. Mineralogical impact on organic nitrogen across a long-term soil chronosequence (0.3-4100 kyr)[J]. Geochimica Et Cosmochimica Acta, 2010, 74(7): 2142–2164.
[36] VANDENBOER T C, DI LORENZO R A, HEMS R F, et al. Quantitation of amino sugar stereoisomer and muramic acid biomarkers by hydrophilic interaction liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2020, 1618: 1–11.
[37] APPUHN A, JOERGENSEN R G. Microbial colonisation of roots as a function of plant species[J]. Soil Biology and Biochemistry, 2006, 38(5): 1040–1051.
[38] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[39] MALIK A A. Defining trait-based microbial strategies with consequences for soil carbon cycling under climate change[J]. The ISME Journal, 2019, 14(1):1–9.
[40] LI Lidong, WILSON C B, HE Hongbo, et al. Physical, biochemical, and microbial controls on amino sugar accumulation in soils under long-term cover cropping and no-tillage farming[J]. Soil Biology and Biochemistry, 2019, 135:369–378.
[41] 易志刚, 蚁伟民, 周丽霞, 等. 鼎湖山主要植被类型土壤微生物生物量研究[J]. 生态环境, 2005, 14(5): 727–729.
[42] 井艳丽, 刘世荣, 殷有, 等. 赤杨对辽东落叶松人工林土壤氨基糖积累的影响[J]. 生态学报, 2018, 38(8): 2838–2845
[43] LIANG Chao, ZHANG Xudong, BALSER T C. Net microbial amino sugar accumulation process in soil as influenced by different plant material inputs[J]. Biology and Fertility of Soils, 2007, 44(1): 1–7.
[44] LIANG Chao, ZHANG Xudong, RUBERT K F, et al. Effect of plant materials on microbial transformation of amino sugars in three soil microcosms[J]. Biology and Fertility of Soils, 2007, 43(6): 631–639.
[45] ANGERS D A, MEHUYS G R. Barley and alfalfa cropping effects on carboydrate contents of a clay soil and its size fractions[J]. Soil Biology and Biochemistry, 1990, 22(3): 285–288.
[46] QUIDEAU S A, CHADWICK O A, BENESI A, et al. A direct link between forest vegetation type and soil organic matter composition[J]. Geoderma, 2001, 104(1/2): 41–60.
[47] FILLEY T R, BOUTTON T W, LIAO J D, et al. Chemical changes to nonaggregated particulate soil organic matter following grassland-to-woodland transition in a subtropical savanna[J]. Journal of Geophysical Research-Biogeosciences, 2008, 113(G3): 1–11.
[48] STEWART C E, NEFF J C, AMATANGELO K L, et al. Vegetation effects on soil organic matter chemistry of aggregate fractions in a Hawaiian forest[J]. Ecosystems, 2011, 14(3): 382–397.
[49] 王宝荣. 辽东栎枯落叶分解过程中叶际氨基糖及微生物量动态变化特征研究[D]. 杨凌: 西北农林科技大学, 2018.
[50] 韩永娇, 张威, 何红波, 等. 干湿交替条件下棕壤氨基糖的动态及指示作用[J]. 土壤通报, 2012, 43(6): 1391–1396.
[51] LEE X, WU Huiju, SIGLER J, et al. Rapid and transient response of soil respiration to rain[J]. Global Change Biology, 2004, 10(6): 1017–1026.
[52] AMELUNG W, ZHANG Xudong, FLACH K W, et al. Amino sugars in native grassland soils along a climosequence in North America[J]. Soil Science Society of America Journal, 1999, 63(1): 86–92.
[53] JACINTHE P A, LAL R, OWENS L B, et al. Transport of labile carbon in runoff as affected by land use and rainfall characteristics[J]. Soil and Till Research, 2004, 77(2): 111–123.
[54] O’BRIEN S L, JASTROW J D, GRIMLEY D A, et al. Moisture and vegetation controls on decadal-scale accrual of soil organic carbon and total nitrogen in restored grasslands[J]. Global Change Biology, 2010, 16(9): 2573–2588.
[55] COTRUFU M F, ALBERTI G, INGLIMA I, et al. Decreased summer drought affects plant productivity and soil carbon dynamics in a Mediterranean woodland[J]. Biogeosciences, 2011, 8(9): 2729–2739.
[56] 宗巧鱼, 艾宁, 杨丰茂, 等. 陕北黄土区枣林土壤物理性质变化研究[J]. 中国农学通报, 2020, 36(6): 48–56.
[57] WILPISZESKI R L, AUFRECHT J A, RETTERER S T, et al. Soil aggregate microbial communities: towards understanding microbiome interactions at biologically relevant scales[J]. Applied and Environmental Microbiology, 2019, 85(14): e00324-19.
[58] SORENSEN L H. Influence of clay on rate of decay of amino-acid metabolites synthesized in soils during decomposition of cellulose[J]. Soil Biology and Biochemistry, 1975, 7(2): 171–177.
[59] AMATO M, LADD J N. Decomposition of C-14-labeled glucose and legume material in soils - properties influencing the accumulation of organic residue-C and microbial biomass-C[J]. Soil Biology and Biochemistry, 1992, 24(5): 455–464.
[60] SINSABAUGH R L, SHAH J J F. Ecoenzymatic stoichiometry and ecological theory[J]. Annual Review of Ecology, Evolution, and Systematics, 2012, 43:313–343.
[61] EDWARDS A P, BREMNER J M. Microaggregates in soils[J]. Journal of Soil Science, 1967, 18(1): 64–73.
[62] TISDALL J M, OADES J M. Organic-matter and water-stable aggregates in soils[J]. Journal of Soil Science, 1982, 33(2): 141–163.
[63] SIX J, PAUSTIAN K, ELLIOTT E T, et al. Soil structure and organic matter: I. Distribution of aggregate-size classes and aggregate-associated carbon[J]. Soil Science Society of America Journal, 2000, 64(2): 681–689.
[64] TURRION M B, GLASER B, ZECH W. Effects of deforestation on contents and distribution of amino sugars within particle-size fractions of mountain soils[J]. Biology and Fertility of Soils, 2002, 35(1): 49–53.
[65] PUGET P, ANGERS D A, CHENU C. Nature of carbohydrates associated with water-stable aggregates of two cultivated soils[J]. Soil Biology and Biochemistry, 1999, 31(1): 55–63.
[66] 周正虎, 王传宽. 微生物对分解底物碳氮磷化学计量的响应和调节机制[J]. 植物生态学报, 2016, 40(6): 620–630.
[67] MANZONI S, TROFYMOW J A, JACKSON R B, et al. Stoichiometric controls on carbon, nitrogen, and phosphorus dynamics in decomposing litter[J]. Ecological Monographs, 2010, 80(1): 89–106.
[68] MOOSHAMER M, WANEK W, SCHNECKER J, et al. Stoichiometric controls of nitrogen and phosphorus cycling in decomposing beech leaf litter[J]. Ecology, 2012, 93(4): 770–782.
[69] DENG Qi, CHENG Xiaoli, YANG Yuanhe, et al. Carbon-nitrogen interactions during afforestation in central China[J]. Soil Biology and Biochemistry, 2014, 69:119–122.
[70] 李响, 何红波, 张威, 等. 外源无机氮素形态对土壤氨基糖动态的影响[J]. 应用生态学报, 2012, 23(5): 1153– 1158.
[71] 李晓波, 张威, 田秋香, 等. 尿素向氨基糖的转化以及对土壤氨基糖库动态的影响[J]. 土壤学报, 2011, 48(6): 1189–1195.
[72] HEMINGWAY J D, ROTHMAN D H, GRANT K E, et al. Mineral protection regulates long-term global preservation of natural organic carbon[J]. Nature, 2019, 570(7760): 228–231.
[73] SIX J, CONANT R T, PAUL E A, et al. Stabilization mechanisms of soil organic matter: Implications for C-saturation of soils[J]. Plant and Soil, 2002, 241(2): 155–176.
[74] 王帅, 徐俊平, 王楠, 等. FTIR及SEM诊断铁铝锰氧化物参与微生物利用木质素形成矿物-菌体残留物的结构特征[J]. 光谱学与光谱分析, 2018, 38(7): 2086–2093.
[75] DEROME J, LINDROOS A J. Effects of heavy metal contamination on macronutrient availability and acidification parameters in forest soil in the vicinity of the Harjavalta Cu-Ni smelter, SW Finland[J]. Environmental Pollution, 1998, 99(2): 225–232.
[76] AMELUNG W, MILTNER A, ZHANG Xudong, et al. Fate of microbial residues during litter decomposition as affected by minerals[J]. Soil Science, 2001, 166(9): 598– 606.
[77] MILTNER A, ZECH W. Carbohydrate decomposition in beech litter as influenced by aluminium, iron and manganese oxides[J]. Soil Biology and Biochemistry, 1998, 30(1): 1–7.
[78] MILTNER A, ZECH W. Beech leaf litter lignin degradation and transformation as influenced by mineral phases[J]. Organic Geochemistry, 1998, 28(7/8): 457–463.
[79] TANG Jinyun, RILEY W J. Weaker soil carbon-climate feedbacks resulting from microbial and abiotic interactions[J]. Nature Climate Change, 2015. 5(1): 56–60.
[80] MA Tian, ZHU Shanshan, WANG Zhiheng, et al. Divergent accumulation of microbial necromass and plant lignin components in grassland soils[J]. Nature Communications, 2018, 9(3480):1–9.
[81] LIANG Chao, BALSER T C. Preferential sequestration of microbial carbon in subsoils of a glacial-landscape toposequence, Dane County, WI, USA [J]. Geoderma, 2008, 148(1): 113–119.
[82] WARDLE D A, BARDGETT R D, KLIRONOMOS J N, et al. Ecological linkages between aboveground and belowground biota[J]. Science, 2004, 304(5677): 1629–1633.
[83] BANNING N C, GLEESON D BB, GRIGG A H, et al. Soil microbial community successional patterns during forest ecosystem restoration[J]. Applied and Environmental Microbiology, 2011, 77(17): 6158–6164.
[84] SCHMIDT J, SCHULZ E, MICHALZIK B, et al. Carbon input and crop-related changes in microbial biomarker levels strongly affect the turnover and composition of soil organic carbon[J]. Soil Biology and Biochemistry, 2015, 85: 39–50.
[85] SMITH A P, MARIN-SPIOTTA E, BALSER T. Successional and seasonal variations in soil and litter microbial community structure and function during tropical postagricultural forest regeneration: a multiyear study[J]. Global Change Biology, 2015, 21(9): 3532–3547.
[86] LIANG Chao, FUJINUMA R, BALSER T C. Comparing PLFA and amino sugars for microbial analysis in an Upper Michigan old growth forest[J]. Soil Biology and Biochemistry, 2008, 40(8): 2063–2065.
[87] STEENWERTH K L, DRENOVSKY R E, LAMBERT J J, et al. Soil morphology, depth and grapevine root frequency influence microbial communities in a Pinot noir vineyard[J]. Soil Biology and Biochemistry, 2008, 40(6): 1330–1340.
[88] LLUDWIG M, ACHTENHAGEN J, MILTNER A, et al. Microbial contribution to SOM quantity and quality in density fractions of temperate arable soils[J]. Soil Biology and Biochemistry, 2015, 81:311–322.
[89] AMELUNG W, BRODOWSKI S, SANDHAGE-HOFMANN A et al. Combining biomarker with stable isotope analyses for assessing the transformation and turnover of soil organic matter[M]. San Diego: Elsevier Academic Press Inc, 2008: 155–250.
[90] JACKSON R B, MOONEY H A, SCHULZE E D. A global budget for fine root biomass, surface area, and nutrient contents[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(14): 7362–7366.
[91] JOBBAGY E G, JACKSON R B. The vertical distribution of soil organic carbon and its relation to climate and vegetation[J]. Ecological Applications, 2000, 10(2): 423–436.
[92] LUO Zhongkui, WANG Guocheng, WANG Enli. Global subsoil organic carbon turnover times dominantly controlled by soil properties rather than climate[J]. Nature Communications, 2019, 10(3688): 1–10.
[93] BONAN G G. Forests and climate change: Forcings, feedbacks, and the climate benefits of forests[J]. Science, 2008, 320(5882): 1444–1449.
[94] TRUMBORE S, BRANDO P, HARTMANN H. Forest health and global change[J]. Science, 2015, 349(6250): 814–818.
[95] ZHOU Guoyi, LIU Shuguang, LI Zhian, et al. Old-growth forests can accumulate carbon in soils[J]. Science, 2006, 314(5804): 1417–1417.
Soil amino sugars and the factors affecting their accumulation
MA Lingling1,2,3, YANG Shifu1,2,3, LIN Zhaokai4, TANG Xuli1,3*
1. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China 2. University of Chinese Academy of Sciences, Beijing 100049, China 3.Key Laboratory of Vegetation Restoration and Management of Degraded Ecosystem, Chinese Academy of Sciences, Guangzhou 510650, China 4.,,Guangzhou 510640, China
Soil amino sugars (ASs), representing microbial cell wall residues, are the key microbial residual biomarkers which are associated with soil carbon cycling in terrestrial ecosystem. In recent years, ASs are often used as indicators to connect microbial community dynamics and ecosystem nutrient cycling. Here, the brief history and applications of amino sugars as microbial residues indices were reviewed, and the merits of ASs as microbial residual indicators were elaborated by comparing with various microbial biomass indices adopted in the previous studies. We also summarized current understanding of factorsinfluencingsoil amino sugar accumulation. Based on the knowledge of ASs related studies, we suggest future study should pay more attention to multi-factors mechanism of ASs accumulation and to regional knowledge on the patterns and dynamics of ASs, which is also essential in carbon sequestration mechanisms in light of climate change.
amino sugar; soil carbon pool; soil structure; microbial processes; microbial remains or microbial residues
马玲玲, 杨世福, 林钊凯, 等.土壤氨基糖及影响其积累的因素综述[J]. 生态科学, 2022, 41(5): 252–263.
MA Lingling, YANG Shifu, LIN Zhaokai, et al. Soil amino sugars and the factors affecting their accumulation[J]. Ecological Science, 2022, 41(5): 252–263.
10.14108/j.cnki.1008-8873.2022.05.029
X833
A
1008-8873(2022)05-252-12
2020-08-29;
2020-10-15
国家自然科学基金项目(31770491)
马玲玲(1996—), 女, 山东淄博人, 硕士, 主要从事生态系统生态学研究, E-mail: malingling@scbg.ac.cn
唐旭利, 女, 博士, 副研究员, 主要从事生态系统生态学研究, E-mail: xltang@scib.ac.cn
