模拟增温对青海湖河源湿地土壤微生物群落特征的影响
2022-08-04章妮杨阳陈克龙
章妮, 杨阳, 陈克龙
模拟增温对青海湖河源湿地土壤微生物群落特征的影响
章妮1,2, 杨阳1,2, 陈克龙2,3,*
1. 青海师范大学生命科学学院, 西宁 810008 2. 青海省自然地理与环境过程重点实验室, 西宁 810008 3. 青海师范大学科技处, 西宁 810008
湿地生态系统在生物多样性保护等方面有着重要的功能及地位, 不同的湿地生态系统在功能上存在差异, 土壤微生物在湿地生态系统中发挥着重要作用, 但目前对河源湿地的土壤微生物群落开展的研究较少。全球变暖大背景下, 为探究温度升高对河源湿地土壤微生物的影响, 利用高通量测序方法来深入了解模拟增温后土壤细菌及真菌的群落结构及多样性的变化。青海湖河源湿地细菌的优势菌群为变形菌门、酸杆菌门、放线菌门及厚壁菌门, 真菌的优势菌群为子囊菌门、担子菌门。细菌群落对比真菌群落而言对土壤增温的响应更为明显, 细菌菌群的相对丰度呈增加趋势, 真菌群落仅Hypocreales目相对丰度显著增加; 土壤细菌及真菌群落的丰富度均降低, 而群落多样性增加。增温影响了土壤细菌及真菌的群落结构及多样性, 且细菌群落对土壤增温更为敏感。
河源湿地; 增温; 土壤微生物; 高通量测序
0 前言
土壤微生物组成了一个强大的动力资源库, 在养分的持续循环和地上生态系统的驱动方面起着至关重要的作用[1]。土壤微生物也影响着植物健康[2]、土壤结构[3]等进而影响着地上生态系统。湿地生态系统中, 土壤微生物不仅维持着系统的稳定性, 也参与了生态修复、生物多样性保护等生态过程[4]。因此, 土壤微生物在湿地生态系统中极其重要。湿地作为一个复杂多样化的生态系统, 为多种生物提供了栖息环境, 同时也为人类生存提供了一定的环境条件, 其功能和地位是不可替代的[5]。但湿地生态系统受到多重因素的干扰, 致使湿地面积持续萎缩、功能多样性降低以及资源不断减少。已有研究表明80%的湿地资源正在丧失、退化[6], 这对生存环境及生物多样性带来了不利影响。我国湿地分布极广[7], 湿地面积达到了5360.26万hm2, 为世界湿地面积排名第四的国家[8]。我国青藏高原作为全球气候变化的敏感区, 湿地面积约为13.19×104km2, 占全国湿地面积的20%[9-10], 在全球变化研究中也有着重要地位[11]。青海湖流域位于青藏高原东北部, 为国际重要湿地, 也是我国重要的生态功能调节区。
近年来, 自然因素与人为因素的综合作用造成了青海湖流域水土流失、生物多样性减少、草场退化等生态问题[12], 其中气候变化对青海湖流域的湿地生态系统影响显著。IPCC第五次报道指出, 截止到本世纪末, 全球地表平均温度上升了约1.5—2.0 ℃, 2018—2100年全球气温将持续上升[13], 这将对青海湖流域产生极大影响。目前, 对湿地的植物[14-15]、动物[16-18]、微生物[19-21]及生态评价[22-24]等方面均有研究, 但不同湿地生态系统具有的生态功能存在差异性[25], 针对河源湿地的研究多为对河源湿地生态系统的评估与评价[26-28], 河源湿地土壤微生物的研究依然较少。对模拟增温条件下河源湿地土壤微生物的研究有利于深入了解全球变暖后河源湿地生态系统的作用机制, 为河源湿地生态系统的保护提供一定的参考依据。
1 研究区概况
研究区为沙柳河上游源头的典型河源湿地, 位于青海湖北岸, 地理位置为37°43′—37°46′ N、100°01—100°05′ E, 平均海拔在3720—3850 m。该区昼夜温差极大, 为高原大陆性气候, 多年平均温度为-3.31 ℃, 年降水量在420.37 mm, 同时也是以小嵩草 () 主要植被的高寒草甸。
2 材料与方法
2.1 样品采集
本实验于2015年设置增温实验, 采用高于92%透光率的聚丙烯酸脂作为开顶箱 (Open-Top Chamber, OTC) 的制作材料, OTC增温圈上表面直径为150 cm, 边长为87 cm; 下表面直径为208 cm, 边长为122 cm。该装置对0—10 cm土层增温约1.3 ℃, 10—20 cm土层增温约1.0 ℃。实验设置两个处理、三个重复, 取三个样方内增温处理土壤 (WW), 同时取距增温圈2 m内自然状态土壤 (Wck) 作为对照。于2019年8月采集土壤样品, 每个样方采取随机取五钻土的方式, 对0—10 cm, 10—20 cm土壤分层取样, 同层土壤混匀后过2 mm筛, 用10 mL的EP管保存土壤样品, 分别标记为Wck1-1、Wck1-2、Wck2-1、Wck2-2、Wck3-1、Wck3-2、WW1-1、WW1-2、WW2-1、WW2-2、WW3-1、WW3-2, 置于液氮罐中用于高通量测序。
2.2 基因组DNA提取
土壤微生物总DNA提取试剂盒 (PowerSoil) 提取样品的总基因组DNA, 试剂盒来源于美国的Mio-bio公司。PCR扩增的土壤细菌引物为CCTAYGGGRBGCASCAG(正向引物)、GGACTACNNGGGTATCTAAT(反向引物), 土壤真菌的引物为CTTGGTCATTTAGAGGAAGTAA(正向引物)、GCTGCGTTCTTCATCGATGCPCR(反向引物), 扩增过程参照文献进行[29,30]。
2.3 数据分析
PCR扩增产物转化得到原始测序序列 (Sequenced Reads) 后利用FLASH v1. 2. 7软件[31]拼接PE reads得到原始Tags数据 (Raw Tags), 再利用Trimmomatic v0.33软件[32]、UCHIME v4.2软件[33]得到Effective Tags。UCLUST软件[34]基于序列的相似性高于97%的分别利用Silva(细菌)和 UNITE(真菌)聚类得到OTU数目以及韦恩图, R 包绘制Heatmap聚类分析图, Mothur软件[35]对α-多样性评估, SPSS 21.0对土壤微生物的群落结构及多样性进行ANOVA单因素方差分析, 对组间及组内数据作显著性检验。Excel 2018绘制相对丰度饼图。
3 结果与分析
3.1 基于序列相似度的OTU分类
高通量测序得到的有效序列经OTU分类后得到1607个细菌OTU, 87个真菌OTU。WW土壤细菌及真菌的OTU数目与Wck保持了一致性。为验证测序数据量是否足以反映样品中的物种多样性, 构建了所有样品土壤细菌(图1A)及真菌的稀释性曲线(图1B)。可以看出, 随着测序数据的增加, 各样品的曲线逐渐趋于平坦, 表明无须再增加测序量, 也表明了本实验数据的测序数量的合理性。
3.2 增温对土壤微生物群落结构的影响
以青海湖河源湿地相对丰度大于1%的土壤微生物菌群构建饼图, 细菌菌群(图2)以变形菌门 (Proteobacteria, 50.77%)、酸杆菌门 (Acidobacteria, 18.17%)、放线菌门 (Actinobacteria, 6.28%)、厚壁菌门 (Firmicutes, 5.01%)、Rokubacteria门 (3.89%)、疣微菌门 (Verrucomicrobia, 3.79%)、芽单胞菌门 (Gemmatimonadetes, 3.19%)、绿弯菌门 (Chloroflexi, 3.14%)、硝化螺旋菌门 (Nitrospirae, 2.52%)、拟杆菌门 (Bacteroidetes, 2.15%) 为主要菌群; 真菌门水平的已知菌群主要为子囊菌门 (Ascomycota, 56.59%)、担子菌门 (Basidiomycota, 22.16%), 真菌目水平(图3)以未分类菌群 (未分类菌群, 28.54%) 相对丰度最高,其余主要菌群为鸡油菌目 (Cantharellales, 15.79%)、柔膜菌目(Helotiales, 15.13%)、煤炱目 (Capnodiales, 12.90%)、肉座菌目(Hypocreales, 11.96%)、伞菌目 (Agaricales, 5.69%)、粪壳菌目 (Sordariales, 2.99%)、Myrmecridiales目 (2.61%)、盘菌目 (Pezizales, 1.10%)。
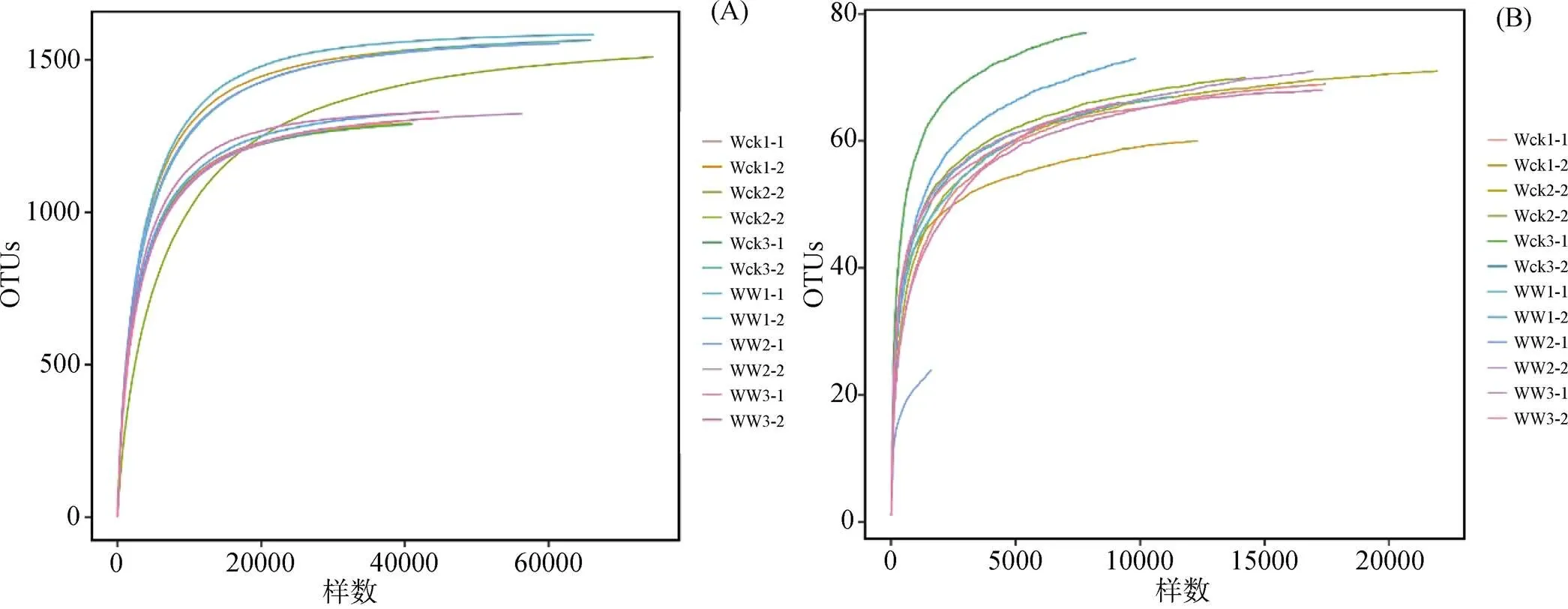
图1 土壤细菌 (A) 及真菌 (B) 稀释性曲线图
Figure 1 Dilution curves of soil bacteria (A) and fungi (B)

图2 细菌群落主要菌群相对丰度
Figure 2 Relative abundance of main flora in bacterial community

表1 不同处理下细菌菌群的相对丰度

图3 真菌群落主要菌群相对丰度
Figure 3 Relative abundance of major flora in the fungal community
对不同处理的样品的土壤微生物菌群的相对丰度计算均值及标准误, 增温处理后的土壤微生物菌群的相对丰度都发生改变。细菌的主要菌群(表1)中有7个菌群的相对丰度升高, Bacteroidetes门、Proteobacteria门及Verrucomicrobia门的相对丰度降低, 但细菌菌群相对丰度的变化并不显著。真菌目水平有9个主要菌群(表2), 其中4个菌群的相对丰度升高, 5个菌群的相对丰度降低, 但仅Hypocreales目的相对丰度显著升高 (= 0.015)。
3.3 增温对土壤微生物群落多样性的影响
增温处理影响了青海湖河源湿地土壤微生物群落多样性(表3)。细菌群落的ACE指数、Chao1指数、Simpson指数表现为Wck>WW, Shannon指数表现为Wck 表2 不同处理下真菌菌群的相对丰度 表3 土壤微生物群落多样性指数 3.4.1 不同土层土壤微生物群落结构 计算不同土壤层次样品细菌(表4)及真菌(表5)的均值、标准误。对Wck、WW组内不同层次进行ANOVA分析。Wck1与Wck2在细菌门水平上存在10个有显著差异的菌群, 主要菌群中仅在Firmicutes门差异显著 (= 0.013); 而在真菌门水平下的Ascomycota门表现出显著性差异 (= 0.024), 但真菌目水平并无存在显著差异的菌群。WW1与WW2的细菌菌群仅有4个表现出显著性差异, 但主要菌o群中的Chloroflexi门 (= 0.024)、Gemmatimonadetes门 (= 0.033)及Nitrospirae门 (= 0.016)均表现出显著差异; 真菌群落则完全没有表现出显著差异。对组间同层样品进行比较, 0—10 cm土层中, Wck1与WW1的细菌菌群仅在Entotheonellaeota门有显著差异 (= 0.013), 但该菌群相对丰度较低; 真菌菌群则没有显著差异。10—20 cm土层中, Wck2与WW2的细菌菌群中的14个菌群差异显著, 主要菌群中Actinobacteria门 (= 0.033)、Firmicutes门 (= 0.013)、Gemmatimonadetes门 (= 0.016)、Nitrospirae门 (= 0.008) 表现出显著差异; 真菌菌群都未表现出显著差异。表明土壤微生物对温度的上升的响应中, 群落结构会发生变化, 不同土层细菌的多个群落变化显著, 但真菌群落结构的变化并不显著, 表明细菌群落对温度升高更为敏感。 表4 不同土层细菌主要群落相对丰度 表5 不同土层真菌主要群落相对丰度 3.4.2 不同土层土壤微生物群落多样性 分析不同土层土壤微生物群落的丰富度及多样性(表6)。组内分析表明, Wck1与Wck2的细菌群落的丰富度指数(ACE指数、Chao1指数)差异极显著 (= 0.00), 且Wck1 热图(图4)是基于距离算法得到样品间的距离矩阵, 通过R包绘制的样品热图, 可根据颜色梯度的变化直观看出两样品间的差异性, 图中各样品间均表现出一定的差异。土壤细菌菌群(图4A)差异性明显, Wck1-2、Wck2-2、Wck3-2、WW1-1、WW2-1聚为一支, 差异性较小, 其余样品聚为一支, 两大支间差异明显。土壤真菌菌群(图4B)差异更大, 所有样品聚为三支, Wck1-2、Wck2-2、Wck3-2、WW1-1、WW2-1仍聚为一支, Wck1-1、Wck2-1、Wck3-1聚为一支, 其余四个样品聚为一支。表明增温处理后0—10 cm土层的微生物群落趋于与10–20 cm土层的微生物群落保持一致性。 表6 不同土层土壤微生物群落多样性指数 图4 不同样品间土壤微生物差异热图 Figure 4 Heat map of soil microbial differences among different samples 土壤微生物对生存的微环境变化极为敏感, 温度升高影响土壤微生物的群落结构及多样性。Papatheodorou等人的研究表明, 对比其他土壤微生物群落特征, 土壤微生物的群落组成可能对环境变化更为敏感[36]。青海湖河源湿地的细菌主要菌群为变形菌门、酸杆菌门、放线菌门、厚壁菌门、疣微菌门、芽单胞菌门、绿弯菌门、硝化螺旋菌门和拟杆菌门; 真菌优势菌群为子囊菌门以及担子菌门, 其目水平的主要菌群则有鸡油菌目、柔膜菌目、煤炱目、肉座菌目、伞菌目、粪壳菌目、Myrmecridiales目、盘菌目。这与湿地土壤微生物优势菌群的报道具有高度的一致性[37-39]。本实验中, 增温处理后青海湖河源湿地细菌群落的十个主要菌群中有7个菌群相对丰度升高, 另外三个菌群相对丰度降低; 表明温度升高增加了土壤细菌的相对丰度。熊金波等人的研究同样表明了增温会改变土壤细菌的群落结构[40]。真菌目水平的9个主要菌群中4个菌群相对丰度升高, 但仅肉座菌目的相对丰度在统计学上显著升高, 其余5个菌群相对丰度降低。已有的研究表明温度升高对土壤微生物群落结构有影响[41-43]。本实验中土壤细菌及真菌的大多菌群变化并不显著, 这与Schindlbacher等人[44]研究表明气候变暖没有影响大多数微生物群的丰度相一致。以往研究表明不同土壤层次的微生物群落结构存在较大差异[45]。本实验对0—10 cm及10—20 cm土壤样品的微生物群落结构剖析, 结果表明Wck组内差异较大, 十个菌群在统计学上表现出显著差异, 厚壁菌门为唯一一个差异显著的相对丰度较高的菌群; 真菌菌群中, 子囊菌门差异显著, 但在真菌目水平并无差异显著的菌群。而WW组内差异相对较小, 4个细菌菌群表现出显著差异, 其中芽单胞菌门、绿弯菌门及硝化螺旋菌门三个主要菌群均差异显著; 但真菌菌群不存在显著差异。Wck与WW组间同层分析表明, 0—10 cm土层仅细菌菌群中Entotheonellaeota门差异显著; 10—20 cm土层中微生物群落结构的显著差异仍体现在细菌菌群, 14个细菌菌群均表现出显著差异, 其中Actinobacteria门、Firmicutes门、Gemmatimonadetes门、Nitrospirae门为主要细菌菌群。夏北成等人发现在不同层次的土壤环境中细菌群落有明显的变化[46], 这与本实验的结果一致。赵建琪等人的研究也表明不同层次的土壤微生物的群落结构均发生了变化[47]。 已有研究表明气候变暖可能改变土壤微生物群落的多样性[48]。本实验增温处理后, 土壤细菌及真菌群落的ACE指数、Chao1指数、Simpson指数均下降, Shannon指数升高, 表明土壤微生物群落多样性对增温的响应体现在丰富度指数的降低以及均一度指数的升高。Gregory等人的研究也证实了增温会导致土壤微生物的群落多样性变化[49]。Chengqun Yu 等人七年的模拟增温实验也表明土壤微生物多样性会发生变化, 与本实验一致[50]。0—10 cm及10—20 cm土壤样品的微生物群落多样性ANOVA分析表明, Wck组内细菌群落丰富度指数差异显著, 10—20 cm土层的细菌丰富度明显高于0—10 cm土层; WW组内多样性指数差异显著, 0—10 cm土层细菌多样性高于10—20 cm土层。组间同层分析表明, 0—10 cm土层WW的细菌多样性明显高于Wck; 10—20 cm土层Wck的细菌丰富度明显高于WW。李钧敏等人的研究也表明土壤微生物的多样性随土壤深度增加会有显著变化[51], 与本实验一致。 青海湖河源湿地的细菌优势菌门为变形菌门、酸杆菌门、放线菌门、厚壁菌门, 相对丰度之和为80.23%; 真菌优势菌门为子囊菌门、担子菌门, 总相对丰度达到了78.75%。温度上升改变了土壤微生物的群落结构及多样性, 对不同土层的细菌群落影响明显。OTC增温条件下, 细菌菌群的相对丰度整体呈上升趋势, 真菌菌群中Hypocreales目的相对丰度显著升高。土壤细菌及真菌群落的丰富度指数下降, 多样性指数上升。表明增温降低了土壤微生物丰富度, 增加了微生物群落多样性。但增温对不同土层微生物的影响主要是对细菌菌群群落的影响, 其群落结构中10—20 cm土层的三个细菌主要菌群, 即Actinobacteria门、Gemmatimonadetes门和Nitrospirae门相对丰度显著升高, Firmicutes门这一主要菌群相对丰度显著降低; 不同土层的细菌群落多样性均有变化, 0—10 cm土层细菌群落多样性显著增高, 10—20 cm土层的细菌群落丰富度显著降低。 [1] MELIANI A, BENSOLTANE A, MEDERBEL K. Microbial diversity and abundance in soil: related to plant and soil type[J]. American Journal of Plant Nutrition and Fertilization Technology, 2012, 2(1): 10–18. [2] SRIVASTAVA D, KAPOOR R, SRIVASTAVA S K, et al. Vesicular arbuscular mycorrhiza-an overview[M]. Springer, Dordrecht, 1996. [3] DODD J C, BODDINGTON C L, RODRIGUEZ A, et al. Mycelium of arbuscular mycorrhizal fungi (AMF) from different genera: form, function and detection[J]. Plant and Soil, 2000, 226(2): 131–151. [4] CHAUHAN A, OGRAM A, REDDY K R. Syntrophic- methanogenic associations along a nutrient gradient in the Florida Everglades[J]. Applied and Environmental Microbiology, 2004, 70(6): 3475–3484. [5] MITSCH W J, GOSSELINK J G. Wetlands, 4th ed[M]. John Wiley & Sons, 2007. [6] 孙志高, 刘景双, 李彬. 中国湿地资源的现状、问题与可持续利用对策[J]. 干旱区资源与环境, 2006, 20(2): 83–88. [7] 胡胜杰, 牛振国, 张海英, 等. 中国潜在湿地分布的模拟[J].科学通报, 2015, 60(33): 3251–3263. [8] 柯善北. 顶层设计为“地球之肾”撑起制度保护伞《湿地保护修复制度方案》解读[J]. 中华建设, 2017, (7): 36–37 [9] 邢宇, 姜琦刚, 李文庆, 等. 青藏高原湿地景观空间格局的变化[J]. 生态环境学报, 2009, 18(3): 1010–1015. [10] 闫立娟, 齐文. 青藏高原湖泊遥感信息提取及湖面动态变化趋势研究[J]. 地球学报, 2012, 33(1): 65–74. [11] 白军红, 欧阳华, 徐惠风, 等. 青藏高原湿地研究进展[J].地理科学进展, 2004, 23(4): 1–9. [12] 李成秀, 李小雁, 杨太保, 等. 青海湖流域沙柳河草甸群落结构与数量特征[J]. 干旱区研究, 2013, 30(6): 1028–1035. [13] IPCC. Climate change 2013: the physical science basis: contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change [M]. Cambridge: Cambridge University Press, 2013. [14] OWEN R K, WEBB E B, HAUKOS D A, et al. Projected climate and land use changes drive plant community composition in agricultural wetlands[J]. Environmental and Experimental Botany, 2020, 175: 104039. [15] Wang X, Luo B, Wang L, et al. Plant diversity improves the effluent quality and stability of floating constructed wetlands under increased ammonium/nitrate ratio in influent[J]. Journal of Environmental Management, 2020, 266: 110607. [16] 朱慧兰, 刘梦迪, 周宇鸿, 等. 深圳湾福田红树林湿地小型底栖动物群落结构及海洋线虫新纪录种[J].生态学杂志, 2020, 39(6): 1806–1812. [17] BROTHERTON S, JOYCE C B, SCHARLEMANN J P W. Global offtake of wild animals from wetlands: critical issues for fish and birds[J]. Hydrobiologia, 2020, doi: 10.1007/s10750-020-04188-z. [18] 王琰, 童春富, 汤琳, 等. 崇明东滩盐沼湿地大型底栖动物功能群分布特征及其影响因子[J]. 生态学杂志, 2020, 39(3): 880–892. [19] 赵先丽, 周广胜, 周莉, 等. 盘锦芦苇湿地土壤微生物初步研究[J]. 气象与环境学报, 2007, (1): 30–33. [20] MA L, LIU S N, DING X H, et al. Seasonal dynamics of soil microorganism in Zhalong reed wetland[C]. Trans Tech Publications Ltd, 2011. [21] SHENGUI L I. Study of Wetland Plant Rhizosphere Microorganism in the Treatment of Sanitary Wastewater[J]. Industrial Safety and Environmental Protection, 2010, (11): 6. [22] 徐香勤, 蔡文倩, 王艳, 等. 天津市典型湖库湿地生态完整性评价[J]. 应用生态学报, 2020, 31(8): 2767–2774. [23] 赵衡, 闫旭, 王富强, 等. 基于PSR模型的三门峡库区湿地生态系统健康评价[J]. 水资源保护, 2020, 36(4): 21–25. [24] 朱金峰, 周艺, 王世新, 等. 白洋淀湿地生态功能评价及分区[J]. 生态学报, 2020, 40(2): 459–472. [25] 舒俭民, 杜加强, 孟晓杰, 等. 牡丹江支流河源湿地环境特征与服务功能研究[J]. 水生态学杂志, 2009, 30(6): 62–66. [26] SHU J, DU J, MENG X, et al. Study on the Wetland Ecosystem Functions and the Characteristics of Surrounding Environment in Bayou Headwater Wetland of the Mudan River[J]. Journal of Hydroecology, 2009, (6): 13. [27] TANG C. Ecohydrological Assessments on Nitrogen Behavior in the Headwater Wetland[M]. Springer, Tokyo, 2014. [28] CHEN M, CAO J J, WU G L, et al. Preliminary estimation of service values of Maqu wetland ecosystem in the head water areas of the Yellow River[J]. Pratacultural Science, 2010, 27(5): 10–14. [29] LIU J, JIA X, YAN W, et al. Changes in soil microbial community structure during long‐term secondary succession[J]. Land Degradation & Development, 2020, 31(9): 1151–1166. [30] SEKARAN U, SANDHU S S, QIU Y, et al. Biochar and manure addition influenced soil microbial community structure and enzymatic activities at eroded and depositional landscape positions[J]. Land Degradation & Development, 2020, 31(7): 894–908. [31] MAGOC T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957–2963. [32] BOLGER A M, LONSE M, USADEL B. Trimmomatic: a flexible trimmer for Illumina sequence data[J]. Bioinformatics, 2014, 30(15): 2114–2120. [33] EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194–2200. [34] WANG Y, SHENG H F, HE Y, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags[J]. Applied and environmental microbiology, 2012, 78(23): 8264–8271. [35] SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and environmental microbiology, 2009, 75(23): 7537–7541. [36] PAPATHEODOROU E M, ARGYROPOULOU M D, STAMOU G P. The effects of large-and small-scale differences in soil temperature and moisture on bacterial functional diversity and the community of bacterivorous nematodes[J]. Applied Soil Ecology, 2004, 25(1): 37–49. [37] 谌佳伟, 葛继稳, 冯亮, 等. 神农架大九湖泥炭湿地甲烷通量特征及其与土壤微生物群落组成的关系[J]. 地球科学, 2020, 45(3): 1082–1092. [38] LI H, CHI Z, LI J, et al. Bacterial community structure and function in soils from tidal freshwater wetlands in a Chinese delta: potential impacts of salinity and nutrient[J]. Science of The Total Environment, 2019, 696: 134029. [39] 于少鹏, 史传奇, 胡宝忠, 等. 古大湖湿地盐碱土壤微生物群落结构及多样性分析[J]. 生态学报, 2020, 40(11): 3764–3775. [40] 熊金波. 青藏高原短期增温实验引起土壤细菌群落的快速响应[C]//中国土壤学会. 面向未来的土壤科学(中册)—中国土壤学会第十二次全国会员代表大会暨第九届海峡两岸土壤肥料学术交流研讨会论文集, 2012. [41] DEANGELIS K M, POLD G, TOPCUOGLU B D, et al. Long-term forest soil warming alters microbial communities in temperate forest soils[J]. Frontiers in microbiology, 2015, 6: 104. [42] RINNAN R, MICHELSEN A, BAATH E, et al. Fifteen years of climate change manipulations alter soil microbial communities in a subarctic heath ecosystem[J]. Global Change Biology, 2007, 13(1): 28–39. [43] ALLISON S D, TRESEDER K K. Warming and drying suppress microbial activity and carbon cycling in boreal forest soils[J]. Global change biology, 2008, 14(12): 2898–2909. [44] SCHINDLBACHER A, RODLER A, KUFFNER M, et al. Experimental warming effects on the microbial community of a temperate mountain forest soil[J]. Soil Biology and Biochemistry, 2011, 43(7): 1417–1425. [45] FIERER N, SCHIMEL J P, HOLDEN P A. Variations in microbial community composition through two soil depth profiles[J]. Soil Biology and Biochemistry, 2003, 35(1): 167–176. [46] 夏北成, ZHOU J, TIEDIE J M. 土壤细菌类克隆群落及其结构的生态学特征[J]. 生态学报, 2001, 21(4): 574–578. [47] 赵建琪, 吴建平, 张慧玲, 等. 增温对南亚热带季风常绿阔叶林土壤微生物群落的影响[J]. 生态环境学报, 2019, 28(5): 881–889. [48] SHADE A, PETER H, ALLISON S D, et al. Fundamentals of microbial community resistance and resilience[J]. Frontiers in microbiology, 2012, 3: 417. [49] ZOGG G P, ZAK D R, RINGELBERG D B, et al. Compositional and functional shifts in microbial communities due to soil warming[J]. Soil Science Society of America Journal, 1997, 61(2): 475–481. [50] YU C, HAN F, FU G. Effects of 7 years experimental warming on soil bacterial and fungal community structure in the Northern Tibet alpine meadow at three elevations[J]. Science of the Total Environment, 2019, 655: 814–822. [51] 李钧敏, 金则新, 张崇邦. 不同土层土壤细菌的遗传多样性及其与环境因子的相关性[J]. 浙江大学学报(理学版), 2006, 33(6): 695–701. Effects of simulated warming on soil microorganisms community characteristics in source wetland of qinghai lake ZHANG Ni1,2, YANG Yang1,2, CHEN Kelong2,3,* 1. College of Life Science Qinghai Normal University, Xining 810008, China 2. Qinghai Key Laboratory of Physical Geography and Environmental Processes, Xining 810008, China 3. Science and Technology Department, Qinghai Normal University, Xining 810008, China Wetland ecosystems play an important role in biodiversity conservation, but different wetland ecosystems have different functions, and soil microbes play an important role in wetland ecosystems. However, few studies have been carried out on soil microbial communities in source wetland. In the context of global warming, in order to explore the impact of temperature rise on soil microorganisms in source wetland, high-throughput sequencing method was used in this experiment to further understand the community structure and diversity changes of soil bacteria and fungi after simulated warming. The dominant flora were Proteobacteria, Acidobacteria, Actinomycetes and Firmicutes, and the dominant flora were Ascomycetes and Basidiomycetes. Compared with the fungal community, the bacterial community showed a more obvious response to the increase in soil temperature. The relative abundance of the bacterial community was increasing, and the relative abundance of the fungal community was only significantly increased in Hypocreales. The richness of soil bacteria and fungi community decreased, while the community diversity increased. Temperature increase affects the community structure and diversity of soil bacteria and fungi, and the bacterial community is more sensitive to soil temperature increase. source wetland; warming; soil microbe; high-throughput sequencing 章妮, 杨阳, 陈克龙. 模拟增温对青海湖河源湿地土壤微生物群落特征的影响[J]. 生态科学, 2022, 41(5): 46–54. ZHANG Ni, YANG Yang, CHEN Kelong. Effects of simulated warming on soil microorganisms community characteristics in source wetland of qinghai lake[J]. Ecological Science, 2022, 41(5): 46–54. 10.14108/j.cnki.1008-8873.2022.05.006 Q938.1+1 A 1008-8873(2022)05-046-09 2020-07-12; 2020-08-05 国家自然科学基金项目(41661023); 国家科技支撑计划项目(2017YFC0403601); 第二次青藏高原综合科学考察研究(2019QZKK0405); 青海省科技厅项目(2017-ZJ-782) 章妮(1997—), 女, 湖北荆州人, 硕士研究生, 主要从事湿地生态学研究, E-mail:1581146264@qq.com 陈克龙, 男, 二级教授, 博士生导师, 主要从事生物地理与湿地生态研究, E-mail:ckl7813@163.com
3.4 不同土层土壤微生物群落特征变化


3.5 组间差异性分析

4 讨论
5 结论
