精神分裂症患者不同时期血清细胞因子水平及肠道菌群宏基因组学研究
2022-08-04郜见亮张爱国姚理慧陈苑苑张许来
郜见亮, 张爱国,姚理慧 ,陈苑苑 , 程 鹏 ,苏 虹, 张许来,2
精神分裂症是一组病因、临床表现、治疗反应及病程不同的疾病。多起病于青壮年,疾病对患者的影响通常严重而持续[1]。研究[2]表明精神分裂症存在免疫异常,炎症因子的水平发生变化。但在疾病不同时期炎症因子水平是否具有差异,不同时期炎症因子水平与疾病临床症状之间的病理生理机制尚不明确。另有研究表明,肠道菌群的失调与抑郁[3]、焦虑[4]以及精神分裂症[5]有关。该研究比较了精神分裂症急性期和缓解期患者的血清细胞因子水平,以及其与疾病症状之间的相关性;通过MetaGeneMark进行基因预测,对比精神分裂症急性发作期和缓解期肠道菌群的变化。
1 材料与方法
1.1 病例资料纳入2018年6月—2019年12月安徽省精神卫生中心(合肥市第四人民医院)精神分裂症住院患者80例,其中急性期患者(急性组)40例,缓解期患者(缓解组)40例。入组标准:① 患者及其家属知情并自愿签署知情同意书;② 年龄20~60岁,符合《ICD-10精神与行为障碍分类》精神分裂症诊断标准;③ 抗精神病药物治疗方案符合遵守精神分裂症诊疗规范;④ 急性组:入院后PANSS评分≥60分;缓解组:经规范治疗后,PANSS评分<60分。排除标准:① 患有颅脑外伤、神经系统疾病及其他慢性躯体疾病,如高血压、糖尿病;② I级亲属有精神疾病史;③ 有酒精、尼古丁其它精神活性物质依赖史;④ 妊娠期或哺乳期女性患者;⑤ 合并恶性肿瘤、自身免疫学疾病等或肠道感染性疾病治愈未超过3个月;⑥ 入组前接受电抽搐治疗;⑦ 近三个月有抗生素、糖皮质激素、益生菌制剂及其他免疫抑制剂使用史。本研究经安徽省精神卫生中心伦理委员会批准(批号: HSY-IRB-PJ-JZB-001)。
1.2 方法
1.2.1一般资料 收集研究对象一般人口学资料,包括:年龄、性别、住址、文化程度、体质量、家族史、饮食习惯等。
1.2.2PANSS量表[6]评定 首先对培训人员进行一致性培训,后由2名主治及以上职称的专科医师,采用PANSS量表对精神分裂症患者的症状进行评估,得出总分和因子分。因子分包括阳性因子条目,阴性因子条目,认知因子条目,兴奋因子条目,抑郁因子条目。
1.2.3血液样本采集及检测 每名受试者空腹早晨 7 ∶00 左右,由专人采集静脉血样本(~5 ml)。后送至检验科,以3 000 r/min的转速离心5 min。分析前,血清样本储存在-80 ℃下。使用超敏电化学发光分析技术(Meso Scale Discovery)方法以测量血清炎症的生物标志物水平(IL-6,IL-8,IL-10,IL-17,IL-23和TNF-α)。完成后集中送至专业公司采用超敏电化学发光分析技术方法进行检验上述炎性因子水平。Meso Scale Discovery方法介绍:超敏电化学发光分析技术(Meso Scale Discovery)灵敏度可0.05 pg/ml,有效线性范围达6 log。
1.2.4粪便标本采集 在患者入组1周内要求研究对象在早上使用无菌粪便干燥盒收集粪便标本,密封、编号,粪便样本放入有冰袋的保温盒中,尽快送置-80 ℃冰箱保存。
1.2.5粪便标本DNA 提取 采用德国Qinagen公司的 QIAamP DNA试剂盒,严格按照产品操作说明书进行操作,按一定的生物保护程序,在安全柜中提取样本总DNA。通过AgencourtAMPureXP-Mediumki软件选择片段,保证样品的条带能集中在300~400 bp左右,进行文库检测后,通过预设的联合探针锚定聚合技术进行上机测序。
1.2.6测序数据处理 由专业的生物检测公司检测处理,并出具报告。
1.2.7宏基因组 采取Denovo套装、预测基因及基因集构建,使用预定组装的软件MEGAHIT对样品进行Denovo的组 装。依据MetaGeneMark和CD-Hit程序完成对基因测序和基因构建,再后来利用MEGAN进行所需的物种注释和代谢的丰度统计。
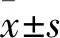
2 结果
2.1 一般资料分析该研究总共纳入分裂症的急性期患者(急性组)和缓解期患者(缓解组)各40例。急性组性别为男性19例,女性21例,平均年龄为(32.93±9.44)岁,BMI为(23.80±3.55)kg/m2;缓解组男性22例,女性18例,平均年龄为(32.05±7.83)岁,BMI为(24.79±1.80) kg/m2;两组间性别组成、年龄和BMI差异均无统计学意义(χ2=0.05,P=0.856;Z=-0.169,P=0.871;t=-1.571,P=0.122)。
2.2 两组血清细胞因子水平的比较急性组清IL-6 (t=8.988,P<0.001)、IL-10 (Z=-3.551,P<0.001)、IL-17(Z=-6.038,P<0.001)、IL-23 (Z=-5.138,P<0.001)和TNF-α (Z=-6.928,P<0.001)浓度均明显高于缓解组,两组结果分析有统计学意义(P<0.05)。见表1。
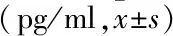
表1 2组血清细胞因子水平比较
2.3 急性组PANSS各因子与细胞因子水平的相关性分析Pearson相关分析显示,急性组患者的阳性因子分与IL-17和TNF-α水平呈负相关(P<0.05);阴性因子分与IL-23水平呈正相关(P<0.05);认知因子分与IL-6水平呈正相关(P<0.05);PANSS总分与IL-23水平呈正相关(P<0.05)。见表2。
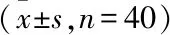
表2 急性组细胞因子与PANSS各因子分的相关性
2.4 缓解组PANSS各因子与细胞因子水平的相关性分析Pearson相关分析显示,缓解组患者的细胞因子水平与PANSS各因子分及总分均无明显相关性。见表3。
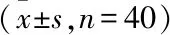
表3 缓解组细胞因子与PANSS各因子分的相关性
2.5 急性期和缓解期患者肠道菌群基因多样性及物种差异通过对两组符合检测要求的粪便样本进行肠道菌群宏基因分析,共预测了1 321 604个基因(图1A)。AlPha的多样性分析(图1B)显示微生物多样性急性组指数(shannon)低于缓解组;Beta的多样性(图1C)分析两组表明微生物物种的差异组成具有统计学意义(P<0.05);排名前30的研究差异物种StamPPlot展图(图2)表明:急性组拟杆菌属和埃希氏杆菌属丰度较缓解组升高(P<0.05),而乳酸菌属、普氏菌属丰度较缓解组降低(P<0.05);缓解组的粪杆菌属丰度升高(P<0.05)。
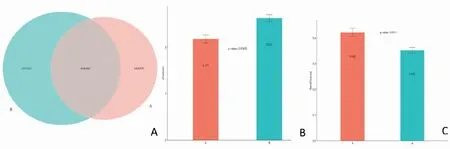
图1 2组粪便样本的肠道菌群宏基因分析红色:急性组;蓝色:缓解组;A:肠道菌群宏基因预测量;B:Alpha的多样性分析;C:Beta的多样性分析
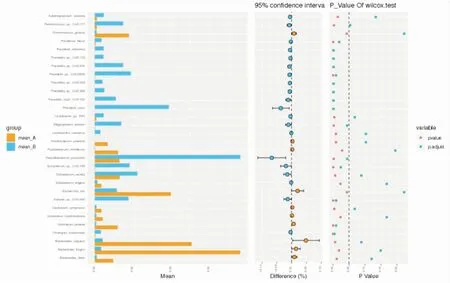
图2 2组粪便样本排名前30肠道菌群丰度比较棕色:急性组;蓝色:缓解组
3 讨论
目前有多项研究[2,8-10]证实精神分裂症患者存在免疫学异常。该研究发现精神分裂症急性期患者的血清IL-6、IL-10、IL-17、 IL-23和TNF-α浓度均高于缓解期患者(P<0.01),与UPthegrove et al[2]的报告结果不完全一致,后者发现急性期精神分裂症患者血清炎症因子浓度升高的有IL-6、 IL-1β、 TNF-α、和IFN-γ,浓度降低只有IL-10。造成这种差异的原因可能是精神分裂症各亚型之间的免疫学异常存在差异。该研究还显示分裂症急性期细胞因子水平与患者临床症状存在相关性,该结果提示炎症性反应参与了精神分裂症的发病,并影响了精神分裂症的严重程度。
Miller et al[8]和冯 薇等[9]发现精神分裂症患者外周血IL-6水平与治疗前后PANSS总分和病程之间存在正相关。该研究结果显示精神分裂症急性期患者IL-17和TNF-α水平与PANSS量表阳性因子得分与TNF-α和IL-17呈负相关;IL-23水平与阴性因子分呈正相关,与总分呈正相关,IL-6水平与认知因子分呈正相关。这与以上研究结论有一致性,但是该研究所测定的炎症因子种类与上述研究不同,故结果不尽相同。总体来说,临床上的药物治疗可以降低轻患者的炎症水平,急性期患者细胞因子水平与症状存在一定相关性。
有研究[10-11]表明:服用益生菌补充剂,精神分裂症患者的PANSS得分降低,提示改变肠道微生物的结构,可能会对精神分裂症的治疗效果产生影响。黄 侠等[12]发现精神分裂症患者较正常人群肠道菌群结构特征发生了明显的变化。本研究结果表明急性发作期的精神分裂症患者样本内微生物丰度明显低于缓解期,两组之间微生物物种组成存在差异。本研究还显示:急性发作期精神分裂症患者拟杆菌属、普氏菌属和埃希氏杆菌属物种丰度高于缓解期。与张言武等[13]的研究结果一致。另外,本研究表明精神分裂症急性期患者乳酸菌菌属丰度较缓解期明显降低,而有研究[14-15]显示:精神分裂症患者乳酸菌丰度明显升高,且与临床症状严重程度有关。造成这种差异的原因可能是研究方法不同、样本量大小差异、饮食结构差异等。
综上所述,本研究结果提示分裂症患者可能存在免疫功能的异常,且炎症因子的水平与疾病严重程度有关。同时也发现了该类患者存在肠道菌群的紊乱。细胞因子的种类很多,本研究仅选择了5种细胞因子,另外,该研究结果仅观察到患有分裂症疾病者肠道菌群存在异常。精神分裂症炎症水平的异常与肠道菌群的变化是否存在相关性,以及肠道菌群紊乱是如何对精神分裂症的发病产生影响的,需要纳入更多的样本,更深入的研究去探讨。
