猕猴下丘脑-垂体-肾上腺轴组织结构学特征观察
2022-08-04董婷玉郭梦慧许昌勇蒋海峰刘潇一严尚学
董婷玉,郭梦慧,许昌勇,蒋海峰,张 磊,许 振,刘潇一,严尚学,常 艳,魏 伟
下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPAA)由下丘脑、垂体、肾上腺组成,调节机体能量代谢,维护内环境[1]。生理应激时,下丘脑分泌促肾上腺皮质激素释放激素(corticotrophin releasing hormone,CRH),促进垂体释放促肾上腺皮质激素(adrenocorticotropic hormone,ACTH),使肾上腺分泌糖皮质激素(glucocorticoid,GC),GC又负反馈作用于下丘脑和垂体[2]。HPAA异常时,体内稳态失衡,如自身免疫病患者长期使用GC,肾上腺皮质功能不全,皮质醇缺乏,炎症加重[3]。库欣综合征表现为HPAA亢进,皮质醇分泌过多,诱发骨质疏松和感染[4]。治疗此类疾病多为恢复HPAA功能,因此对HPAA生理及病理反应研究尤为重要。目前对HPAA的研究集中于啮齿动物[5]或临床病例分析[6],也有对麋鹿[7]、水牛[8]、树齁[9]等动物HPAA部分组织病理的特征观察,对非人灵长类HPAA全面系统性的组织结构特点却鲜有报道。与其他动物相比,非人灵长类具有与人类相近的基因序列和神经解剖结构,是进行脑部研究最理想的实验动物[10]。本研究探讨了猕猴HPAA几种病理切片的制作方法,对组织结构做了详细描述,为更好的模拟人类HPAA生理和病理特征提供了技术方法。
1 材料与方法
1.1 实验动物清洁级实验猕猴(雄性,年龄3~5岁),由旌德县皖南猕猴驯养繁殖基地提供[SCXK(皖)2020-001],饲养于安徽医科大学临床药理研究所普通级猴饲养中心,湿度:(40~70)%;温度:(21~26)℃;7:00 am~7:00 pm光照,自由摄取维持饲料和水,额外补充瓜、果、蔬、蛋、奶等食物来满足猕猴的营养需要,严格按照动物伦理福利规定的标准开展实验。所有实验方案均经安徽医科大学临床药理研究所动物伦理委员会审查批准同意(批号:PT-2020-001)。
1.2 实验试剂注射用盐酸替来他明盐酸唑拉西泮(舒泰50)购自上海维克有限公司(批号:200826 12C BN 82T7A)安徽公司;DAPI染色液、Triton-X、EDTA抗原修复液购自北京Solarbio公司;DAB显色试剂盒、通用型试剂盒(小鼠/兔聚合物法检测系统)购自北京中杉金桥生物技术有限公司;苏木精染液、HE染液套装、抗荧光淬灭剂购自武汉Servicebio公司;兔抗CRH抗体、小鼠抗ACTH抗体、兔抗MAP2抗体购自美国Proteintech公司;兔抗GR抗体、兔抗ACTH-R抗体、兔抗CRFR1抗体购自美国Immunoway公司;兔抗iba-1抗体购自日本Wako公司;荧光标记山羊抗小鼠IgG AF 488购自武汉Elabscience Biotechnology公司;荧光标记山羊抗兔IgG AF 594购自美国Jackson公司。
1.3 实验仪器组织脱水机购于湖北康龙电子科技有限责任公司;组织摊烤片机、包埋机购于湖北亚光医用电子技术有限公司;石蜡切片机、冰冻切片机购于Thermo Scientific公司;脱色摇床购于武汉Servicebio公司;恒温烘箱购于上海福玛实验设备有限公司;微波炉购于广东Galanz公司;正置荧光显微镜、激光共聚焦显微镜、全自动免疫组化染色仪购于德国Leica公司。
1.4 猕猴下丘脑-垂体-肾上腺组织取材与保存在猕猴情绪平稳的状态下,按6 mg/kg肌肉注射盐酸替来他明盐酸唑拉西泮至深度麻醉,采用股动脉放血进行安乐死。在解剖台上分离躯干和头颅,去除头部皮肤和附着肌肉,用电锯从眉骨、颞骨、枕骨上方环状锯开,揭开颅顶骨和软脑膜,暴露并剥离出大脑,冰上迅速取出下丘脑(图1A),从垂体窝中挑出垂体(图1B),同时打开腹部,于肝肾之间取出左、右肾上腺(图1C),固定于预冷4%多聚甲醛溶液(PFA)中。
1.5 猕猴下丘脑-垂体-肾上腺组织石蜡切片制作新鲜组织用4% PFA固定24 h以上,修剪目标组织,放入自动脱水机:70%、80%、90%、95%、100% Ⅰ、100%Ⅱ 乙醇各1 h,二甲苯Ⅰ、Ⅱ、Ⅲ 各30 min,55 ℃融化石蜡Ⅰ、Ⅱ、Ⅲ各1 h。从脱水盒内取出组织放入包埋框内,-20 ℃冷却凝固,修齐表面后用切片机切片,厚4 μm,于摊片机40 ℃温水上摊平,载玻片捞片,烘箱60 ℃烤干取出,室温保存。
1.6 猕猴下丘脑组织冰冻切片制作4 ℃冰箱内,新鲜组织用4% PFA固定24 h以上,转入20%蔗糖溶液,沉底后换30%蔗糖溶液,再次沉底即可。脱水完成后取出,修齐组织,用OCT包埋剂将组织固定在样本托上速冻,待OCT变白变硬即可进行切片。先粗切修齐组织面,再细切,厚度8~10 μm,粘附载玻片贴切片,-20 ℃保存。
1.7 猕猴下丘脑-垂体-肾上腺组织苏木精-伊红(hematoxylin-eosin staining,HE)染色石蜡切片首先经60 ℃烘至蜡融化,而后二甲苯I、II各20 min,100%I、100%II、95%、85%、75%乙醇各5 min,流水冲洗进行脱蜡;苏木精染色5~10 min,分化液分化20 s,返蓝5 min,流水冲洗后85%、95%酒精各5 min,行伊红染色3 min;最后经75%、85%、95%、100%Ⅰ、100%Ⅱ乙醇各5 min,二甲苯Ⅰ、Ⅱ各20 min脱水,中性树胶封片。
1.8 猕猴下丘脑-垂体-肾上腺免疫组织化学染色石蜡切片脱蜡后,经0.5% Triton-X室温30 min通透;用沸腾的EDTA抗原修复液余温修复切片10 min;内源性过氧化物酶阻断剂室温避光10 min;5% BSA室温封闭1 h;滴加稀释后的一抗:CRH、ACTH、CRFR1(1 ∶100);ACTH-R(1 ∶200);GR(1 ∶50),湿盒内4 ℃过夜;次日拿出切片复温,洗去一抗,滴加与一抗相应种属的二抗,室温20 min;滴加新配制的DAB显色液,镜下控制显色时间,流水冲洗终止显色;苏木素染色20 s,分化,返蓝,流水冲洗后脱水封片。
1.9 猕猴下丘脑组织石蜡切片免疫荧光染色切片同上述方法脱蜡、通透、抗原修复、封闭后,滴加稀释的一抗:iba-1(1 ∶500)、MAP2(1 ∶100),湿盒4 ℃过夜;第二日拿出切片复温,洗去一抗,滴加与一抗相应种属的荧光二抗,室温避光1 h后DAPI染液室温避光10 min染细胞核;自发荧光淬灭剂室温避光5 min;抗荧光淬灭封片剂封片,盖玻片四角用中性树胶固定,4 ℃避光保存。切片于激光共聚焦显微镜下观察采集图像。
1.10 猕猴下丘脑组织冰冻切片免疫荧光染色冰冻切片于37 ℃ 、(10~20) min,4% PFA固定30 min后,用5% BSA和0.5% Triton-X混合液室温封闭通透1 h;而后同上述1.9的方法进行一抗、二抗敷育、DAPI染核、淬灭组织荧光、封片、镜检。
2 结果
2.1 猕猴下丘脑、垂体、肾上腺组织解剖形态学观察从脑底面观,下丘脑位于丘脑沟以下,前方是视交叉,呈现中空漏斗状,重量约为2 g,主要包括乳头体、结节部和视上部(图1A、B)。揭开全脑,断开视交叉,可见垂体陷于颅骨蝶鞍垂体窝内,剥离硬脑膜,挑出垂体,形似直径5 mm的碗豆状结构(图1C、D)。肾上腺左右各一,位于两侧肾脏的上方,被肾筋膜和脂肪组织所包裹,左肾上腺稍大,如半月形,右肾上腺稍短,为锥形(图1E、F)。
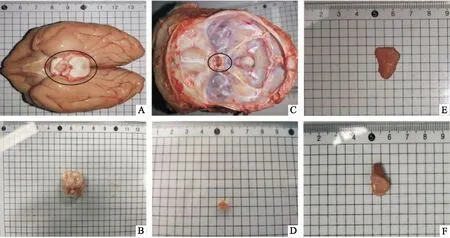
图1 猕猴下丘脑、垂体、肾上腺组织解剖形态学
2.2 猕猴下丘脑、垂体、肾上腺组织病理切片HE染色
2.2.1下丘脑组织病理切片HE染色 主要分布着神经元细胞和小胶质细胞(图2B▲),正常神经元胞体呈锥形,核大居中,胞质中均匀分布强碱性尼氏体(图2B黑色箭头),深色神经元即坏死神经元,细胞核固缩,胞体缩小变形,尼氏体消失不见,被增生的胶质细胞吞噬(图2C白色箭头)。
2.2.2垂体组织病理切片HE染色 由腺垂体(anterior lobe)和神经垂体(posterior lobe,PL)组成,两部分之间界限清楚,腺垂体又可分为远侧部(pars distalis,PD)和中间部(pars intermedia,PI)(图2D);远侧部主要分布着嫌色细胞(图2E黑色箭头)、嗜酸性细胞(图2E白色箭头)及嗜碱性细胞(图2E▲),细胞集合成团索状;中间部(图2F*)是位于远侧部与神经垂体之间的狭窄部分,主要分布嗜碱性细胞和嫌色细胞;神经垂体主要由无髓神经纤维和神经胶质细胞组成,也纵横毛细血管,高倍镜下神经垂体内的嗜酸性团块为神经轴突内的分泌物,称为赫令体(图2G黑色箭头)。
2.2.3肾上腺组织病理切片HE染色 由周边皮质和中央髓质(medulla,M)构成,表面包以结缔组织被膜(capsule,C),皮质由外向内分别为球状带(zona glomerulosa,ZG)、束状带(zona fasciculata,ZF)和网状带(zona reticularis,ZR)(图2H);球状带较薄,细胞为卵圆形,胞质少,核深染呈球形,细胞排列成球状,团块或拱形(图2I)。束状带位于球状带深面,是皮质中最厚的部分,细胞大,多边形,部分有双核,核圆形,染色淡,胞质有嗜酸性大脂滴,细胞排列成束,呈放射状伸向髓质(图2J);网状带细胞相互排列成网,胞浆少,内含脂褐素和脂滴,核深染(图2K);髓质由排列成团的髓质细胞、结缔组织和大量血窦组成,胞体较大,呈卵圆形(图2L)。
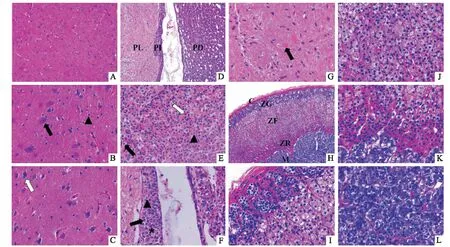
图2 猕猴下丘脑、垂体、肾上腺组织HE染色图
2.3 猕猴下丘脑、垂体、肾上腺免疫组织化学染色
2.3.1下丘脑组织病理切片免疫组化染色 图3A是对下丘脑区域分泌的CRH进行免疫组化染色,可见下丘脑室旁核神经元胞质有棕黄色阳染;对CRH分泌起负反馈调节作用的糖皮质激素受体(GR)多表达在细胞质中,也有部分表达于细胞核,图3B神经元胞核中GR阳性颗粒明显。
2.3.2垂体组织病理切片免疫组化染色 腺垂体合成释放ACTH,图3C中垂体嗜碱性细胞质中充盈着阳染的ACTH黄色颗粒;接受下丘脑释放的CRH的CRHR1表达于胞膜(图3D);GR主要位于垂体中间部细胞核和细胞质中(图3E)。
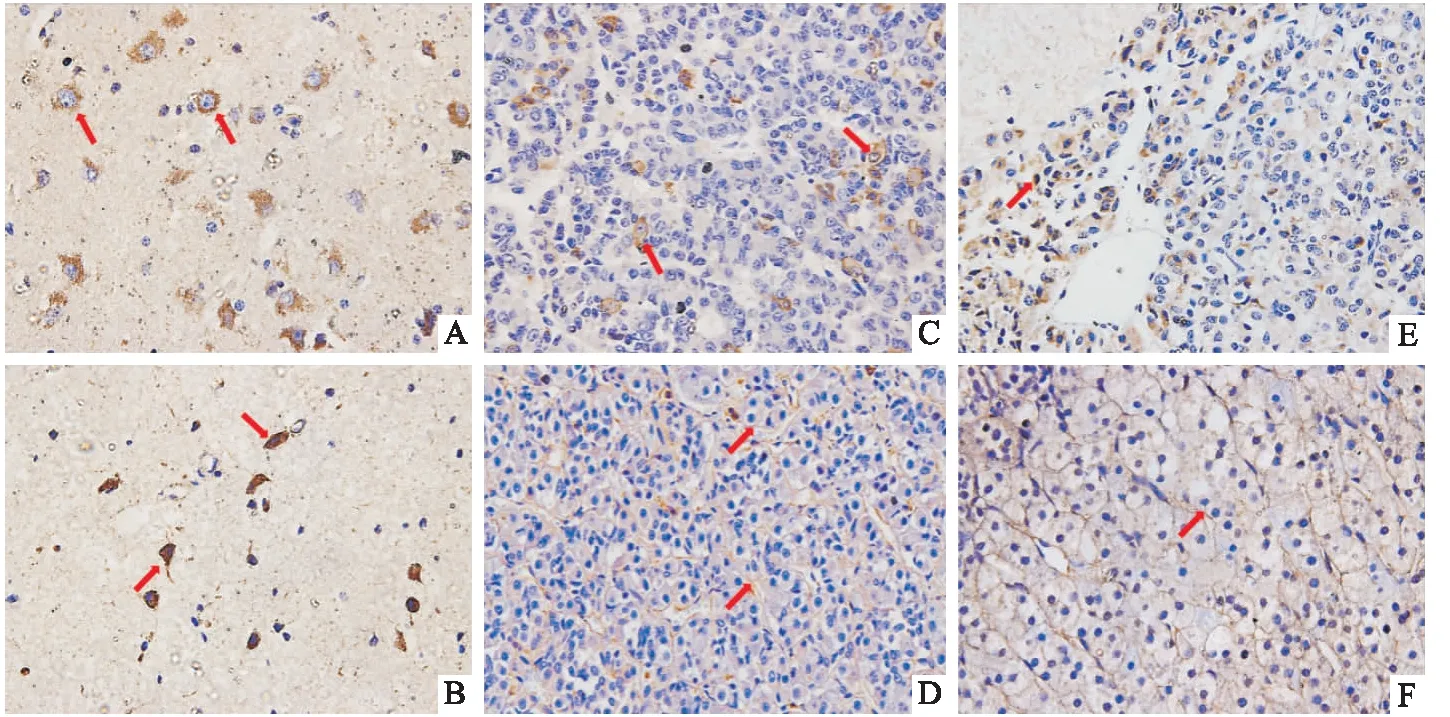
图3 猕猴下丘脑、垂体、肾上腺免疫组织化学染色图 ×400A:下丘脑CRH染色;B:下丘脑GR染色;C:垂体ACTH染色;D:垂体CRHR1染色;E:垂体GR染色;F:肾上腺ACTHR染色
2.3.3肾上腺组织病理切片免疫组化染色 腺垂体释放的ACTH与肾上腺皮质束状带细胞上的ACTHR结合,如图3F所示,ACTHR表达于胞膜上。
2.4 猕猴下丘脑免疫荧光染色图4、图5是对猕猴下丘脑区域离子钙接头蛋白1(ionized calcium binding adapter molecule 1,iba-1)和微管相关蛋白2(microtubule associated protein 2,MAP2)进行免疫荧光染色。从merge图上可以清楚的观察到iba-1在小胶质细胞核中表达,MAP2在神经元胞质中表达。通过比较冰冻切片和石蜡切片的荧光染色效果,可以看出,脑组织石蜡切片在经过脱水脱蜡等步骤后,组织中抗原的性质易受到破坏,且操作过程较繁琐,染片背景较深较杂,出现较多的非特异性染色,反观冰冻切片染色图,背景清晰明亮,细胞形态结构易于辨认,效果优于石蜡切片。
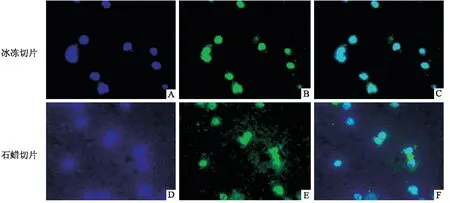
图4 猕猴下丘脑iba-1免疫荧光染色图 ×1 000
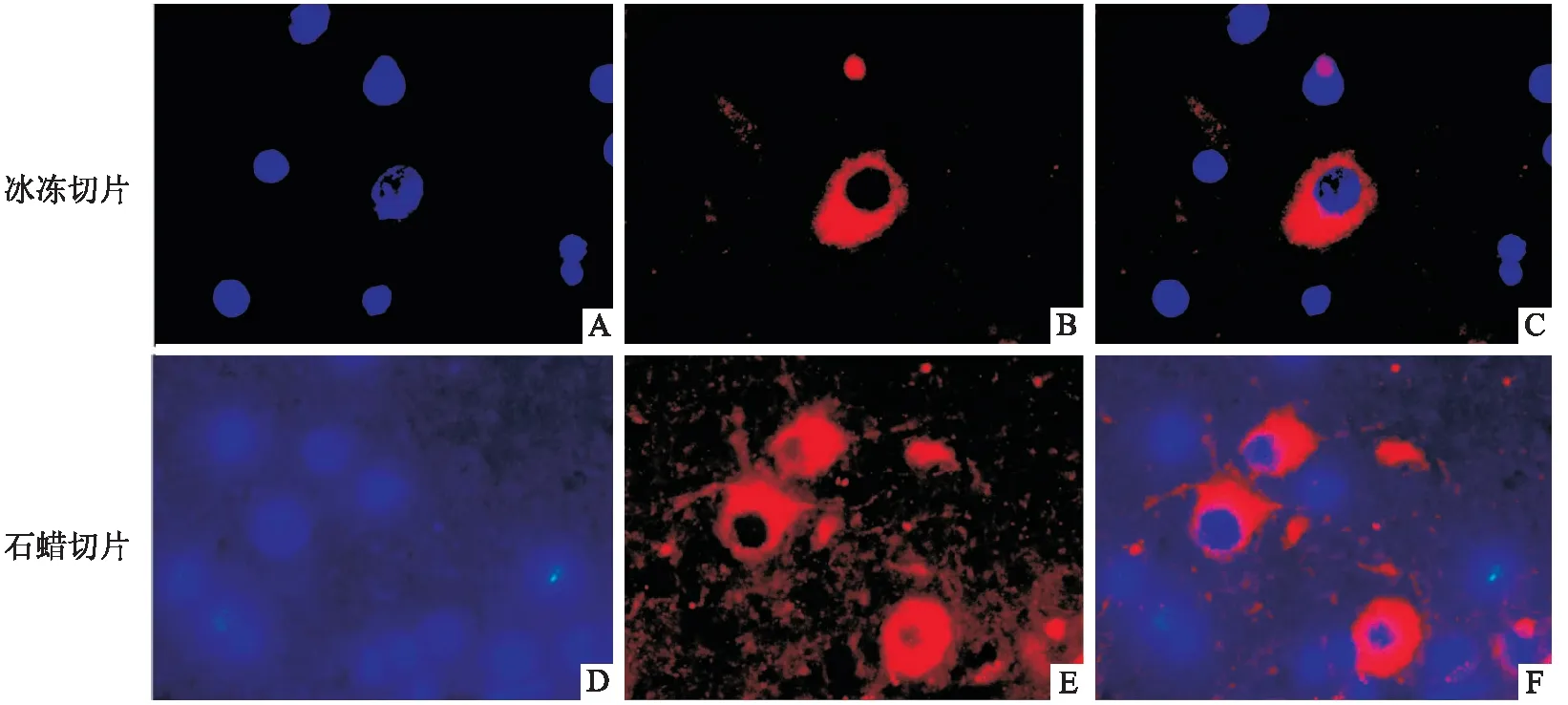
图5 猕猴下丘脑MAP2免疫荧光染色图 ×1 000
3 讨论
HPAA作为“神经-内分泌-免疫”(neuro-endocrine-immune,NEI)调节网络的三大轴之一,当受到刺激时,大脑发出信号,以适应环境。下丘脑最先接收到信息,兴奋CRH神经元,兴奋投射至正中隆起,释放CRH到垂体门脉系统到达垂体前叶,与CRH受体(CRHR1)结合,CRHR1是一种G蛋白偶联受体,激活腺垂体ACTH生成细胞释放ACTH入血到达肾上腺,与肾上腺皮质束状带细胞上ACTH受体(ACTHR)结合,刺激其分泌GC(人类合成皮质醇,啮齿动物合成皮质酮)[11]。皮质醇进入体循环后,与分布于机体各组织器官的核受体GR结合,参与包括压力反应、糖代谢、炎症反应及情绪改变等多个调节过程[12]。皮质醇又可与位于下丘脑及腺垂体上的GR结合,负反馈抑制CRH及ACTH的合成,其中任何一个环节发生异常都会影响HPAA的功能,导致NEI网络失调,对机体造成不可逆转的损伤[1]。该实验以猕猴为实验动物,探讨了多种有效病理染色方法,系统性地研究HPAA各级组织器官的组织结构学特征,并做了详细描述,也检测了各组织水平上分泌的激素及表达的激素受体,细化到了各蛋白的表达位置。其中iba-1是中枢神经系统中的小胶质细胞特异性标记蛋白,小胶质细胞是脑固有巨噬细胞,在脑损伤时快速感测神经障碍并被活化,迁移到损伤部位,发挥吞噬死细胞、产生促炎因子等功能[13]。MAP2存在于神经元中,构成细胞骨架,塑形神经元,其缺失会导致神经功能障碍[14]。这两种蛋白的表达情况可以作为下丘脑神经元发生炎症病理损伤的评价指标。以上研究从组织结构形态学的角度更清晰直观的表现出HPAA通过各激素和激素受体发挥调节机体内环境的作用,为更好的模拟人类HPAA各环节的生理和病理特征提供了方法参考。
由于实验时间限制,该研究只观察了正常猕猴的HPAA组织形态学,接下来将聚焦到某一疾病模型,观察病理状态下的HPAA轴功能改变。
