全身动态18F-FDG PET/CT Patlak显像评价大鼠胶质瘤放疗增敏早期疗效
2022-08-04张晴晴余文静薛杨央徐慧琴
蔡 可,张晴晴,余文静,薛杨央,汪 会,徐慧琴
放射治疗是胶质瘤术后的主要治疗方法,然而,由于胶质瘤高度缺氧和巨大异质性常导致预后不良[1]。研究[2]表明,放射增敏剂是解决肿瘤放疗耐受的有效手段之一。正电子发射计算机断层显像(positron emission computed tomography, PET/CT)在肿瘤诊断、分期及疗效评价中应用广泛,目前采用标准化摄取值(standardized uptake value, SUV)进行分析,但SUV是半定量指标,易受到注射时间、患者体质量、血糖水平等多种因素影响。全身动态18F-脱氧葡萄糖(fluorodeoxyglucose, FDG) PET/CT Patlak显像具有传统显像无法获得的FDG代谢的动力学信息,并且一次成像可生成多种类型PET图像,如Patlak斜率Ki图,Ki值代表FDG绝对摄取率,FDG绝对定量化有助于准确评估肿瘤治疗效果,从而制定最佳治疗方案以延长患者寿命[3-4]。本研究拟通过建立大鼠C6胶质瘤模型,采用齐墩果酸(oleanolic acid,OA)对其进行放射增敏治疗,探讨全身动态18F-FDG PET/CT Patlak显像评价大鼠C6胶质瘤放疗增敏早期疗效的价值。
1 材料与方法
1.1 细胞株与实验试剂大鼠C6胶质瘤细胞由安徽医科大学基础医学院核医学教研室提供;Dulbecco 改良 Eagle 培养基(dulbecco's modified eagle medium, DMEM)高糖培养基、胎牛血清、0.25%胰酶、磷酸盐缓冲液均购自美国Gibco公司;齐墩果酸购自北京索莱宝科技有限公司;肿瘤增殖指数Ki-67及葡萄糖转运蛋白-1(glucose transporter-1, GLUT-1)免疫组化试剂购自华安生物技术有限公司。
1.2 实验动物24只雄性大鼠,SPF级,(4~5)周龄,体质量(170~230) g,购自浙江维通利华实验动物技术有限公司,许可证编号:SCXK(浙)2019-0001;所有实验动物方案均获安徽医科大学动物实验伦理审查委员会批准,批号:LLSC20211059。
1.3 实验仪器VitalBeam直线加速器购自美国瓦里安公司;Biograph Vision PET/CT购自德国Siemens公司;18F-FDG购自江苏南京江原安迪科正电子研究发展有限公司,放化纯度>95%。
1.4 细胞培养与大鼠C6胶质瘤模型建立大鼠C6胶质瘤细胞于37 ℃、5%CO2恒温培养箱中培养,培养基为含10%胎牛血清的DMEM高糖培养基,隔天换液,通常传至2~3代。取处于对数生长期的C6胶质瘤细胞,待细胞贴满培养瓶底80%时用0.25%胰酶消化制成2.0×107/ml单细胞悬液,用1 ml无菌注射器抽取0.2 ml细胞悬液接种于大鼠右后肢皮下,记录接种时间,约2周左右接种部位瘤体直径≥1 cm时用于动物实验。
1.5 实验分组及处理将24只荷C6胶质瘤大鼠按随机数字表法分为以下4组,每组6只:对照组,给予生理盐水灌服,2 ml/d/只,共7 d;OA组,给予20 mg/ml的OA生理盐水悬浊液灌服,2 ml/d/只,共7 d;单纯放疗组,采用美国VARIAN Vitalbeam医用直线加速器进行放疗,照射采用6 Mev电子线,照射野10 cm×10 cm,源皮距100 cm,剂量率2 Gy/min,分次照射剂量4 Gy,隔日1次,共3次,累计照射剂量12 Gy;OA+放疗组,放疗前7 d每日给予OA生理盐水悬浊液灌服,剂量同OA组,7 d完成所有给药,随后使用与单纯放疗组相同的参数进行放射治疗。
1.6 全身动态18F-FDG PET/CT Patlak显像放疗前及放疗后48 h采用德国Siemens公司Biograph Vision PET/CT对四组荷C6胶质瘤大鼠行75 min全身动态18F-FDG PET/CT Patlak显像,见图1。大鼠显像前夜禁食6 h,可自由饮水。用异氟烷麻醉大鼠并俯卧位固定于PET/CT检查床上,先进行用于PET数据衰减校正的5 s低剂量CT采集(管电压120 kV,管电流160 mA,螺距5.0 mm),再移动检查床于PET视野内,经大鼠尾静脉弹丸式注射活度为37 MBq的18F-FDG,同时开始以心脏为中心的6 min动态单床PET采集,随后在75 min内进行18次连续进床全身PET扫描。采集完成后,采用有序子集最大期望值法(order subsets expectation maximization,OSEM)对原始动态PET数据(共46帧图)进行重建(参数:迭代4、子集5,矩阵为128×128)。在重建好的PET图像中勾画左心室感兴趣体积(volume of interest, VOI),并将勾画好的左心室VOI复制映射到同一断层所有帧中,生成左心室时间-活度曲线(tumor time activity curve,TAC)。左心室TAC曲线作为输入函数用于Patlak模型分析并获得Ki图像,动态PET图像最后一帧作为测量SUV的图像用于静态分析,在SUV图像中勾画每只荷瘤大鼠的肿瘤感兴趣区域(region of interest,ROI),并将ROI复制到Ki图中,测量每只荷瘤大鼠右后肢肿瘤SUVmax及Ki值。4组荷瘤大鼠肿瘤体积由PET/CT系统自带软件True D计算测量。
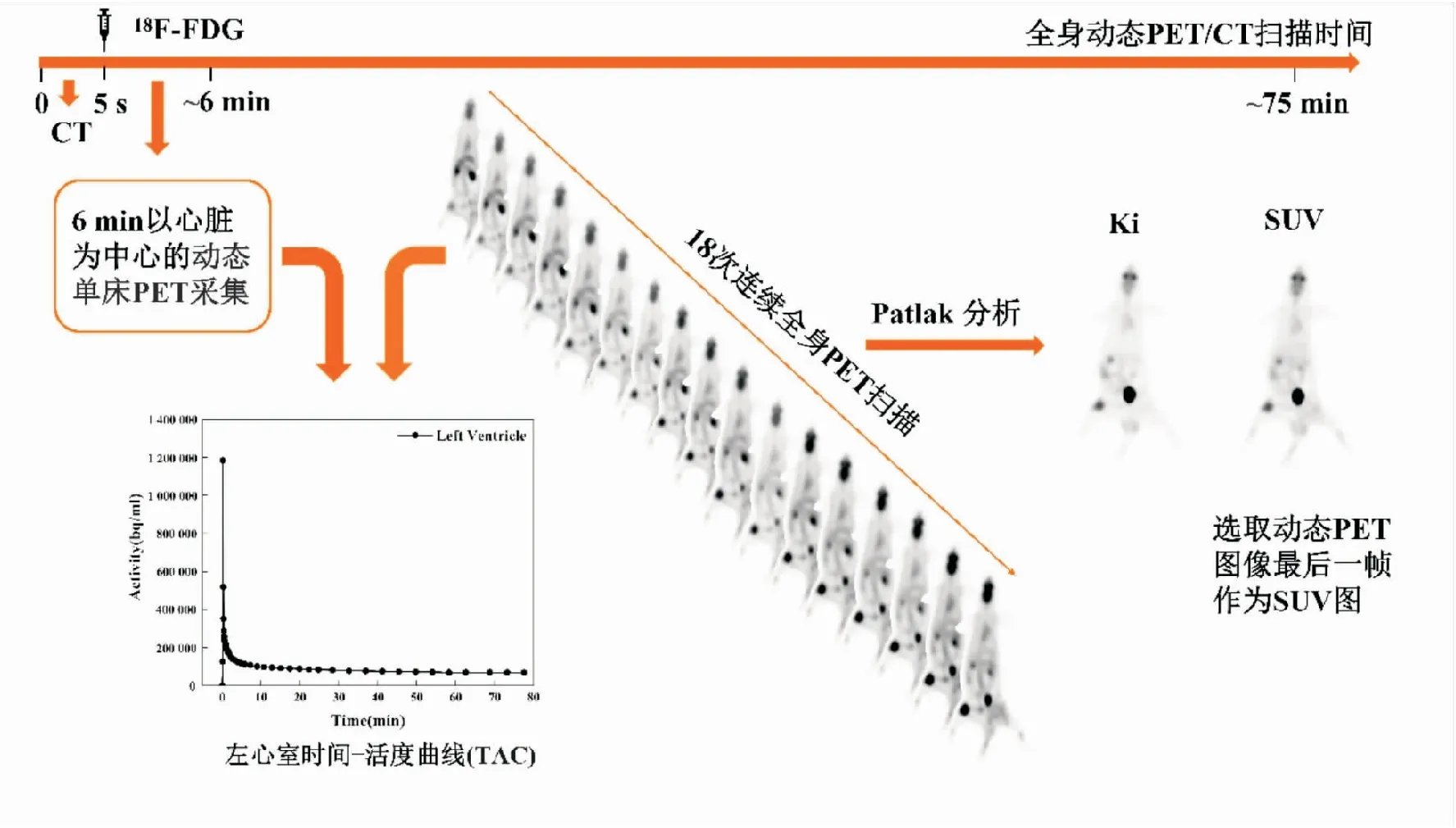
图1 全身动态18F-FDG PET/CT Patlak显像流程图
1.7 病理学检查显像完成后,迅速取出肿瘤组织,用体积分数4%多聚甲醛溶液固定,石蜡包埋,4 μm切片行Ki-67及GLUT-1免疫组织化学检查。在高倍视野下(×400),从每张切片随机选择5个视野进行拍照分析,计算每个视野100个细胞中的阳性细胞百分比。
2 结果
2.1 全身动态18F-FDG PET/CT Patlak显像结果接种2周左右,24只大鼠右后肢均可见类圆形瘤体组织,接种成功率100%。18F-FDG PET/CT显像荷瘤大鼠右后肢均可见不同程度放射性摄取增高灶,少数肿瘤放射性分布欠均匀。治疗前,4组SUVmax、Ki值差异无统计学意义(FSUVmax=0.909,P>0.05;FKi=0.858,P>0.05);治疗后48 h,4组之间SUVmax、Ki值差异有统计学意义(FSUVmax=68.547,P<0.01;FKi=200.648,P<0.01),对照组、OA组的SUVmax、Ki值较治疗前升高(tSUVmax=-10.697,P<0.01、tKi=-17.516,P<0.01;tSUVmax=-19.321,P<0.01、tKi=-9.887,P<0.01),放疗组、OA+放疗组的SUVmax、Ki值较治疗前下降(tSUVmax=5.629,P<0.01、tKi=6.916,P<0.01;tSUVmax=7.241,P<0.01、tKi=10.490,P<0.01)。治疗后放疗组、OA+放疗组的SUVmax差异无统计学意义(t=1.233,P=0.246),而OA+放疗组的Ki值较放疗组降低,差异有统计学意义(t=3.051,P<0.05),见表1、图2。治疗前4组肿瘤体积差异无统计学意义(F=0.507,P>0.05)。治疗后48 h,4组肿瘤体积差异有统计学意义(F=432.386,P<0.01),对照组、OA组肿瘤体积较治疗前明显增大,放疗组、OA+放疗组肿瘤体积增长缓慢,而放疗组、OA+放疗组肿瘤体积组间比较,差异无统计学意义(t=1.707,P>0.05),见表1。
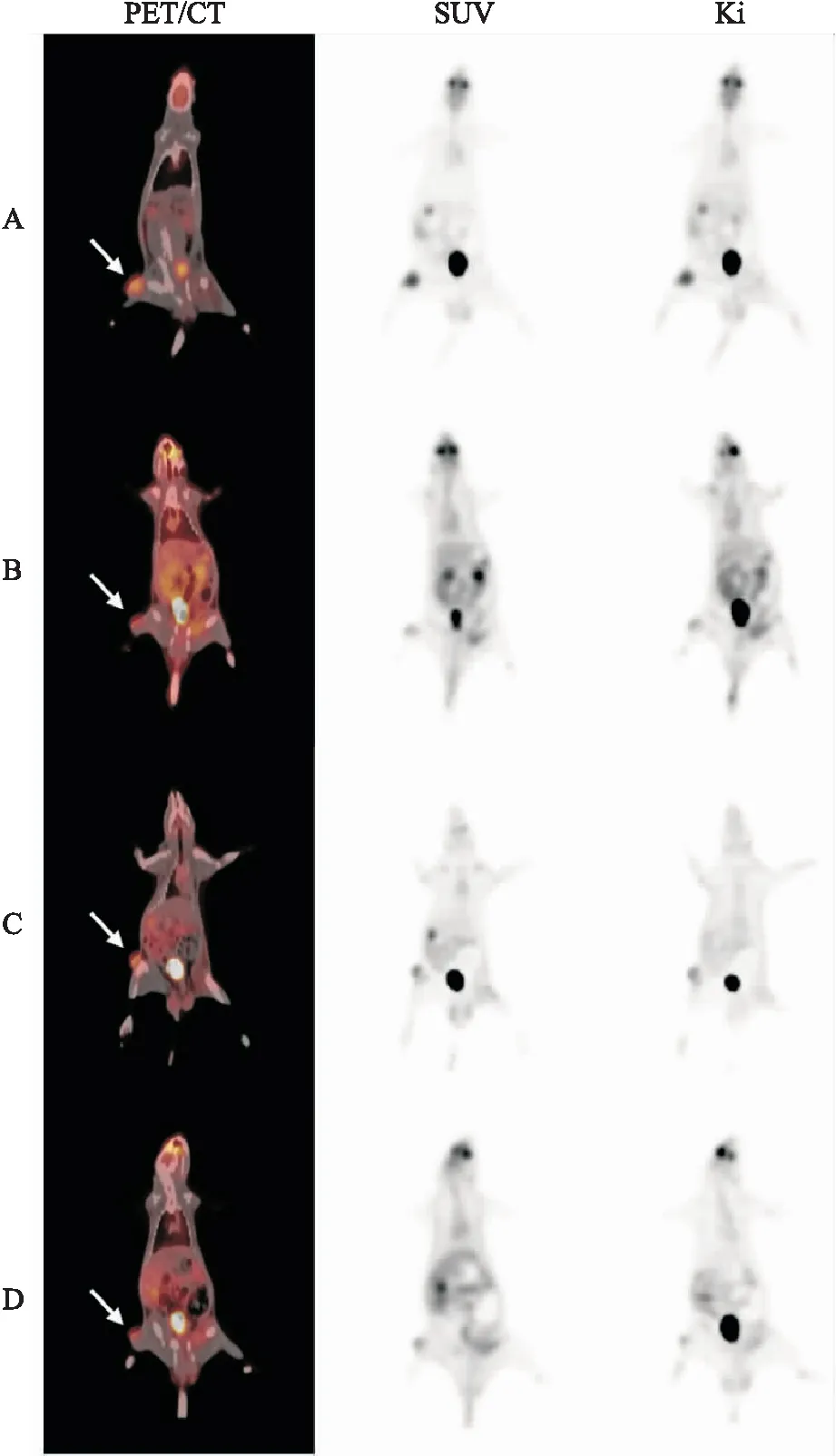
图2 治疗后48 h 4组大鼠全身动态18F-FDG PET/CT Patlak显像图A:对照组;B:OA组;C:单纯放疗组;D:OA+放疗组
表1 各组大鼠治疗前后肿瘤SUVmax、Ki值及肿瘤体积变化
2.2 免疫组化结果镜下观察,Ki-67阳性表达于细胞核,部分表达于细胞质中,4组阳性细胞百分比分别为(59.19±4.27)%、(60.14±5.24)%、(40.76±3.61)%和(31.77±3.87)%,OA+放疗组阳性细胞百分比低于其他3组(F=63.887,t=11.657、10.662、4.161,P<0.05),差异有统计学意义;GLUT-1阳性表达于细胞膜,部分表达于细胞质中,4组阳性细胞百分比分别为(74.53±5.66)%、(75.40±5.07)%、(53.21±9.11)%和(41.87±4.45)%,OA+放疗组阳性细胞百分比显著低于其他3组(F=40.720,t=11.116、12.173、2.743,P<0.05),差异有统计学意义,见图3。
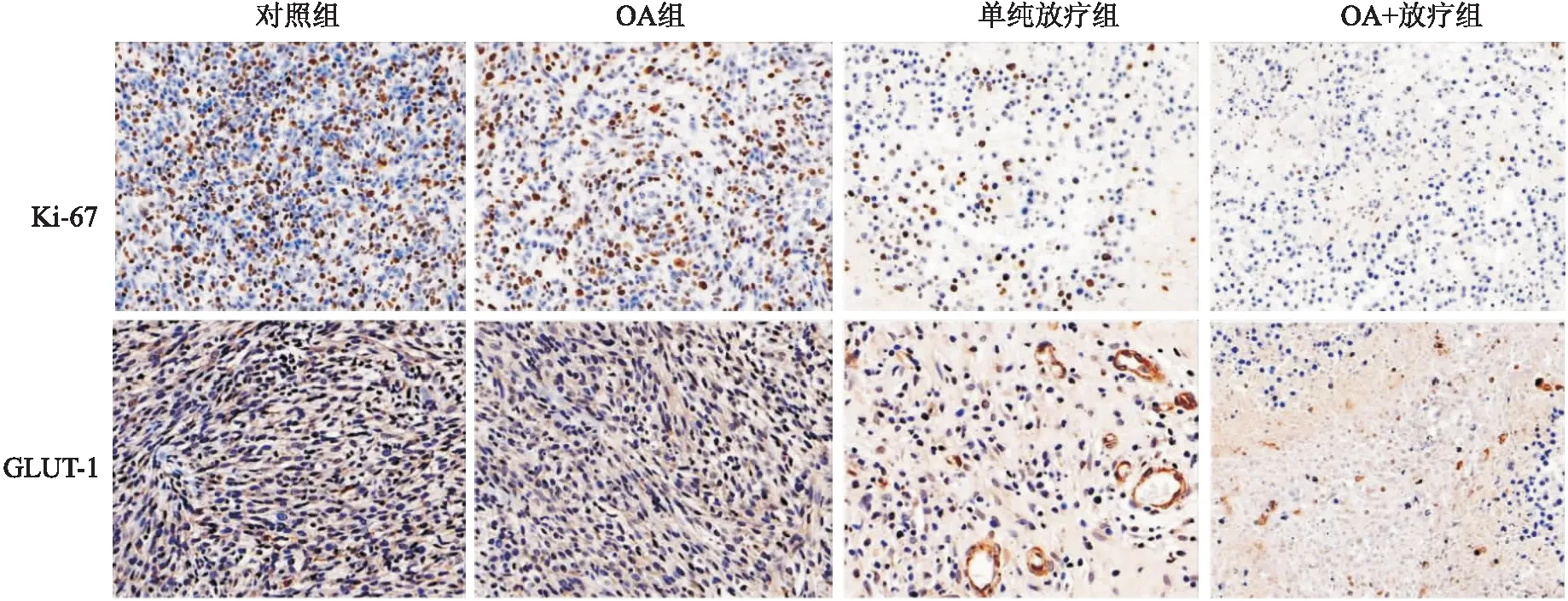
图3 各组荷C6胶质瘤大鼠肿瘤组织Ki-67及GLUT-1免疫组织化结果EnVision ×400
2.3 Ki-67及GLUT-1表达与Ki值之间的相关性分析Pearson相关分析结果显示Ki-67及GLUT-1表达与Ki值均呈正相关(rKi-67=0.931,P<0.01;rGLUT-1=0.936,P<0.01),见图4。
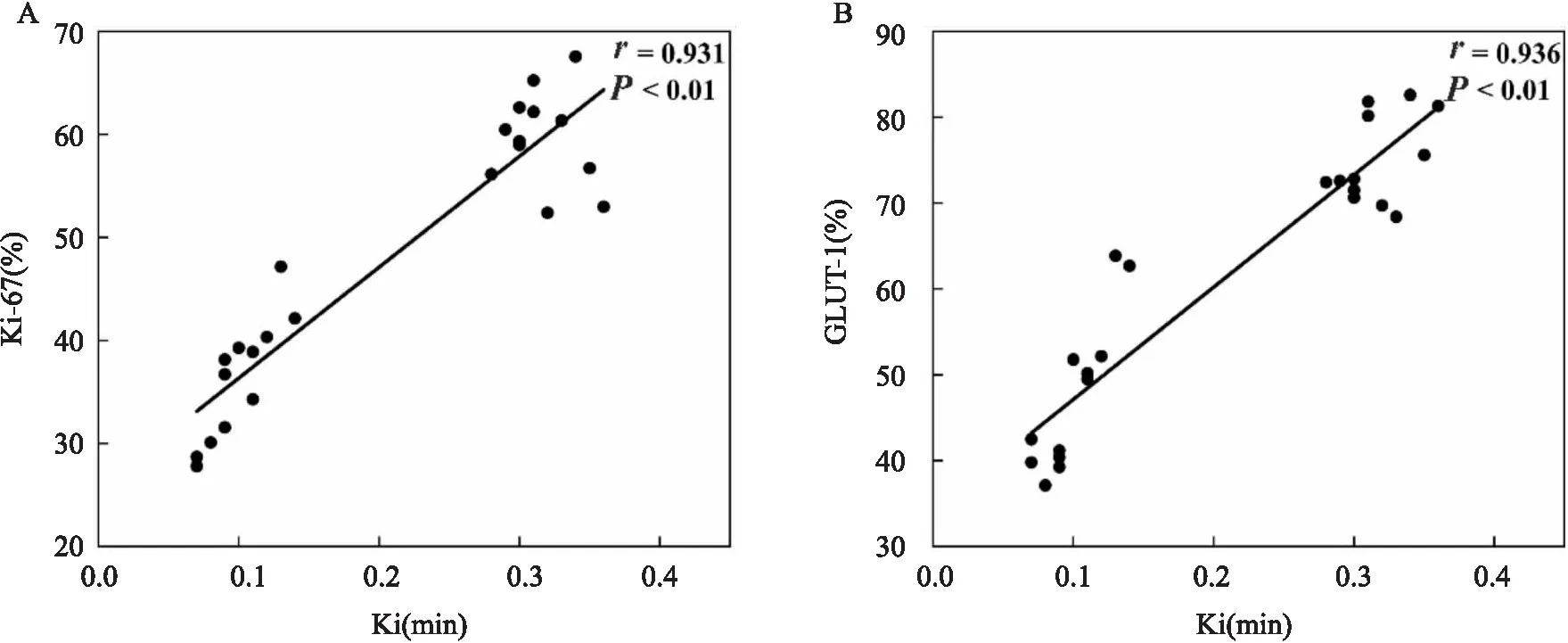
图4 Ki值与Ki-67及GLUT-1表达相关性分析A:Ki值与Ki-67表达相关分析图;B:Ki值与GLUT-1表达相关分析图
2.4 Kaplan-Meier法分析荷瘤鼠生存情况对照组、OA组、单纯放疗组、OA+放疗组的生存时间分别为(43.00±7.97)天、(44.83±6.21)天、(52.00±3.10)天及(57.67±3.27)天,Kaplan-Meier法分析显示各组间生存时间差异有统计学意义(χ2=19.817,P<0.01),见图5。
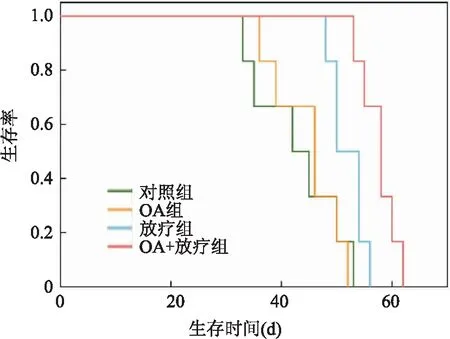
图5 Kaplan-Meier法分析4组荷瘤鼠生存率
3 讨论
恶性肿瘤的诊断及早期疗效评价与患者预后密切相关,准确的疗效评估对患者来说至关重要。PET/CT广泛用于监测肿瘤组织代谢、增殖、乏氧及凋亡等情况,可特异性地从分子水平反映肿瘤治疗效果[5]。在临床实践中,PET/CT检查是将采集的数据在采集时间范围内取平均值以生成传统的静态PET图像,并以SUV为指标进行量化,然而SUV是对示踪剂剂量及患者体重进行归一化,并且很大程度上取决于注射示踪剂至扫描的间隔时间,目前SUV仍存在很大的可变性[6]。
示踪剂在组织中分布的动态过程可以反映关于组织代谢特性非常有用的信息,因此,本实验引入了动态PET成像技术,允许随着时间的推移扫描有限的轴向视野,并采用稳定的Patlak图形分析法,从而提取重要的示踪剂动力学参数,即摄取率Ki,它代表示踪剂绝对代谢率,避免了时间依赖性,能够对病灶进行更准确的分析[7]。
以前的研究主要集中关注PET/CT静态显像,而采用全身动态18F-FDG PET/CT Patlak显像评估OA放射增敏早期疗效的研究目前国内外尚未见报道。本实验对大鼠C6胶质瘤行放射治疗,使用放射增敏剂OA,采用全身动态18F-FDG PET/CT Patlak显像评估OA对荷C6胶质瘤大鼠放疗增敏的早期疗效,观察并记录各组荷瘤鼠的生存时间。结果显示,OA联合放疗可抑制肿瘤生长,延长荷瘤鼠的生存时间,然而,在治疗后48 h,OA联合放疗组肿瘤体积较治疗前并没有缩小,且与放疗组相比差异无统计学意义,这可能是由于治疗后的肿瘤体积受到死细胞清除率、局部结构破坏及周围组织水肿等多种因素的影响[8],因此肿瘤体积并不是评价OA放射增敏早期疗效的敏感指标。动态PET/CT Patlak显像结果显示,放疗组和OA联合放疗组的SUVmax及Ki值较放疗前均下降,说明放疗后,肿瘤细胞活性受到抑制,因此肿瘤病灶的放射性摄取下降,而两组的SUVmax组间差异无统计学意义,但是两组的Ki值组间统计学差异显著,说明全身动态18F-FDG PET/CT Patlak显像在检测OA治疗后肿瘤活性早期变化方面比传统PET/CT静态显像更敏感。
Ki-67是目前广泛应用的一种细胞增殖标志物,表达于细胞周期的S、G1、G2、M期,G0期不表达,Ki-67表达与细胞增殖活性密切相关,可以反映肿瘤细胞增殖及预后情况[9-10]。Glut-1是葡萄糖转运蛋白家族中的一种,是细胞摄取葡萄糖的主要载体,可促进葡萄糖转运,肿瘤细胞由于无氧酵解水平的增加,导致Glut-1在恶性肿瘤细胞中有更高水平的表达[11]。本实验中,放疗组与OA联合放疗组中Ki-67及Glut-1的表达低于对照组,而OA联合放疗组的表达更低,提示放射治疗后,肿瘤细胞的增殖活性及代谢活性均降低,而使用放射增敏剂的OA联合放疗组对放射治疗更敏感。此外,本研究将全身动态PET/CT结果与免疫组化结果进行相关性分析,发现动态PET/CT Ki值与Ki-67及Glut-1表达呈明显正相关,进一步验证了全身动态18F-FDG PET/CT Patlak显像可以反映OA治疗后肿瘤细胞增殖活性及代谢活性的早期变化。
综上所述,OA对大鼠C6胶质瘤有放射增敏作用,全身动态18F-FDG PET/CT Patlak显像可以通过反映肿瘤细胞增殖活性及代谢活性的早期变化,评估大鼠C6胶质瘤放疗增敏的早期疗效,比传统PET/CT静态显像更灵敏。
