miR-30b在三叉神经痛模型大鼠中的表达及作用
2022-08-04胡婷婷刘明政徐文华王元银
胡婷婷,何 帆,刘明政,徐文华,王元银
三叉神经痛(trigeminal neuralgia,TN)是颌面外科临床常见的一种神经病理性疼痛,严重影响患者的生活质量及心理健康[1-2]。卡马西平等药物治疗易出现疲劳、头昏等副作用[1,3]。注射治疗、射频温控热凝和手术等方法也仍不能达到理想的治疗效果[1,3]。因此进一步探索TN发生的机制,寻找更精确有效的治疗方法,已成为近年来的研究热点[2,4]。
miR-30b是miR30家族的成员,参与了多种疾病的发病机制,与神经性疼痛、神经退行性疾病等有关[5-6]。目前关于TN模型大鼠三叉神经节(trigeminal ganglion,TG)中miR-30b的研究较少。激活转录因子3(activating transcription factor 3,ATF3)与周围神经损伤特异性相关,被用作神经损伤的特定标记物[7-8]。故本研究建立大鼠TN模型,通过机械痛阈测定及ATF3辅助验证模型,探索miR-30b是否参与调控TN的发生。
1 材料与方法
1.1 实验主要试剂、仪器Von Frey 毛刷(美国North Coast公司);Tissue RNA Purification Kit Plus(上海奕杉生物科技有限公司组织);PrimeScriptTMRT Reagent Kit(Perfect real Time)(日本TaKaRa生物科技有限公司) ;TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus)(日本TaKaRa生物科技有限公司);Hairpin-itTM microRNA and U6 snRNA Normalization RT-PCR Quantitation Kit(上海吉玛制药技术有限公司);荧光定量PCR仪(美国Thermo Scientific公司);KZ-Ⅲ-F高速低温组织研磨仪(武汉赛维尔生物科技有限公司);SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术有限公司);ATF3 Antibody(江苏亲科生物研究中心有限公司,DF6660);miR-30b agomir、miR-30b agomir NC(上海吉玛制药技术有限公司)。
1.2 实验动物及TN模型的构建
1.2.1实验动物 选用体质量(180~200) g的成年雄性 Sprange-Dawley(SD)大鼠,常规饲料饲养,自由饮水,饲养温度控制在22 ℃~25 ℃,12 h交替照明。动物实验通过安徽医科大学实验动物伦理委员会批准(批号:LLSC20190705)。实验动物均由安徽医科大学实验动物中心提供。
1.2.2TN模型的构建 选用眶下神经缩窄术(infraorbital nerve-chronic constriction injury,ION-CCI)构建TN动物模型。首先对大鼠进行1周的手术前适应性训练,剔除对Von Frey毛刷过于敏感或迟钝的大鼠,并筛选出经适应性训练后毛发和触须完整的大鼠用于TN模型的构建。大鼠称重后腹腔注射10%水合氯醛,待大鼠全身麻醉后,在左侧眶下颧弓和鼻骨结合处作一切口,长约5 mm,切口与鼻翼平行,玻璃分针分离眶下神经。ION-CCI组大鼠用两根5-0丝线结扎眶下神经,结扎线间距约2 mm。结扎力度适中,使眶下神经受到轻微压迫但未阻断其血液循环为宜。结扎完成后用3-0丝线缝合皮肤创口,涂抹红霉素软膏以预防创口感染[3,9]。
1.3 实验分组
1.3.1miR-30b在TN大鼠三叉神经节中的表达 将SD大鼠随机分成2组,即ION-CCI组及假手术组(Sham组),6只/组。ION-CCI组于大鼠左侧行眶下神经缩窄术,Sham组除不结扎眶下神经外,其余手术步骤均与ION-CCI组相同。采用Von Frey毛刷分别测试大鼠术前1 d和术后10个时间点(术后2、4、6、8、10、12、14、16、21、28 d)时术侧触须垫区域的机械痛阈,记录阈值并对大鼠不同时间点的机械痛阈进行统计分析。通过实时定量免疫荧光反应(qRT-PCR)及免疫印迹(Western blot) 检测术侧三叉神经节(TG)内ATF3和miR-30b表达变化。
1.3.2miR-30b表达变化对TN大鼠的影响 将SD大鼠随机分成3组,即ION-CCI组、ION-CCI+miR-30b agomir组及ION-CCI+scramble组,7只/组。ION-CCI造模术后第12天10%水合氯醛腹腔注射麻醉大鼠,经眶下孔分别将miR-30b agomir、agomir NC(20 μmol,10 μl)1次/d,连续4 d定位注射到ION-CCI+miR-30b agomir组及ION-CCI+scramble组大鼠TG内[10]。每次给药前及最后一次注射给药后1 d,使用Von Frey毛刷进行机械痛阈测定。最后一次注射给药后1 d处死大鼠,采集术侧TG,通过qRT-PCR以及Western blot方法对各组大鼠TG中ATF3和miR-30b表达量进行检测及对比。实验所用微小RNA(microRNA,miRNA)序列见表1。

表1 miRNA序列(5′-3′)
1.4 机械痛阈测定测试于每日16:00~17:00间进行,测试前将大鼠置于安静环境中适应1 h,用 Von Frey毛刷从最小刺激强度开始依次递增刺激大鼠术侧触须垫区域,每根毛刷重复刺激5次,每次间隔时间不少于30 s,直到某一毛刷激发大鼠重复出现以下任一阳性反应3次:① 快速缩头、躲避毛刷的行为;② 快速抓咬毛刷的攻击行为;③ 连续搔抓术侧受刺激部位皮肤的行为。此时记录该毛刷所代表的刺激强度即为机械痛阈,并对大鼠不同时间点的机械痛阈进行统计分析。
1.5 qRT-PCR采集大鼠术侧TG,采用Tissue RNA Purification Kit Plus(上海奕杉生物科技有限公司)提取mRNA及miRNA;PrimeScript TM RT Reagent Kit(日本TaKaRa生物科技有限公司)、TB Green®Premix Ex TaqTMⅡ(日本TaKaRa生物科技有限公司)、Hairpin-itTM microRNA and U6 snRNA Normalization RT-PCR Quantitation Kit(上海吉玛制药技术有限公司)进行 cDNA的合成和PCR的扩增;荧光定量PCR仪检测TG中ATF3及miR-30b的表达情况。使用 2-ΔΔCt计算其相对表达水平。实验所用荧光定量PCR基因引物序列见表2。

表2 荧光定量 PCR 基因引物序列
1.6 Western blot采集大鼠术侧TG组织,称重后每1 mg组织加入含1%PMSF的10 μl RIPA裂解液,置于KZ-Ⅲ-F高速低温组织研磨仪中研磨。4 ℃、12 000 r/min 条件下离心10 min,吸取上清液。加入相应体积的 5X SDS-PAGE蛋白上样缓冲液,100 ℃加热10 min使蛋白充分变性,-20 ℃下保存待用。使用10% SDS-PAGE凝胶配制试剂盒制备凝胶,上样电泳后转模至PVDF膜上,TBST洗涤液反复洗涤3次,每次10 min,置于5%脱脂奶粉中,室温下摇床封闭2 h。置于一抗稀释液中(ATF3 Antibody 1 ∶1 000,江苏亲科生物研究中心有限公司,DF6660;GAPDH Zsbio,TA-08),4 ℃下孵育过夜。PVDF 膜充分漂洗后置于已稀释好的二抗中室温孵育1.2 h。PVDF膜充分漂洗,置于显影机内设置条件曝光成像,使用Image J软件对曝光后的蛋白条带图灰度值进行统计分析,检测ATF3蛋白的相对表达水平。
1.7 统计学处理采用Grahpad Prism 8.0软件进行分析,ION-CCI组及Sham组两组间qRT-PCR 实验及Western blot 实验数据比较采用独立样本t检验。机械痛阈测定结果采用双因素方差分析。ION-CCI组、ION-CCI+scramble组及ION-CCI+miR-30b agomir组qRT-PCR 实验和 Western blot 实验数据采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠TN模型构建成功机械痛阈测定结果显示ION-CCI组大鼠术后第2~28天机械痛阈低于Sham组。术后第2天ION-CCI组大鼠机械痛阈即开始降低[Sham 组: (1.33±0.16) g,ION-CCI 组: (0.70±0.24) g],在术后第12天时疼痛阈值达到最低[Sham 组: (1.53±0.39) g,ION-CCI组: (0.11±0.06) g],且直至术后28天ION-CCI组大鼠机械痛阈仍低于Sham组[Sham 组: (1.53±0.39) g,ION-CCI组: (0.32±0.12) g],F=3.965,P<0.05,见图1。qRT-PCR结果显示术后第12天ION-CCI组大鼠TG中ATF3 mRNA表达较Sham组升高,t=5.780,P<0.05,见图2A。Western blot结果显示术后第12天ION-CCI组大鼠TG中ATF3 蛋白表达较Sham组升高,t=11.18,P<0.05,见图2B。以上结果表明TN模型构建成功。
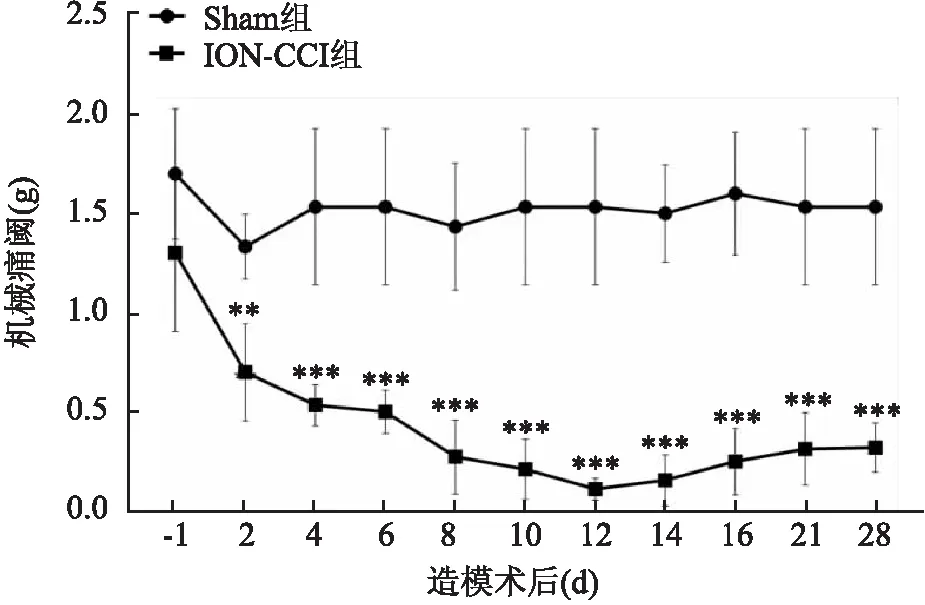
图1 ION-CCI组及Sham组大鼠在造模术后不同时间点机械痛阈的变化与 Sham组比较:**P<0.01,***P<0.001
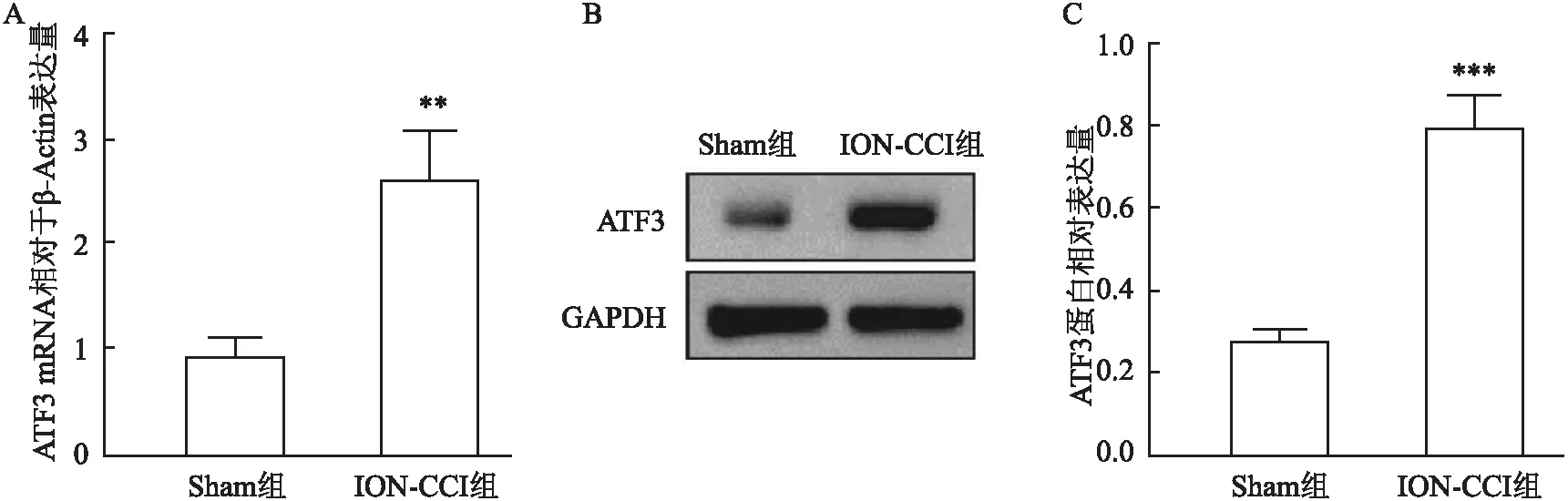
图2 ATF3在ION-CCI组大鼠术侧TG中的的表达与Sham组比较:**P<0.01,***P<0.001
2.2 TN大鼠的术侧TG中miR-30b表达降低qRT-PCR结果显示在术后第12天,与Sham组相比,ION-CCI组大鼠TG中miR-30b的相对表达量降低,t=6.505,P<0.05,见图3。
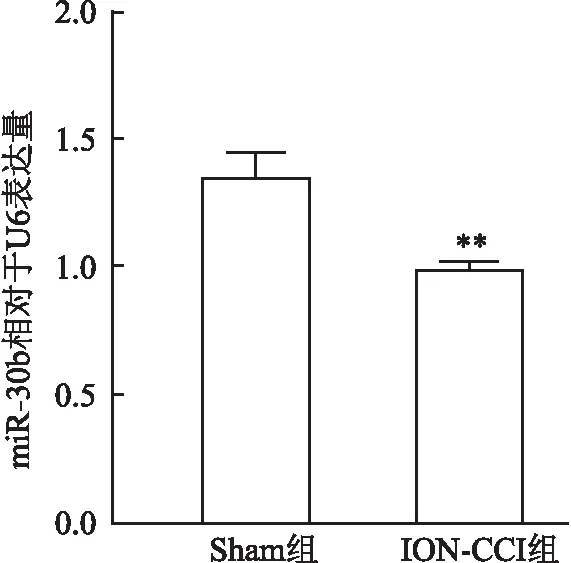
图3 miR-30b在ION-CCI组大鼠术侧TG中的表达与Sham组比较:**P<0.01
2.3 miR-30b类似物对TN大鼠TG内ATF3的表达的影响注射miR-30b类似物后,与ION-CCI组及ION-CCI+scramble组相比,ION-CCI+miR-30b agomir组机械痛阈升高,F=21.20,P<0.05;qRT-PCR结果显示ION-CCI+miR-30b agomir组大鼠TG中ATF3 mRNA表达降低,F=8.562,P<0.05;Western blot结果显示ION-CCI+miR-30b agomir组大鼠TG中ATF3 的蛋白表达降低,F=8.353,P<0.05,见图4。ION-CCI组与ION-CCI+scramble组大鼠机械痛阈及TG内ATF3的表达差异无统计学意义。
3 讨论
miRNAs是一类长度为18~25个核苷酸的非编码RNA[11]。超过30%的人类蛋白编码基因可能受到这些miRNAs的调控[12]。成熟的单链miRNA可通过序列完全互补的方式与靶基因mRNA 3’非翻译区相结合,降解mRNA或抑制mRNA的翻译[11]。miRNAs在病理状态下表达异常,可能是一个潜在的治疗靶点[11]。近年来miRNAs在疼痛中的作用受到越来越多的关注,逐渐成为镇痛治疗的一个新方向[6]。CCI慢性坐骨神经缩窄性损伤后,大约有111种miRNAs表达异常[13]。Shao et al[14]研究发现在脊神经损伤模型SNL中,miR-30b可通过抑制Nav1.7的表达缓解大鼠的神经性疼痛。Su et al[15]研究发现在脊神经损伤模型SNL中,miR-30b可通过抑制大鼠背根神经节神经元和脊髓中Nav1.3的表达来减轻神经性疼痛。目前miRNAs对痛觉调控机制的研究主要集中在背根神经节、脊髓组织和坐骨神经痛等,对其在TN中的作用研究较少。故本研究重点关注miR-30b在TN模型大鼠TG内的表达及作用。
采用眶下神经缩窄模型建立TN是由Vos et al[16]于1994年首次提出的一种经典的造模方法,改编自Bennett和Xie[17]的坐骨神经慢性结扎模型,能再现TN的重要方面,模拟出TN的自发性疼痛及异常性疼痛(痛觉过敏),通过对大鼠术侧触须垫区域进行机械痛阈测定来判断造模是否成功[3,9]。ATF3是一种转录因子,也是损伤的初级传入神经元的敏感标记物,与周围神经损伤特异性相关。ATF3在许多不同组织中被应激信号诱导。在疾病和损伤的动物研究中,包括神经结扎、HIV、糖尿病和神经毒素等诱导的神经病变,ATF3被用作神经损伤的特定标记物,可以很好地标记那些组织损伤后长期致敏的神经元[8]。故在测定大鼠机械痛阈之外,本研究通过检测TG中ATF3的表达变化辅助验证SD大鼠ION-CCI所构建的TN动物模型。
实验结果表明,与Sham组相比,ION-CCI组术后第2~28天机械痛阈降低,术后第12天达到最低值;术后第12天ION-CCI组TG中ATF3 mRNA及蛋白表达升高,提示TN模型建立成功。ION-CCI组术后第12天TG中miR-30b表达降低,提示miR-30b参与了TN的发生。为进一步了解miR-30b表达变化对TN大鼠的影响,在ION-CCI术后第12天,当大鼠TN模型稳定构建时,经眶下孔分别将miR-30b agomir、agomir NC 1次/d,连续4 d定位注射到ION-CCI+miR-30b agomir组及ION-CCI+scramble组大鼠TG内。实验结果显示miR-30b类似物干预后,TN大鼠机械痛阈升高,TG内ATF3表达降低。提示过表达miR-30b,不仅可以有效抑制TN引起的ATF3的上调,还能使大鼠的机械痛阈升高,缓解ION-CCI诱导的TN,从而确定了miR-30b可能是TN潜在的治疗靶点。
目前认为TN的实质可能是一种过度兴奋,表现为血管受压后脱髓鞘的三叉神经出现异常放电或异位动作电位[18]。电压门控钠离子通道(Voltage-gated sodium channels,VGSC)在神经元动作电位的启动和产生中起着至关重要的作用[2]。研究[14-15]
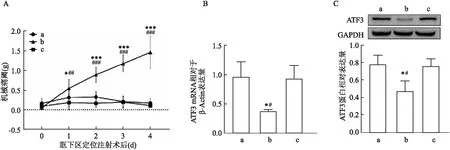
图4 各组大鼠眶下区定位注射不同时间点机械痛阈及术侧TG中ATF3的表达变化
证实,某些miRNA可通过调节VGSC表达和神经元兴奋性,参与神经性疼痛的发展。通过生物信息学预测发现miR-30b与VGSC亚型Nav1.3高度相关。由此推测在正常生理状态下,miR-30b能够抑制SCN3A(Nav1.3编码基因)由mRNA到Nav1.3蛋白的翻译。在外周神经受到损伤时,miR-30b表达下调从而减少对Nav1.3 mRNA的抑制,Nav1.3表达增加,引起神经元兴奋性增强,从而诱发TN。后续实验将进一步深入探究miR-30b调控TN的潜在机制,为TN的治疗研究提供新的方向。
