α-硫辛酸抑制增生性瘢痕氧化应激的作用
2022-08-04倪子樵张锦松朱秋璇黄海年
倪子樵, 张锦松,高 翔,朱秋璇, 王 鑫,黄海年,朱 飞
目前增生性瘢痕(hypertrophic scar,HTS)的形成机制尚不清楚,其预防和治疗也相对困难。氧化应激是机体内活性氧(reactive oxygen species,ROS)产生和抗氧化能力失衡的结果。研究[1]表明,高水平ROS有促纤维化作用,HTS和瘢痕疙瘩中存在氧化应激失衡。NRF2/ARE通路是清除ROS的主要途径。在氧化应激过程中,ROS促进NRF2核转位,激活多种抗氧化酶如[NAD ( P ) H:醌氧化还原酶 1 NQO1]、超氧化物歧化酶(superoxide dismutase,SOD)等表达[2]。
α-硫辛酸(α-lipoic acid,ALA)最初由Reed et al[3]于1951年从牛肝中分离,因其抗氧化特性,ALA可用于多种疾病的治疗,如糖尿病、心血管疾病、癌症和艾滋病。但尚无文献报道ALA在HTS中的作用。ALA因其稳定性差、溶解度低、刺激性强等缺点,不宜直接制备成皮肤制剂使用。本研究将在兔耳HTS模型中探讨局部应用ALA是否可抑制HTS进展以及对氧化还原相关通路的影响。
1 材料与方法
1.1 主要材料ALA、10%NaOH溶液、10%HCl溶液(美国Sigma公司);2-羟丙基-β-环糊精(上海阿拉丁生化科技有限公司);HE 染色液、Masson染色试剂盒、RIPA 裂解液、 BCA 蛋白定量试剂盒、DAB 显色液、ECL 显色液;山羊抗小鼠IgG、山羊抗兔IgG(北京中杉金桥生物技术有限公司);NRF2、NQO1、SOD1、CAT、HO-1抗体(英国Abcam公司);T-SOD、MDA、Hyp、GSH、GSH-px、GSR试剂盒(南京建成生物工程研究所);石蜡包埋机、切片图像分析系统(德国LEICA);全自动化学发光分析仪(上海天能科技有限公司)。
1.2 方法
1.2.1瘢痕模型的建立和ALA乳膏的制备
1.2.1.1瘢痕模型的建立 随机选取18只健康新西兰大白兔,雌雄不限,体质量为2.5~3.0 kg,均由安徽医科大学实验动物中心提供。造模前,适应性单笼喂养3 d,维持室内温度21~25℃。根据李荟元 等[4]建立兔耳HTS模型的方法,3%戊巴比妥钠(30 mg/kg)耳缘静脉麻醉。75%酒精消毒术区,术中严格遵循无菌操作原则。在兔耳腹侧用直径10 mm的角膜环钻钻穿全层皮肤,骨膜剥离器去除软骨膜,保留软骨,按压止血,然后用生理盐水清洗后暴露。每只兔耳两侧长轴方向各制备6个相同的创面,间隔1.5 cm。术后7 d去除创面痂皮,再次造创后14 d左右所有创面均完成上皮化。
1.2.1.2ALA乳膏制备 根据Ikuta et al[5]的实验方法,将2-羟丙基-β-环糊精溶解于10%NaOH中,搅拌至完全溶解,按2:1比例加入ALA粉末,充分搅拌至液体澄清透明。再用10%HCl滴定至pH=7.0,形成稳定的ALA/β-CD包合物。将ALA/β-CD和凡士林、液体石蜡按 2 ∶1 ∶1充分混合,制备成ALA乳膏。
1.2.2实验分组及给药 术后第20 d,所有创面均完全再上皮化并形成早期HTS。随机将动物分为2组,模型组(HTS组)不予以特殊处理,实验组(ALA组)涂抹质量分数为4%ALA软膏(预实验筛选浓度确定),根据Arivazhagan et al[6]提出的ALA有效抑制脂质过氧化的浓度[100 mg/(kg·d)],用量0.1 g/次,2次/d,连续用药28 d。另取6只作空白对照。术后第49 d处死所有实验动物,每组获得标本72个,每个瘢痕在最大突起处被一分为二,一部分立即用10%福尔马林固定脱水,石蜡包埋切片行后期染色观察。一部分放置于-80 ℃冰冻保存,测定氧化应激等相关蛋白表达的指标。
1.2.3大体观察 所有创面再上皮化后,动态观察并记录各组增生性瘢痕的大体情况,在给药后第7、14、28 d,每组随机选择18个瘢痕组织,由3名技术人员在相同条件下分别通过色泽、血管分布、厚度、柔软度评估各组瘢痕增生程度,根据温哥华瘢痕评定量表(VSS),最高分为13分,最低分为0分。对每一个瘢痕评分取平均值,并做统计学处理。连续用药28 d后,在无菌条件下取材。
1.2.4病理指标检测 将取出的组织用10%中性福尔马林固定24 h,石蜡包埋后制备3~4 μm切片。使用苏木精-伊红(HE)染色进行光镜检查,光镜下观察HTS形态及成纤维细胞计数;按照Masson染色试剂盒说明书行Masson染色,脱水后用二甲苯透明、封片,显微镜下拍照分析。
1.2.5免疫组化检测HTS中Ⅰ型胶原、Ⅲ型胶原、CD34、Ki67表达 石蜡包埋的组织切片(4 μm)脱蜡、脱水和复水。加入3% H2O2阻断内源过氧化物酶活性,漂洗后,一抗(collagen 1:1 ∶300; collagen 3:1 ∶300;CD 34:1 ∶400;Ki67:1 ∶200 )孵育60 min,冲洗后加二抗孵育20 min,苏木精复染。显微镜下捕获图像。
1.2.6生化指标检测MDA、Hyp、GSH-px、GR、GSH、T-SOD水平 取保存在-80 ℃的各组组织,与冷却的Tris-HCL缓冲液以1 ∶5(W/V)比例冰浴匀浆,4 ℃、3 500 r/min离心10 min,取上清液行样本分析。按照MDA、Hyp、GSH试剂盒操作说明检测各组组织中MDA、Hyp、GSH含量。按照GSH-px、GR、T-SOD试剂盒操作说明检测各组样本中GSH-px、GR、T-SOD活性。
1.2.7Western blot检测组织中NRF2、SOD-1、NQO1、CAT、HO-1蛋白相对含量 取各组样本,提取总蛋白和核蛋白。SDS-PAGE(聚丙烯酰氨凝胶电泳)用于将等量的蛋白质(10~20 μg)转移到 PVDF 膜上。 将PVDF膜与抗体HO-1(1 ∶1 000)、NRF2 (1 ∶1 000)、SOD1 (1 ∶1 000)、NQO1 (1 ∶1 000)、CAT(1 ∶1 000)、β-actin(1 ∶2 000)、LaminB1(1 ∶1 000)共同孵育 2 h。一抗孵育后,再将PVDF膜与山羊抗兔IgG抗体或山羊抗小鼠IgG抗体孵育1~2 h,然后将膜在 DPS-Tween 20 中洗涤4次,8 min/次,洗涤过后用 ECL 试剂盒进行信号检测。
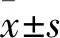
2 结果
2.1 ALA对HTS抑制效果的大体观察兔耳增生性瘢痕模型创面于术后20 d左右完成上皮化,所有创面均愈合良好。上皮化后局部涂抹药物,肉眼观察并拍照评估各组兔耳HTS组织的大小、颜色变化。局部给药第7、14、28 d,每组随机选取18个瘢痕,每个瘢痕评分取平均数行统计学处理(图1),第7 d时,4% ALA组与模型组比较差异无统计学意义,第14天与28天时4% ALA组与模型组比较,温哥华瘢痕评分降低(F14 d=1.262,P<0.001;F28 d=2.102,P<0.001)。实验组较模型组瘢痕体积减小,瘢痕颜色变浅,硬度降低。模型组呈现HTS的典型表现。见图2。

图1 模型组与4%ALA组瘢痕在不同时间温哥华瘢痕评分
2.2 ALA对HTS组织结构的影响HE染色显示模型组真皮层明显增厚,乳头层和网状层边界模糊。高倍视野下真皮内成纤维细胞、微血管也明显增多,表现为轻度的慢性炎症。4% ALA治疗28 d的瘢痕,瘢痕真皮层明显变薄,细胞和微血管明显减少。Masson染色显示模型组组织切片中真皮深层胶原纤维致密,胶原纤维较宽,排列紊乱,呈结节状、圆形或螺旋状排列。相反,4%ALA组中胶原纤维细长,颜色浅蓝色,密度降低,平行于皮肤表面,有向正常皮肤组转化的趋势。见图2。

图2 肉眼观察ALA对兔耳增生性瘢痕模型的影响
2.3 ALA对HTS中CD34、Ⅰ型胶原、Ⅲ型胶原和Ki67表达影响正常组、模型组和4%ALA组中CD34阳性细胞的表达,主要定位在微血管内皮细胞胞浆中,呈棕黄色或褐色。模型组中CD34阳性表达的微血管数高于正常组及ALA组;Col Ⅰ和Col Ⅲ主要表达于细胞外基质中,模型组中Col Ⅰ和Col Ⅲ阳性面积多于正常组及4%ALA组;模型组中,Ki67阳性表达率多于正常组及4%ALA组。见图3。
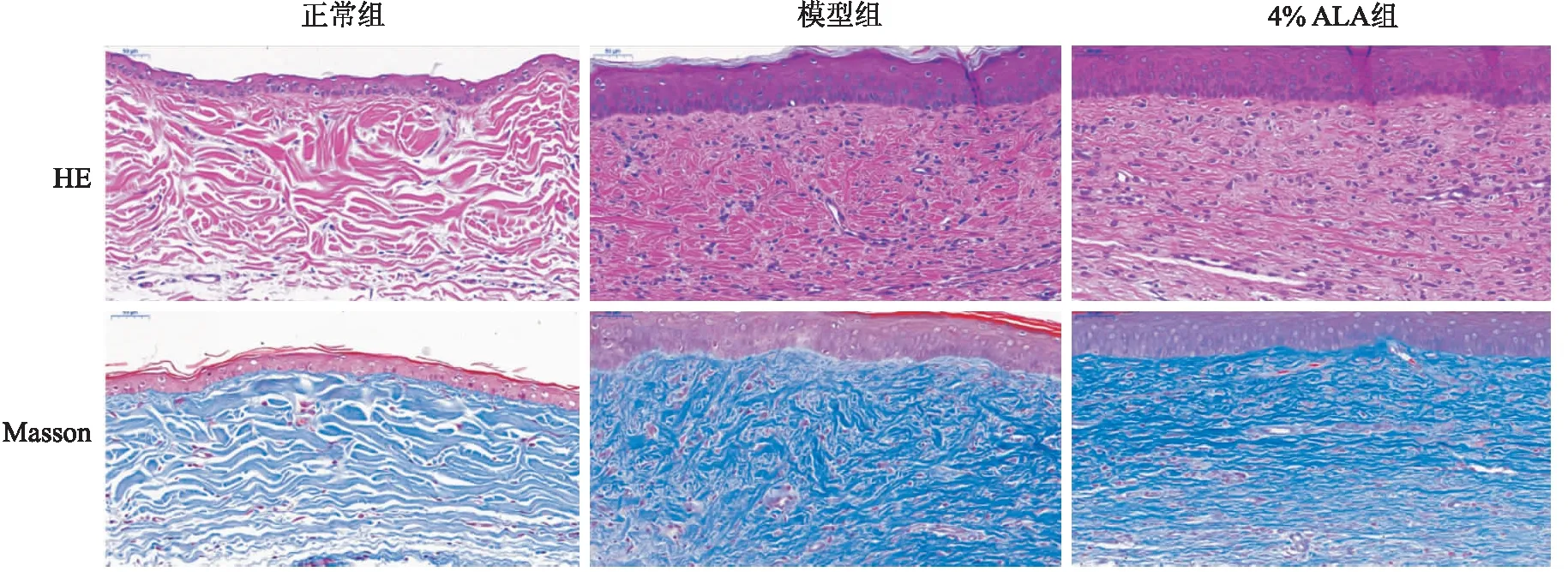
图3 ALA对兔耳增生性瘢痕模型组织形态的影响 HE&Masson染色 ×200
2.4 ALA对HTS中MDA、Hyp、GSH含量及GSH-px、GR、T-SOD活性的影响与4%ALA组及正常组相比,模型组中MDA、Hyp含量明显升高, GSH-px、GR活性均明显升高,GSH水平明显降低,T-SOD活性逐渐递增(FGR=79.36,FGSH=237.3,FGPX=164,FHYP=285.5,FMDA=320.2,FT-SOD=99.25),差异有统计学意义。见图4。
图4 ALA对兔耳增生性瘢痕模型组织CD34、Col Ⅰ、Col Ⅲ表达的影响 免疫组化 ×400
2.5 ALA对HTS中NRF2、SOD1、NQO1、CAT、HO-1蛋白表达的影响在正常组、模型组、4%ALA组中,NRF2、SOD1、NQO1、CAT、HO-1蛋白表达逐渐递增(F总NRF2=57.82,FHO-1=216.5,FNQO1=198.4,FCat=103.7,FSOD1=480,F核NRF2=90.04),组间两两比较差异有统计学意义(P<0.05)。见图5。
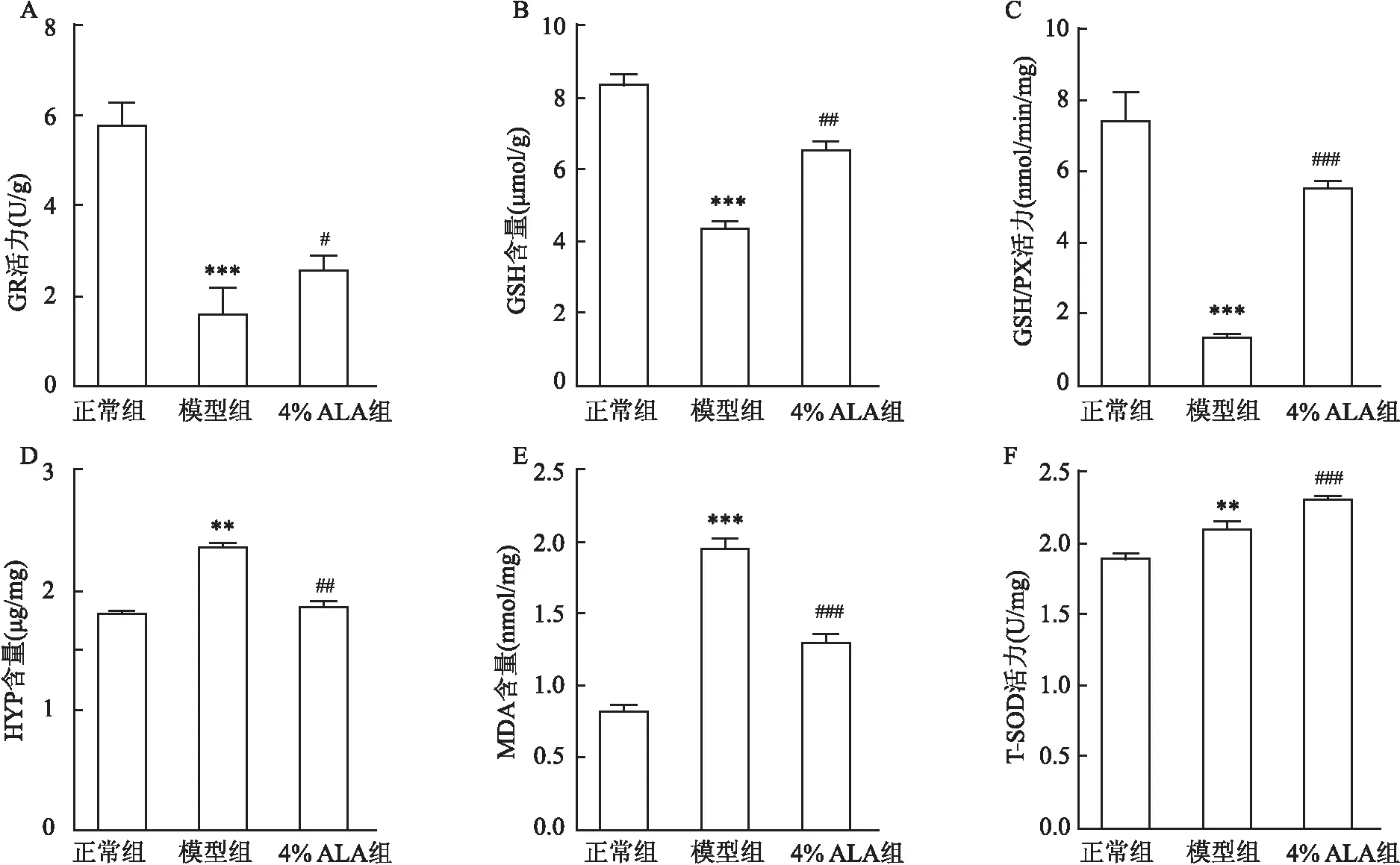
图5 ALA对兔耳增生性瘢痕模型中生化指标的影响
3 讨论
HTS形成的机制目前尚不完全清楚,以成纤维细胞持续活化和细胞外基质过度沉积为特征。局部应用抗瘢痕药物的优点在于无创且易于使用,可提高患者的依从性[7]。因此,临床上致力于寻找一种早期干预、安全性高、创伤小的治疗方法。氧化应激的相关机制已相对明确,近期已有研究[8]表明,氧化还原失衡可能在增生性瘢痕的进展过程中起重要作用。

图6 ALA对兔耳增生性瘢痕模型中NRF2通路相关蛋白表达的影响
ALA作为一种强效的抗氧化剂,能够提高细胞内抗氧化水平,清除和灭活自由基,保护细胞免受氧化应激损伤。Podda et al[9]通过局部应用14C标记的ALA探究其在裸鼠皮下动力学的分布,证实ALA可通过皮肤吸收。Beitner et al[10]使用5%含ALA的面霜进行了关于光老化的双盲随机对照研究,证明其局部应用的安全性和有效性。
本实验成功建立兔耳增生性瘢痕模型,局部外涂ALA治疗后,通过大体观察、病理切片HE染色等指标证实ALA对HTS具有抑制作用。ALA提高HTS组织内抗氧化酶的含量,激活NRF2/ARE通路,提示ALA发挥抗瘢痕作用可能与提高HTS组织内抗氧化能力有关。
细胞内的ROS主要由线粒体产生[11]。MDA含量高低间接反应机体细胞受ROS攻击的严重程度。但本研究结果显示,模型组中MDA和T-SOD水平较均较正常组升高,考虑是HTS的抗氧化能力不足以清除大量升高的ROS,长期暴露在高水平ROS条件下的瘢痕组织,抗氧化物耗竭,氧化与抗氧化之间的平衡倾向于氧化,导致氧化应激损伤。促进成纤维细胞活化和细胞外基质的过度沉积,ALA处理后的HTS抗氧化能力增强,证实了ALA的调节作用。
谷胱甘肽(GSH)循环是机体内重要的抗氧化保护机制之一[12],已有研究[13]表明ALA可通过NRF2/ARE信号通路通过GR再生GSH来减轻镉诱导的HepG2细胞氧化应激。本研究模型组中GSH-px、GR活力及GSH水平较正常组降低,因此GSH可能直接参与HTS内清除ROS的作用,在HTS中,由于ROS增加导致GSH含量降低,而在ALA治疗后,GSH-px、GR活力增加,同时GSH水平相应增加,这与本课题组预期结果相同。提示ALA可能通过NRF2/ARE信号通路增加HTS内GSH的循环,增强瘢痕组织抗氧化能力。
NRF2/ARE信号通路是体内清除ROS的主要途径,作为氧化还原敏感的转录因子,激活的NRF2可以从细胞质移位到细胞核,并抗氧化反应元件(ARE)结合,调控一系列抗氧化酶表达。其蛋白表达水平间接反应机体清除氧自由基的能力。本研究发现,HTS中NRF2表达及核转位增加,其下游相应的抗氧化蛋白表达相应增加,但HTS中仍处于高水平氧化应激状态。在ALA处理后的HTS中,NRF2蛋白表达及核转位和其下游的抗氧化蛋白较模型组中表达增加,氧化应激水平相应降低。ALA加速增生性瘢痕中NRF2的核转位,增加了抗氧化蛋白的表达,增强了HTS组织中的抗氧化能力,减轻了瘢痕组织中的氧化损伤。
已有研究[14]表明高浓度ALA可导致细胞氧化应激损伤。前期预实验采用1%、2%、4%和8%ALA处理HTS,结果提示4%ALA对HTS抑制效果最佳,因此本实验将4%ALA设为最适浓度。后续将通过设置更小浓度梯度探究ALA在HTS中的最佳作用浓度。本研究仅在组织学及蛋白水平证实ALA增强了HTS的抗氧化能力,抑制瘢痕增生,未对NRF2/ARE通路及相关抗氧化蛋白的基因表达进行深入探究,但仍为后续研究提供了科学依据。
