术前充气加温对胃癌患者围手术期低体温的疗效评价*
2022-08-04陈言例沈玲珊黄志成严明芳
陈言例,沈玲珊,黄志成,严明芳
(福建医科大学附属肿瘤医院/福建省肿瘤医院手术室,福建 福州 350014)
根治性手术是胃癌治疗的重要手段之一,然而,胃血供丰富、淋巴结清扫难度大,切除范围广,术后愈合慢、并发症多[1]。世界卫生组织(WHO)发布手术安全指南明确指出手术期间机体的体温维持正常范围可减少手术后并发症[2]。围手术期内非医疗计划引起机体核心体温<36.0 ℃称为围手术期低体温,又称围手术期意外低体温[3]。围手术期低体温发生率高达50%~70%,引起肌松药代谢率降低、心输出量减少、代谢性酸中毒、凝血功能改变、切口感染率增加、寒战后耗氧量增多、促进去甲肾上腺素释放和心肌缺血[4-5]。
维持围手术期正常体温的最佳方法尚未建立,术前预加温是指至少在患者术前30 min进行预热式主动加温保暖。术前预加温的临床效果存在争议,一项meta分析表明术前预加温降低围手术期低体温的风险[6]。但JO等[7]研究表明术前主动加温无法预防围手术期低体温。了解围手术期低体温及不良影响,并采取有效的预防措施是护士围手术期护理的主要目标。本文探讨了术前充气加温对胃癌患者围手术期低体温的影响,具体报道如下。
1 资料与方法
1.1一般资料 选取2019年3月至2021年4月本院接受手术治疗的胃癌患者,纳入标准:(1)胃癌根治性手术,行静脉复合全身麻醉;(2)年龄≥18岁;(3)术前体温正常;(4)美国麻醉医师协会(ASA)麻醉分级为Ⅰ~Ⅲ级。排除标准:(1)严重心、肺、肝功能异常;(2)甲状腺功能低下;(3)术前凝血功能异常;(4)认知功能障碍。期间共有148例胃癌患者纳入研究,按照随机数表法将其分成研究组和对照组,各74例。
1.2方法
1.2.1干预措施 对照组采用常规护理,具体措施包括:(1)术前告知患者及家属围手术期低体温的发生率高及不良影响,争取其配合;保持术前环境温度(手术等候区及手术室)≥23 ℃。(2)术中使用充气式加温仪进行加温,实时监测患者的体温。湿化加热麻醉气体,腹腔镜手术还需加热气腹。输注的液体及冷藏血制品使用输液加温仪加热至37 ℃;腹腔冲洗液加温至38~40 ℃后使用。(3)术后进入麻醉恢复室继续动态监测体温,覆盖棉毯保温。(4)返回病房后,嘱家属使用温水擦拭四肢,做好保暖措施。研究组在常规护理基础上术前使用充气式加温仪预热至少30 min,在预热期间,询问患者的感受将升温毯调节至最适合患者的温度,保证患者围手术期感受良好的热舒适感。
1.2.2观察指标 (1)体温测量:人体体温分为皮肤体温(指体表温度)和核心体温(指脑、心、肺等深部器官的温度)。患者进入手术室时使用体温枪测量其额头体温作为其体表温度。麻醉后将鼻咽温度作为核心体温的测量部位,测量方法为麻醉诱导气管插管后将体温探头置入患者鼻咽部,深度为耳屏到鼻孔的距离,测量手术开始时、麻醉后60 min、麻醉后120 min及手术结束时的核心温度。(2)凝血功能:术前及术后2 h检验凝血功能,包括凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)。(3)并发症:术后注意观察可能出现低体温症状(寒战)。切口感染根据美国疾病控制和预防中心发布的《手术部位感染预防指南》进行评估[8],出现如下症状即可诊断:①切口及周围组织出现红、肿、热、痛;②切口引流出脓性分泌物;③切口分泌物培养显示病原菌感染。
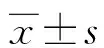
2 结 果
2.12组患者基线资料比较 2组患者性别、年龄、体重指数(BMI)、ASA分级、麻醉时间、手术时间、手术方式、手术切除范围、术中输液量、冲洗液比较,差异均无统计学意义(P>0.05),见表1。

表1 2组患者基线资料比较
2.22组患者不同时间点的体温变化 入手术室时2组患者的体温未见明显差异(P>0.05)。麻醉开始时、麻醉后60 min、麻醉后120 min及手术结束时,研究组患者的核心体温均高于对照组,差异均有统计学意义(P<0.05),见表2。

表2 2组患者不同时间点的体温变化
2.32组患者凝血功能比较 术前2组患者APTT、PT、TT比较,差异均无统计学意义(P>0.05);术后研究组APTT、PT、TT均短于对照组,差异均有统计学意义(P<0.05),见表3。

表3 2组患者凝血功能比较
2.4术后患者复苏时间及低体温、寒战、切口感染发生情况比较 术后研究组围手术期复苏时间短于对照组,低体温、寒战、切口感染发生率均低于对照组,差异均有统计学意义(P<0.05),见表4。

表4 术后患者围手术期复苏时间及低体温、寒战、切口感染发生情况比较
3 讨 论
先前研究表明,术中维持正常体温可使患者的住院时间减少40%,围手术期感染的发生率降低64%,增加患者的满意度和热舒适度[6]。麻醉期间,机体大约90%的热量损失是由皮肤辐射到环境中,使用皮肤保暖方法有效降低热损失[9]。加温措施包括被动加温(棉毯、反光毯)和主动加温(充气加温、加温输液、加温冲洗液)。SHAW等[10]进行meta分析表明,在围手术期主动加温维持患者的体温比被动加温更有效。充气加温是最常用的主动加温方式。先前研究建议术前至少预加温30 min[11],因此,本研究选用术前充气加温≥30 min作为研究方法。
目前部分学者推荐术前需要预加温[12-13],然而与术中加温相比,术前预加温在临床实践中重视程度低,同时,一项研究表明术前预加温对围手术期低体温无效且无法提高术后满意度[14]。本研究中,麻醉开始时、麻醉后60 min、麻醉后120 min及手术结束时,研究组的核心体温均高于对照组,围手术期低体温发生率显著低于对照组,表明术前预加温可有效维持术中体温,降低围手术期低体温的发生,提高患者的舒适度。低温时人体需要骨骼肌的寒战进行产热,因此,本研究中预加温有利于减少寒战的发生。与先前研究一致,GROTE等[15]将7 786例全身麻醉患者进行研究发现,术前预加温患者术中低体温的发生率为15.8%,显著低于未预加温患者的30.4%。MENZEL等[16]将3 228例患者纳入研究表明,仅术中加温比术前结合术中加温术出现围手术期低体温的风险增加1.8倍。LAU等[17]研究显示与单纯术中加温相比,联合进行术前加温出现低体温更少,但在手术部位感染、血细胞比容和术后24 h阿片类药物消耗量未见优势。
术前预加温的作用机制考虑为麻醉诱导后核心体温下降经历3个阶段,分别是急速下降期、缓慢线性下降期和平台期。大部分体温损失发生在第一阶段,占总热量损失的65%,麻醉药物麻痹体温调节中枢,使血管收缩及寒战阈值降低,造成外周血管扩张,机体热量由核心向外周分布,也称为“再分配阶段”[18]。预加温提高体表温度、躯体血管扩张,降低核心组织到外围的温度梯度,减少第一阶段的热量再分布,因此预加温有利于维持术中温度。
本研究中,研究组术后切口感染发生率低于对照组,表明术前预加温有效降低术后切口感染。围手术期低体温造成外周血液循环减少,加重组织缺氧,免疫功能下降,使伤口愈合功能减弱、易受感染[3]。中华医学会外科学分会外科感染与重症医学组发布的《中国手术部位感染预防指南》指出,术中低体温延缓伤口愈合、增加切口感染率,强烈推荐维持围手术期正常温度[19]。低体温导致凝血功能受损、抑制血凝块形成、血栓素A3的合成减少后影响血小板聚集功能[20]。本研究中,研究组术后APTT、PT、TT短于对照组,提示术前预加温有利于保护机体的凝血功能。细胞和酶功能是温度依赖性,活性受温度变化而改变。低温影响麻醉药物的代谢率,延长麻醉药物在体内的代谢时间,因此,本研究中研究组的苏醒时间比对照组长。
总之,围手术期的温度管理是临床工作中的重要挑战,目前体温保护措施可缓解体温降低,但无法完全消除。术前结合术中使用充气加温对改善维持体温、凝血功能、降低术后并发症效果良好。
