肝细胞癌中HP1BP3的表达及其对细胞恶性生物学行为的影响
2022-08-04黄家利王飞通
黄家利,徐 畅,吴 虹,葛 颂,王飞通,牛 坚
肝细胞癌病死率较高[1],预后较差,5年生存率低于5%[2]。早期诊断对提高肝细胞癌患者的总生存率具有重要意义,晚期患者也亟需新的治疗方案。异染色质蛋白1结合蛋白3(heterochromatin protein 1 binding protein 3, HP1BP3)是一种与组蛋白H1有关的蛋白。HP1BP3的染色质结合动力学与H1相似,参与异染色质的合成[3-5]。有研究表明,HP1BP3参与维持异染色质的完整性及细胞周期调控[6]。此外,HP1BP3特异性结合内源性pri-miRNAs,促进人类细胞miRNA的产生[7]。HP1BP3促进肿瘤的发生、发展[8-10]。目前HP1BP3与肝细胞癌的相关性研究较少。本实验利用TCGA数据库分析HP1BP3基因与肝细胞癌的关系,体外细胞实验加以验证,通过GSEA富集分析可能的相关信号通路及机制。
1 材料与方法
1.1 数据采集从TCGA数据库(https://portal.gdc.cancer.gov/)获取376例人肝细胞癌组织和50例正常肝组织的HP1BP3表达数据及相关临床资料,将HP1BP3表达数据与患者临床资料相结合,以HP1BP3表达的中位数为界值,将所有肝细胞癌患者分为高表达组和低表达组进行生存分析。
1.2 细胞培养正常肝组织细胞系LO2、肝癌细胞系HepG2及Huh7购自上海中国科学院类型培养库。所有细胞通过STR图谱进行鉴定。细胞培养在含10%胎牛血清的DMEM培养基中,置于37 ℃、5%CO2孵箱中培养。
1.3 基因沉默HP1BP3 siRNA oligos购自吉玛基因公司(http: //www.genepharma.com)。使用siRNA oligos作为阴性对照。采用riboFECT CP Reagent转染试剂进行瞬时转染。37 ℃孵育,转染24~48 h后进行后续实验,CCK-8、集落形成、侵袭、迁移等功能实验,48 h后提取细胞蛋白,Western blot法检测转染效率。
1.4 CCK-8实验分别将Huh7、HepG2按照1.5×104个/孔接种于96孔板,在5%CO2、37 ℃恒温箱中培养。在每日指定时间点加入CCK-8试剂10 μL,连续4天,在5%CO2、37 ℃恒温箱中孵育2 h后,用Synergy Mx多模式微板仪测定450 nm处的吸光度[12]。
1.5 集落形成试验细胞接种于6 cm培养皿中(2×104个/皿),37 ℃培养2~3周,用PBS洗涤,4%多聚甲醛室温固定1 h,室温下0.1%结晶紫染色30 min,镜下观察。阳性集落形成定义为集落>50个细胞。
1.6 Transwell侵袭、迁移试验将细胞分为两组,侵袭组预涂10 μL Matrigel模拟细胞基底层,迁移组不预涂。将每200 μL含2×104个细胞的无血清DMEM细胞悬液加入上室,下室中加入10%胎牛血清的DMEM。37 ℃孵育48 h后,用PBS冲洗3次,用棉签轻轻擦去上室中的非侵袭性细胞。侵袭细胞加入4%多聚甲醛固定30 min,0.1%结晶紫室温下染色20 min。倒置显微镜下观察,软件计数,随机拍摄。
1.7 免疫组化12例组织切片购自徐州医科大学附属医院(伦理号:XYFY2019-KL129-01),依次经100%二甲苯、梯度乙醇(100%、95%、85%、75%、50%)脱蜡后抗原修复,内源性过氧化物酶封闭。用PBS洗涤3次后,加入一抗HP1BP3(1 mg/mL,稀释500倍)4 ℃孵育过夜,再加入二抗孵育20 min。DAB显色,苏木精复染。切片经50%、75%、85%、95%、100%乙醇和100%二甲苯脱水5 min,中性树胶封固,镜下观察。
1.8 Western blot法用RIPA裂解缓冲液提取各细胞系中蛋白质,用BCA蛋白检测试剂盒测定蛋白质浓度。用7.5%~10% SDS-PAGE凝胶分离蛋白(50 μg),转移到PVDF膜上,室温下用3%牛血清白蛋白封闭缓冲液封闭2 h,加入一抗HP1BP3(1 mg/mL,稀释1 000倍),4 ℃孵育过夜。用1×TBST洗膜10 min,合计3次。室温下将HRP标记的亲和纯羊抗兔IgG(H+L)二抗与膜孵育1~2 h,用TBST洗涤后,用BeyoECL Plus进行检测,化学发光显影。用Image J软件对条带密度进行量化。
1.9 统计学分析应用R包(v3.6.1)对TCGA数据库数据进行统计学分析。采用Wilcoxon signed-rank检验分析HP1BP3在TCGA队列肝细胞癌和正常肝组织中的表达差异。采用Kaplan-Meier生存分析HP1BP3表达与肝细胞癌患者总生存率关系。采用单变量Cox分析来选择可能的预后变量。单因素分析确定的变量P<0.05作为多因素Cox分析的候选变量。采用Cox比例风险模型,通过多因素分析确定独立的预后因素。采用GraphPad Prism 5.01软件中配对t检验对CCK-8实验数据进行两组间对比分析。P<0.05为差异有统计学意义。
1.10 基因富集分析(gene set enrichment analysis, GSEA)使用TCGA队列的GSEA分析确定HP1BP3表达对肝细胞癌预后影响的潜在机制。以分子签名数据库(MSigDB)中的C2(c2.cp.kegg.v7.0.symbs.gmt)作为参考基因集。应用GSEA评估HP1BP3高表达组和HP1BP3低表达组之间的生存差异。每次分析中的基因集排列进行1 000次,若P<0.05则认为基因集显著富集。
2 结果
2.1 TCGA数据库肝细胞癌中HP1BP3的表达及其与患者预后的关系TCGA数据库分析示:肝细胞癌组织中HP1BP3表达较癌旁正常组织显著上调(P<0.001,图1A)。HP1BP3高表达患者总生存期较低表达组低(P=0.029,图1B),提示HP1BP3表达与患者预后相关。Cox单因素分析示:Stage分期、T分期、M分期和HP1BP3表达是影响肝细胞癌患者预后的因素(P<0.05)。Cox多因素分析示:HP1BP3表达是肝细胞癌患者总生存期的独立预后因素(表1)。
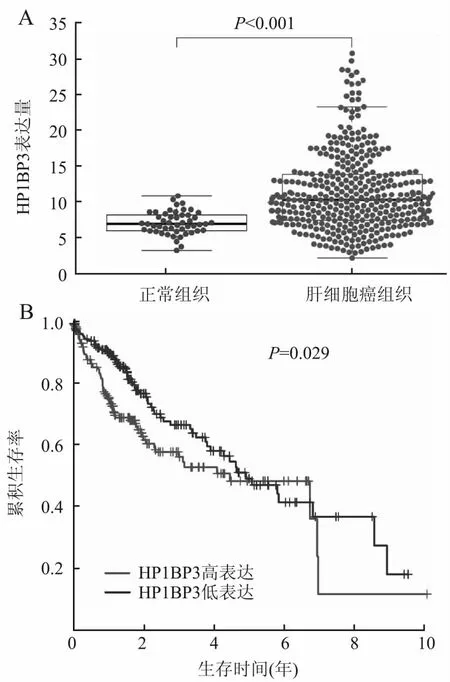
图1 A.TCGA数据库分析HP1BP3在肝细胞癌组织和癌旁正常组织中的表达;B. HP1BP3表达与肝细胞癌患者预后的关系
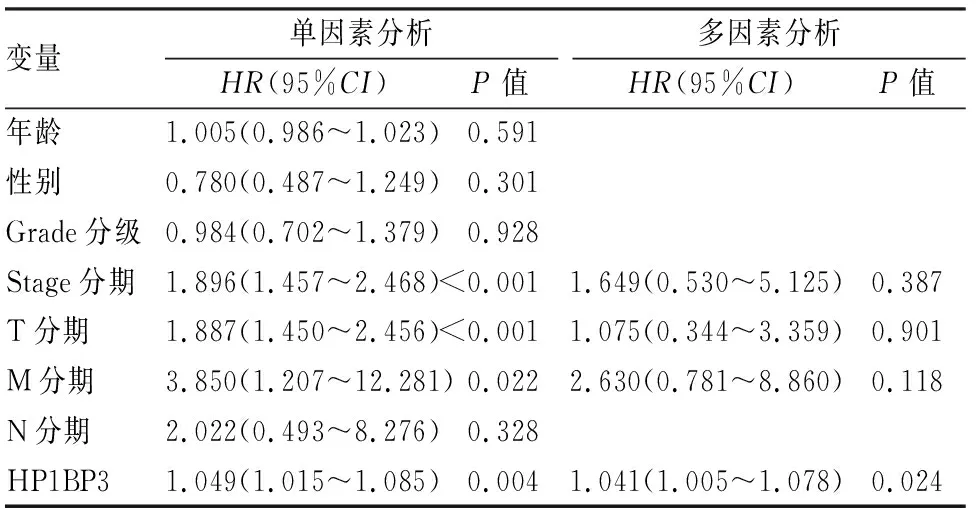
表1 单因素和多因素Cox回归分析
2.2 HP1BP3在体外肝癌细胞系及肝癌组织中的表达差异应用Western blot和免疫组化法分别检测细胞及组织中HP1BP3蛋白的表达,结果显示,肝癌细胞系中HP1BP3蛋白表达高于正常肝细胞系(P<0.001,图2A);免疫组化结果显示:HP1BP3阳性9例,阴性3例,阳性组癌组织较癌旁组织棕黄色染色深,两者免疫组化评分有差异(图2B)。
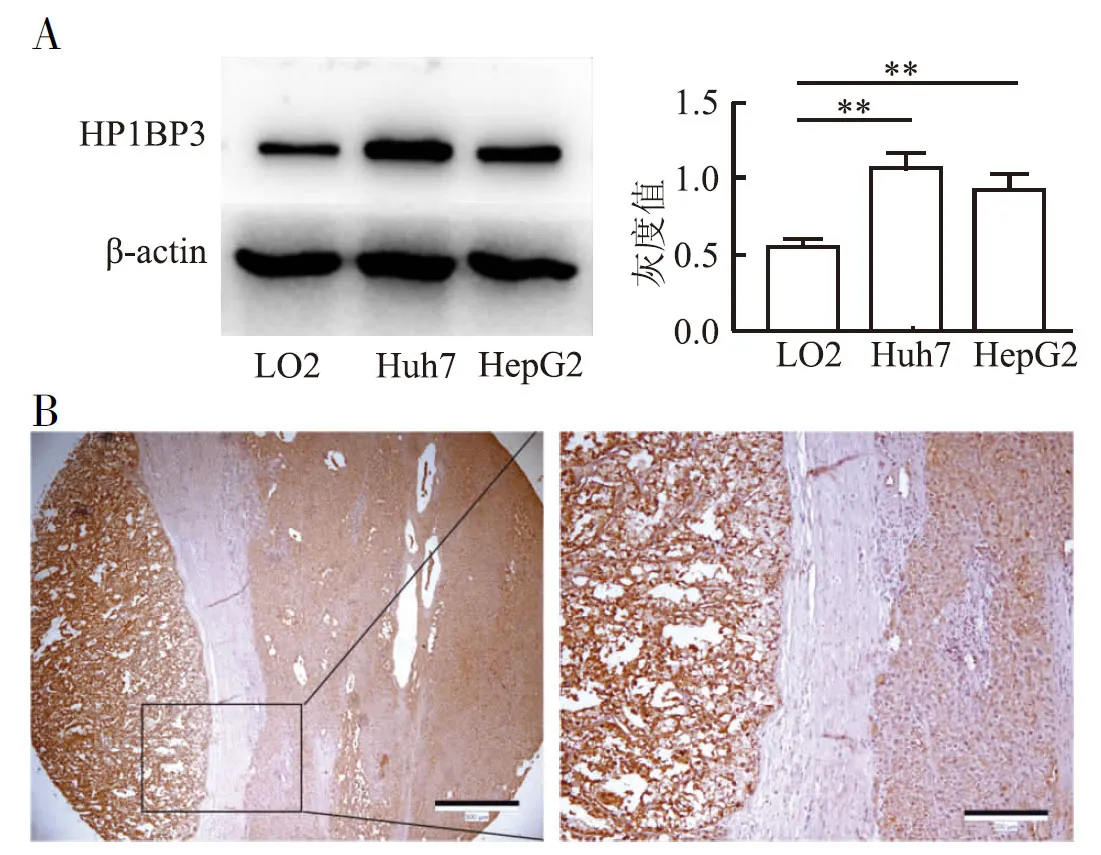
图2 A.Western blot法检测HP1BP3在肝细胞株中的表达:**P<0.001;B.免疫组化检测HP1BP3蛋白在肝细胞癌组织中高表达,较癌旁正常组织表达高,表达定位于细胞核,PV两步法
2.3 沉默HP1BP3对人肝癌细胞增殖、侵袭和迁移的影响分别转染HP1BP3 siRNA至Huh7、HepG2细胞中以沉默HP1BP3表达,应用Western blot法检测转染效率,转染HP1BP3 siRNA的肝癌细胞中HP1BP3表达降低,证明转染成功(P<0.05,图3)。细胞功能实验结果:CCK-8(图4A)和集落形成实验(图4B)表明,沉默HP1BP3后的细胞增殖率和细胞存活率均低于对照组(P<0.05);Transwell图像及定量分析表明,与对照组相比,沉默HP1BP3后Huh7、HepG2细胞的迁移、侵袭能力受到抑制(图5)。上述实验表明,沉默HP1BP3可显著抑制肝癌细胞的增殖、侵袭和迁移。

图3 Western blot法验证Huh7(A)、HepG2(B)中HP1BP3 siRNA的转染效率
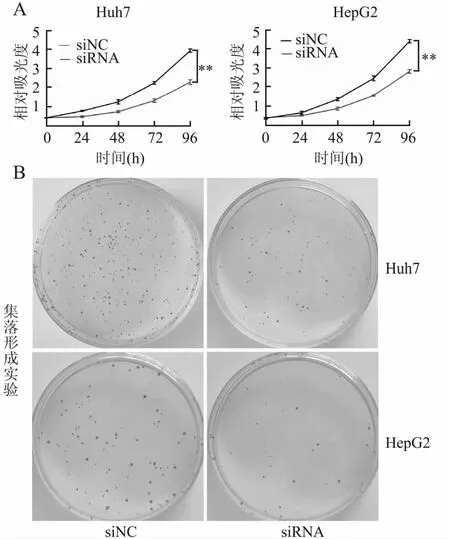
图4 A.CCK-8实验:沉默HP1BP3后实验组Huh7、HepG2细胞较对照组细胞增殖能力降低,**P<0.001;B.集落形成实验:沉默HP1BP3后实验组Huh7、HepG2细胞较对照组细胞增殖能力降低,同CCK-8实验结果相一致
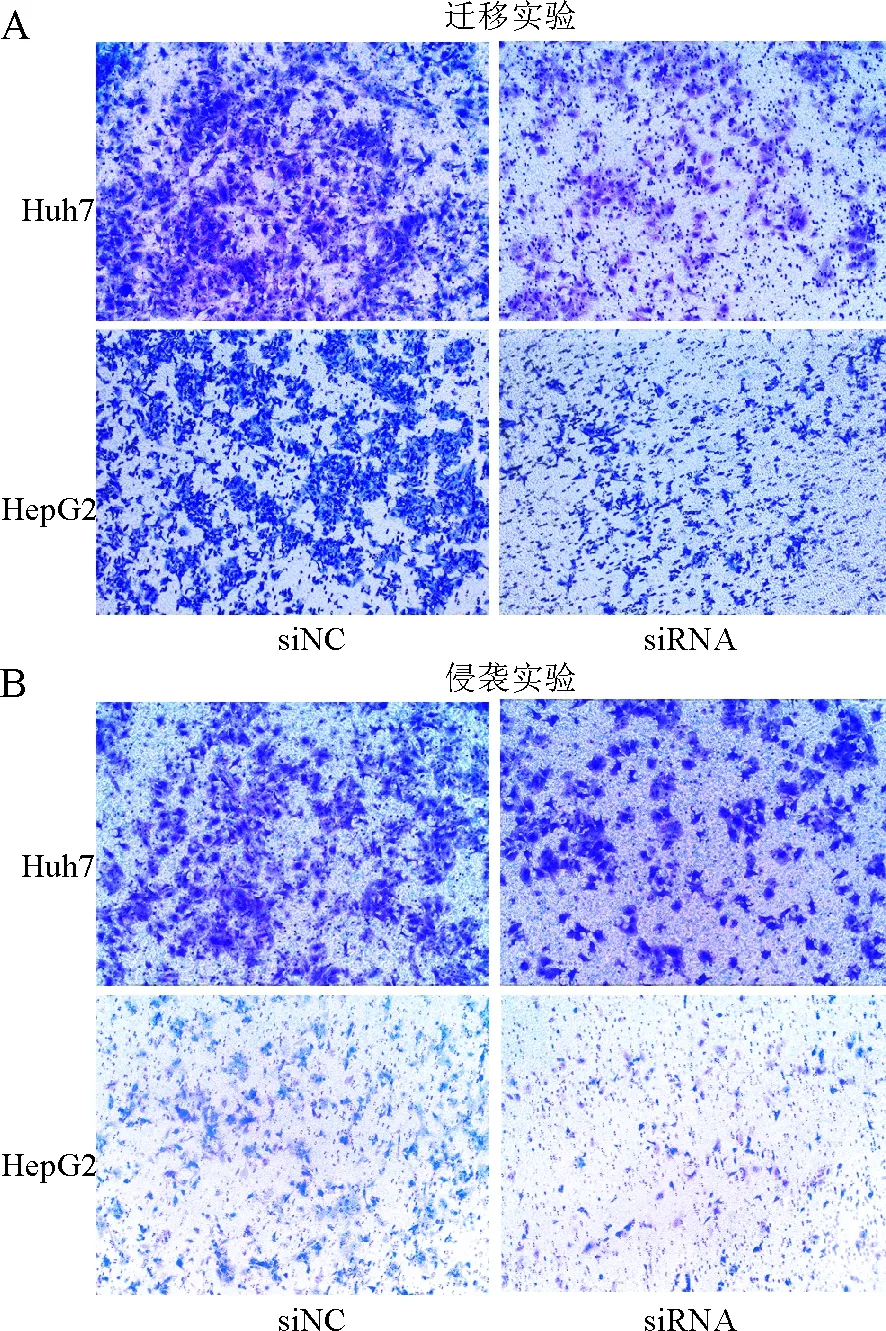
图5 A.迁移实验:沉默HP1BP3后实验组Huh7、HepG2细胞组较对照组细胞穿过小室聚碳酸酯膜数量少,细胞迁移能力降低;B.侵袭实验:沉默HP1BP3后实验组Huh7、HepG2细胞较对照组细胞穿过基底胶数量少,细胞侵袭能力降低
2.4 GSEA筛选肝细胞癌中HP1BP3相关信号通路通过GSEA对HP1BP3高表达进行富集分析,识别肝细胞癌中激活的信号通路,结果显示在泛素化、核酸切除修复、RNA降解、ERBB信号通路、细胞周期、细胞凋亡通路中,HP1BP3高表达富集(表2)。
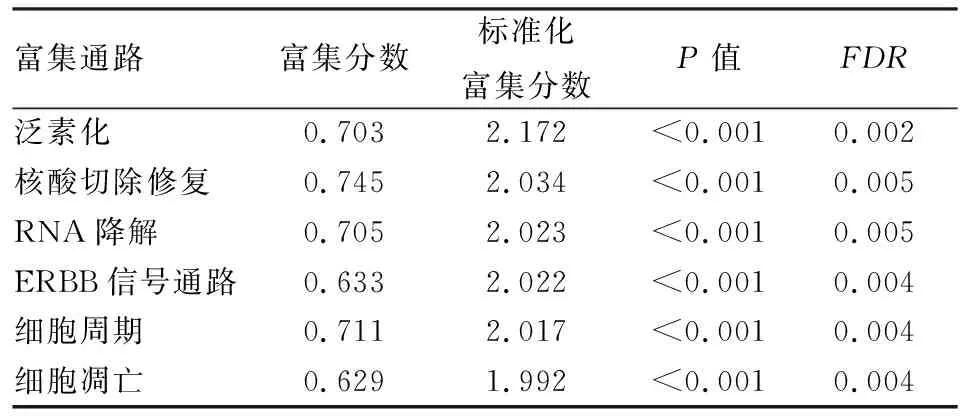
表2 表型高度富集的基因集
3 讨论
P1BP3是细胞生长发育不可或缺的组成部分。分。Garfinkel等[4]指出,HP1BP3是H1组蛋白多基因家族成员,广泛存在于组织和细胞胞核中,以异染色质蛋白1(heterochromatin protein 1, HP1)依赖性方式参与异染色质的合成,HP1BP3缺失影响蛋白的表达。另有研究证实,HP1BP3可以维持异染色质完整性,通过促进G1-S转变参与细胞周期的调控[6],HP1BP3在G1-S进展期间通过将常染色质和异染色质相互转化来激活或沉默特定基因,从而调节G1期的染色质结构以维持细胞周期进程。除此之外,Liu等[7]通过细胞机制研究发现,HP1BP3可以特异性结合内源性pri-miRNAs,促进体内DROSHA/pri-miRNA的结合,从而促进人类细胞miRNA产生,HP1BP3缺失则导致pri-miRNAs从染色质中过早释放,破坏pri-miRNA的加工。以上研究揭示了HP1BP3的基础功能,但其与临床的联系及意义少有报道,本文采用TCGA数据库收集临床数据,通过检验分析发现HP1BP3与肝细胞癌相关,且在肝细胞癌组织中高表达;生存分析显示,HP1BP3低表达组较HP1BP3高表达组生存期长,单因素及多因素分析发现HP1BP3是肝细胞癌的独立预后因素。以上表明HP1BP3与肝细胞癌发生、发展密切相关。
有研究证实,HP1BP3是肿瘤发生发展的促进因素,有促进癌细胞活力、自我更新和治疗抗性作用[8-9]。已有研究发现,HP1BP3在食管癌中可通过上调miR-23a靶向TRAF5促进肿瘤生长和转移[10]。然而,目前尚未见其在肝细胞癌中的研究报道。本实验通过体外细胞实验及免疫组化检测发现,HP1BP3在癌细胞中表达较正常细胞增多,同时在癌组织中表达量较癌旁组织明显增高,验证了数据库的分析结果。进一步通过调低细胞中HP1BP3基因表达作为实验组,在功能实验中发现,实验组细胞相较于对照组在细胞增殖、迁移和侵袭方面均明显减弱,这表明HP1BP3可以促进肝癌细胞的恶性行为,或许可以作为筛查肝细胞癌、预测肝细胞癌患者预后及治疗靶点的潜在指标。
本组通过查阅文献发现,HP1BP3可以通过调节内分泌IGF-1成分的转录对机体生长和骨骼发育起关键作用[11]。同时有研究证实,HP1BP3参与维持异染色质完整性,通过促进G1-S转变参与细胞周期调控[6],HP1BP3在G1-S进展期间通过将常染色质和异染色质相互转化来激活或沉默特定基因来调节G1期的染色质结构以维持细胞周期进程。有研究发现HP1BP3与认知及细胞衰老相关[12-14]。本组通过GSEA[15]筛选出与HP1BP3高表达可能相关的泛素化、核酸切除修复、RNA降解、ERBB信号通路、细胞周期、细胞凋亡通路。上述结果可与已有报道相印证,作为后续HP1BP3机制研究的依据,可以以细胞周期及细胞凋亡[16]为切入点探究其影响肝细胞癌发生发展的机制,为HP1BP3基因的深入研究提供参考。
综上,HP1BP3可以促进肝细胞癌的发生发展,是影响肝细胞癌预后的独立危险因素。此外,HP1BP3在肝细胞癌中可能参与了泛素化、核酸切除修复、RNA降解、ERBB信号通路、细胞周期、细胞凋亡通路,可作为下一步研究方向的参考。本实验仍存在不足之处,数据分析未从多个数据库联合验证,体外实验未进行恢复验证,未来可以从多数据库联合分析,调低目的基因后再进行恢复验证。
