伤口修复中抑制瘢痕用功能敷料的研究进展
2022-08-04宋子钰赵居阳黄小睿
宋子钰, 赵居阳, 秦 玥, 黄小睿, 高 晶,2, 王 璐,2
(1. 东华大学 纺织学院, 上海 201620; 2. 东华大学 纺织行业生物医用纺织材料与技术重点实验室, 上海 201620)
皮肤是人体与外部环境之间的界面,对人体组织和器官起着必要的保护作用,常受到烧伤、烫伤、割伤等外部伤害。当皮肤受到损伤时,会发生一系列的反应进行伤口修复,这是一个动态连续而又复杂的过程,主要分为炎症期、增殖期和重塑期3个阶段。修复的各个阶段并不独立进行,而是相互重叠,各种组织和细胞之间有着复杂而有序的相互作用[1]。同时,许多细胞因子、生长因子和蛋白酶都与伤口修复过程密切相关[2]。皮肤瘢痕则是组织受伤后修复的最终结果[3]。
瘢痕组织是由肉芽组织转化而来的纤维结缔组织,含有大量平行的胶原纤维束或杂乱无序的纤维网络,不包含毛囊、皮脂或者汗腺,缺乏正常皮肤的复杂网纹结构,这极大地降低了瘢痕的弹性和应力[4-5]。据报道,瘢痕组织的抗张强度只有原始皮肤的70%左右,极易受到二次伤害[3,6]。此外,瘢痕组织虽然能够将损伤的伤口填补并连接起来,保持皮肤组织的完整性,但是却存在瘢痕的收缩和产生增生性瘢痕等问题[7]。瘢痕收缩通常发生在人体关节处,会造成患者的行动受限[8-9]。而增生性瘢痕是瘢痕组织过度增生的结果,其主要特征为纤维化和细胞外基质蛋白的过度沉积[7,10-11]。增生性瘢痕多发生在深部创伤、严重烧伤或手术切口后,导致患者较大程度的美容缺陷和功能损害,因此,无论是在外观,还是在生物学功能方面,皮肤瘢痕都会给患者带来沉重的心理负担和身体健康隐患。
近年来,人们在积极寻找各种治疗皮肤瘢痕的方法,包括压力治疗、激光治疗、手术矫正、注射药品等[12-14],但这些方法存在压力治疗疗效低,激光产生热伤害及需要疗后护理,手术矫正后复发率高,药品多次注射带给患者巨大痛苦等诸多问题[13-14]。相比之下,功能敷料可在伤口愈合的早期介入,通过不同的释药系统降低炎症反应,调节与瘢痕形成有关的各生长因子和细胞因子表达的效果,且为伤口愈合提供物理支撑以及无疤愈合所需的湿润环境,从而在根本上预防瘢痕的生成。瘢痕形成涉及伤口愈合全过程,功能敷料在任一阶段的干预都会影响皮肤瘢痕的产生。单一功能的伤口敷料,尤其是用于抗菌和促进伤口愈合的敷料,都表现出了一定的瘢痕抑制效果。本文通过对近年来用于抑制皮肤瘢痕的功能敷料的研究进行总结,期望为未来设计和开发更加有效地抑制瘢痕的敷料提供参考。
1 基于降低炎症反应的抑疤敷料
皮肤受伤后,由于细菌和微生物等侵入引起伤口的炎症反应(见图1),此时单核细胞、中性粒细胞、巨噬细胞等炎症细胞富集到创伤区域,通过分泌蛋白酶和吞噬作用进行杀菌和降解坏死组织,同时分泌高水平的促炎因子[4,7]。这些促炎因子通过激活成纤维细胞促进瘢痕组织形成,且促炎因子的持续高表达也会募集并激活更多的炎症细胞[15-16]。炎症反应是皮肤受到损失后的正常反应,但过度的炎症反应会促进成纤维细胞的过度增殖和其细胞产物的增多,从而加重瘢痕的形成[17-18]。有研究从另一方面证实,减少局部单核细胞和巨噬细胞的形成会显著抑制成纤维细胞的过度增殖和伤口瘢痕组织纤维化[4],因此,减少细菌对伤口的感染,降低炎症反应有利于抑制皮肤瘢痕的形成。Sadiya等[19]在棉织物表面涂层壳聚糖(CS)/聚乙二醇(PEG)/聚乙烯吡咯烷酮(PVP)水凝胶,并加入盐酸四环素(TC),设计开发了一种抗菌并能够预防瘢痕的创面敷料CPPC-TC。经研究发现:该敷料48 h的TC累积释放率为80%,其对革兰氏阳性菌和革兰氏阴性菌均表现出良好的抗菌特性;与无TC的敷料对照组相比,经CPPC-TC处理的伤口的瘢痕面积由原来的10.7%降低到0.33%。
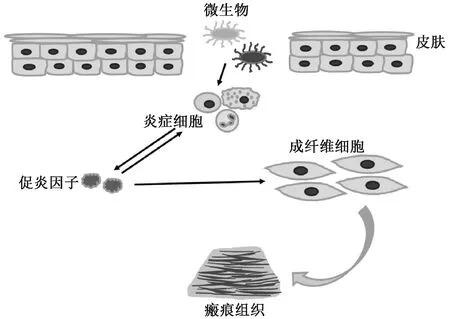
图1 炎症反应对瘢痕形成的影响机制
在皮肤受到严重创伤后,伤口组织会因缺乏氧气而导致炎症反应的增强,此时会产生过量的活性氧(ROS),引起氧化应激反应,对周围的正常细胞环境和成纤维细胞造成伤害[20-21]。Vivek等[20]将具有抗氧化性的姜黄素和铈Ce3+用于静电纺敷料中,由于姜黄素和铈Ce3+具有双重抗氧化性,使得伤口中的超氧化物歧化酶(SOD)和过氧化氢酶的水平提高,ROS水平降低,有效减弱了氧化应激反应。将该敷料应用于大鼠全层伤口中,显示出完全愈合和重新上皮形成,且没有观察到瘢痕的生成。
2 基于调控信号传导的抑疤敷料
增殖期是控制伤口瘢痕形成的关键时期。在这个阶段角质形成细胞增殖,表皮层重建,皮肤再上皮化;肉芽组织形成,包括新血管生成和纤维增生,以填补伤口和恢复皮肤的基本功能。这些过程涉及多种细胞的生理活动和细胞间的信号传导,尤其值得注意的是,成纤维细胞生理活动的任何异常都将导致皮肤瘢痕的产生[22]。
2.1 通过角质形成细胞进行的信号调控
角质形成细胞位于表皮的最上层,是表皮的主要构成细胞。外界环境的变化可直接影响角质形成细胞的生物学行为,其中伤口愈合环境中水分的变化是角质形成细胞信号传导的关键影响因素。Xu等[23]研究发现,伤口中水分减少会导致皮肤局部的钠浓度发生变化,位于角质形成细胞表面的钠通道检测到这一变化,从而引起信号通路的改变。受胎儿无疤伤口愈合的启发,人们认为胎儿的无疤愈合得益于其水合良好,即湿润的环境[24]。Zhao等[25-26]研究发现,伤口水分减少会促使角质形成细胞分泌HMGB1和S100A12蛋白,其通过RAGE、TLR2、TLR4等受体刺激MRTF-A/SRF信号轴,从而激活成纤维细胞,使得胶原纤维密度增加形成增生性瘢痕,因此,在研究设计抑制瘢痕的功能敷料时,必须考虑敷料的吸水性和保湿性,以维持伤口表面湿润的愈合环境。
自20世纪50年代以来,伤口湿润环境愈合理论便被研究者们提出并逐渐完善,湿性敷料也迎来了迅速发展阶段[27]。目前,所用较多的湿性敷料主要有水凝胶类、海绵类、亲水性纤维类等,常用到的生物材料有壳聚糖、藻酸盐类、丝素蛋白、明胶等。水凝胶是一种具有三维网络结构的新型功能高分子材料,具有亲水基团,能被水溶胀但不溶于水,因此,水凝胶制备医用敷料具备保持创面湿润的特性[28]。有研究证明,壳聚糖/明胶水凝胶能够促进成纤维细胞增殖、胶原蛋白合成和新血管形成,从而在较早的肉芽组织形成和再上皮形成过程中促进皮肤伤口的正常愈合[29]。
壳聚糖是甲壳素的N-去乙酰化衍生物,存在于壳聚糖中的N-乙酰氨基葡萄糖是皮肤组织的主要成分,对于瘢痕组织的愈合起着至关重要的作用[30]。Wang等[31]研究发现,不同形态羧甲基壳聚糖(CMCS)敷料对瘢痕的抑制机制和效果有所差异。由于具有多孔结构和更多的生物活性结合位点,CMCS海绵具有良好的吸水性和促进成纤维细胞增殖的作用,其转化生长因子TGF-β1和α-平滑肌肌动蛋白(α-SMA)在创面愈合过程中的表达最高;而CMCS水凝胶和CMCS膜则有利于刺激MMP-1的表达,从而抑制瘢痕生物形成和促进真皮的正常愈合。
2.2 阻断TGF-β/Smad信号传导
转化生长因子TGF-β是影响瘢痕形成的关键活性因子[1]。TGF-β有多种亚型,其中TGF-β1和TGF-β2通过与受体复合物结合磷酸化Smad2和Smad3蛋白,磷酸化的Smad2和Smad3与Smad4形成二聚体转移到细胞核中,作为转录因子发挥作用,从而促进瘢痕的形成,其信号通路如图2所示。此外,TGF-β1还通过诱导Smad3转录蛋白,激活Wnt信号通路增强瘢痕的生成;而TGF-β3作为受体拮抗剂,可以阻断信号传导,从而减少瘢痕形成[1,7,32]。TGF-β/Smad信号传导的失调会刺激结缔组织生长因子的表达,成纤维细胞持续活化会导致胶原合成和沉积的异常,最终Ⅰ/Ⅲ型胶原比例增加以及异常交联的胶原纤维束形成,可加重瘢痕的产生和纤维化[3,32],因此,目前的研究大多针对阻断TGF-β/Smad信号的传导以减轻或抑制皮肤瘢痕的形成。Wang等[33]将SB-525334(小分子TGF-β1抑制剂)负载到聚己内酯(PCL)/明胶静电纺纳米纤维支架上以控制瘢痕的增生,实验结果显示瘢痕表皮基底层变平,真皮层与健康皮肤组织相似,且Ⅰ型胶原水平显著降低,胶原蛋白沉积正常,增生性瘢痕得到有效控制。人参皂苷Rg3是人参的生物活性成分,该成分可通过阻断TGF-β/Smad信号通路抑制瘢痕成纤维细胞的增殖、血管的过量生成和胶原蛋白的过度合成,从而抑制瘢痕的产生[34]。Cui等[35]将人参皂苷Rg3(G-Rg3)以无定形状态掺入到聚(L-乳酸)(PLLA)纤维中,制备了静电纺G-Rg3/PLLA纤维支架。与不负载G-Rg3的支架相比,G-Rg3/PLLA静电纺纤维支架通过减少真皮层厚度、增生性瘢痕成纤维细胞的增殖和胶原纤维密度等,有效抑制了增生性瘢痕的形成。Faraz等[36]利用具有降低TGF-β1表达作用的盐酸二甲双胍制备了静电纺支架,结果显示盐酸二甲双胍的局部给药显著降低了瘢痕相关标记物(Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、纤连蛋白、α-SMA以及TGF-β1)的基因表达,从而减少了瘢痕的形成。
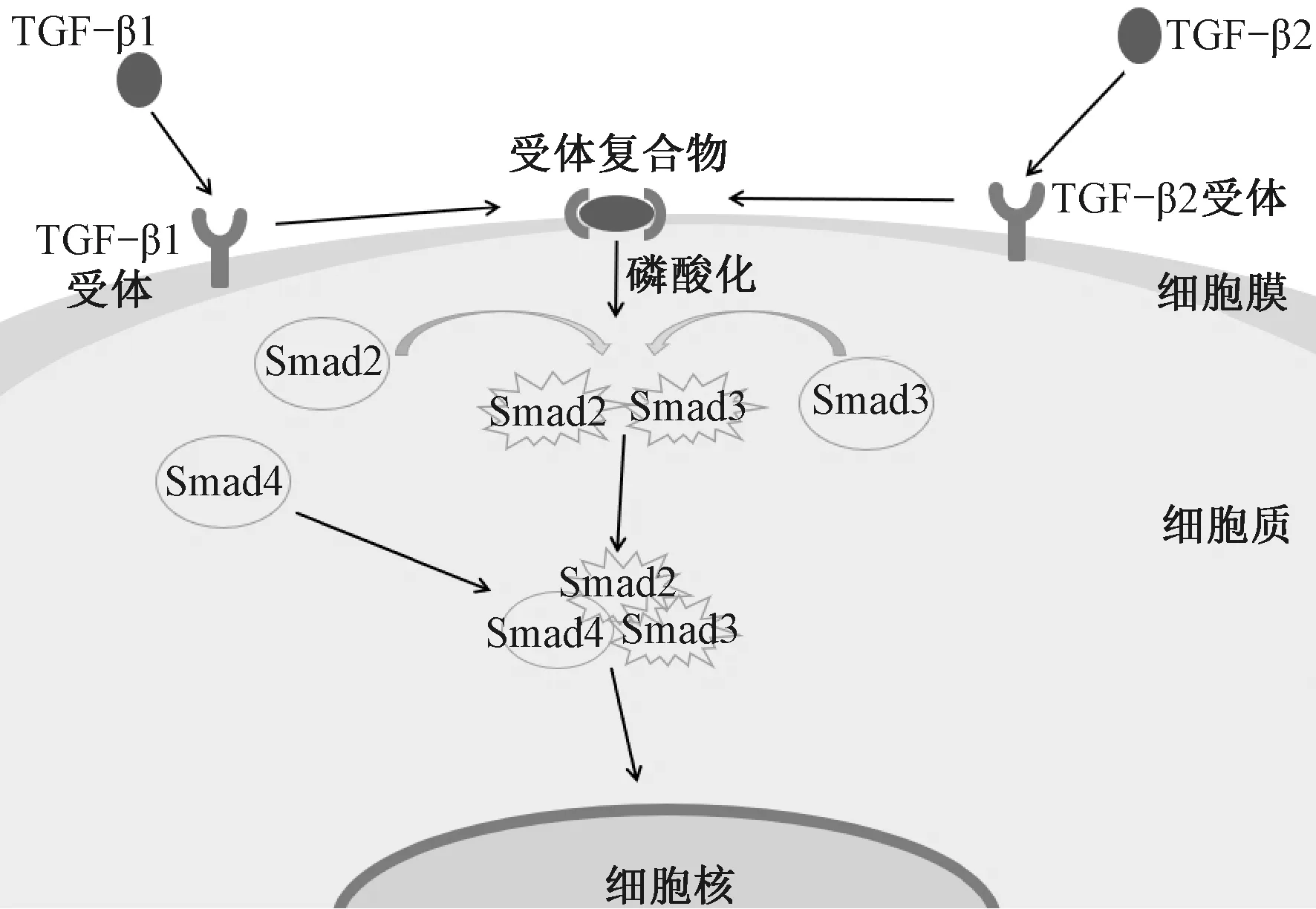
图2 TGF-β/Smad信号通路
3 基于促进组织再生的抑疤敷料
重塑期是瘢痕的形成时期,在瘢痕形成过程中,肉芽组织水分吸收减少,血管逐渐退化,胶原纤维量增多并发生玻璃样变性,从纤维结缔组织转变为瘢痕组织[7]。皮肤在伤口愈合过程中很多组分会发生变化。其中,瘢痕组织的形成过程主要包括3个方面的变化:一是成纤维细胞向肌成纤维细胞的分化,其标志是α-SMA的生成;二是细胞外基质含量和组分发生变化,主要表现为胶原蛋白等物质的过度沉积和胶原蛋白类型的转变。其中,胶原蛋白的过度沉积是瘢痕增生的主要原因,而Ⅰ型胶原蛋白是伤口瘢痕的主要成分[4,37];三是血管和皮肤附属物的缺失,瘢痕组织缺少正常皮肤组织所包含的血管、皮脂、毛囊以及汗腺等成分。如何控制瘢痕组织中各组分的转变及其含量的变化,促进皮肤组织再生,是控制皮肤瘢痕产生的重点。
3.1 控制成纤维细胞的增殖分化
α-平滑肌肌动蛋白(α-SMA)不仅是皮肤愈合过程中成纤维细胞活化的主要标志物,也是具有收缩特性的肌成纤维细胞的典型标志物,能够将伤口边缘连接在一起产生收缩反应[38],因此,过多α-SMA的产生,意味着成纤维细胞的过度增殖分化和肌成纤维细胞的过度生成,使伤口组织收缩过度。细胞外基质(ECM)是在成纤维细胞向肌成纤维细胞分化的过程中产生的[39]。过多的蛋白质生成和较少的胶原降解,导致了ECM在皮肤组织中含量过高,从而表现为皮肤组织变厚,这与成纤维细胞的过度增殖和胶原酶数量减少或活性降低有关。MG53是具有多种生物功能的TRIM家族蛋白,可以通过促进细胞膜修复和控制成纤维细胞向肌成纤维细胞分化,来促进伤口愈合并减少瘢痕的形成[39]。Li等[40]将重组人源蛋白rhMG53封装在热敏水凝胶中,与无rhMG53的对照组相比,用rhMG53处理的成纤维细胞中α-SMA和ECM成分的表达降低,且用rhMG53水凝胶治疗的大鼠瘢痕明显减少。
3.2 调节ECM的变化
ECM作为皮肤细胞生存的微环境,还与细胞的基本生命活动密切相关。其中,ECM组分可调节生长因子的释放、组织病理改变和炎性应答等过程,是决定皮肤修复质量的关键因素之一[41]。在瘢痕生成过程中,ECM组分的主要变化是Ⅲ型胶原的减少和Ⅰ型胶原的增多。Ⅰ型胶原分泌过多会导致纤维结构紊乱和增生性瘢痕形成,而Ⅲ型胶原在创面修复中起到构建桥梁的作用,随后生成的Ⅰ型胶原可以沿Ⅲ型胶原方向有序排列,形成稳固的支架,从而促进创面的无瘢痕愈合[42]。足够含量的Ⅲ型胶原蛋白是一种可以阻止瘢痕形成的调节剂。Yalman等[43]将腐殖酸和藻酸盐交联制备水凝胶伤口敷料,经测试发现这种敷料可抑制Ⅰ型胶原的过度表达,并刺激Ⅲ型胶原的表达,具有促进伤口创面无瘢痕愈合的潜力。
此外,瘢痕组织中存在大量平行排列的胶原纤维束。胶原纤维是由胶原蛋白在细胞外聚合交联而成的纤维组合物[44]。粗大的Ⅰ型胶原纤维质地坚硬而没有弹性,是瘢痕组织纤维化的物质基础[42]。而胶原酶可以降解瘢痕组织中的胶原纤维,起到减少和软化瘢痕的作用。曲安奈德(TA)是一种常用的治疗皮肤瘢痕的糖皮质激素,具有抑制成纤维细胞增殖和增加胶原酶合成的作用[13]。Lin等[13]使用可溶性微针系统将TA进行透皮给药,结果证实TA能够加速Ⅰ型胶原的降解,并抑制成纤维细胞的增殖,促进成纤维细胞的凋亡,从而使伤口愈合良好,无明显瘢痕生成。
3.3 促进血管和皮肤附属物的生成
瘢痕组织的生物学功能丧失还表现在不存在血管以及不包含毛囊、皮脂和汗腺等皮肤附属物。观察伤口无疤愈合,不仅要观察其宏观形貌下无瘢痕形成,更要关注皮肤组织的功能再生,即组织中是否有血管和皮肤附属物等的生成。Zhang等[45]通过加入共价交联剂,对壳聚糖水凝胶的阳离子性质进行调节发现,经5%CMCS处理的伤口在第14天形成了具有正常组织(包括皮脂腺和毛囊等)的真皮结构。此外,这项研究还设计了5%CMCS/芦荟复合敷料,发现加入芦荟的CMCS水凝胶进一步增强了对伤口愈合过程中肥厚性瘢痕形成的抑制作用。此外有研究发现,黄芪甲苷Ⅳ可以通过刺激核仁细胞的增殖和迁移,促进新血管的形成以及平衡胶原蛋白的合成,从而显著促进伤口的再上皮化、血管生成和调节细胞外基质的重塑[46]。Chen等[47]通过溶剂蒸发法制备固体脂质纳米颗粒(SLN)作为黄芪甲苷Ⅳ的药物载体,并将SLN分散体嵌入到水凝胶中。该水凝胶明显促进了角质形成细胞的增殖和迁移以及体外成纤维细胞的药物吸收,通过维持Ⅲ型胶原与Ⅰ型胶原的生成比例,使修复后的创面具有显著的血管生成功能,以及很好的伤口愈合和抗瘢痕效果。Shan等[48]通过静电纺技术制备了载有黄芪甲苷Ⅳ的丝素蛋白/明胶纳米纤维敷料,丝素蛋白/明胶纤维膜可模仿细胞外基质的结构和组成,该敷料处理的伤口能够较快地愈合,且再生皮肤中有大量血管生成,皮肤愈合处胶原蛋白的沉积也与正常皮肤相似,表现出了良好的抗瘢痕特性。
碱性成纤维细胞生长因子(bFGF)在伤口愈合的增殖期和重塑期对瘢痕形成都有着重要影响。bFGF通过抑制TGF-β/Smad信号通路以减少瘢痕形成并促进伤口愈合。此外,bFGF还通过干扰胶原分布和α-SMA的表达来调节ECM的合成和降解[49]。Cheng等[50]制备了载有bFGF的表面生物功能化载药静电纺纤维支架(P-Rg3-P-bFGF),P-Rg3-P-bFGF在第14天的伤口愈合率明显高于其他未改性支架,伤口几乎愈合,并完全重新上皮化,瘢痕增生性指数也明显降低。
针对皮肤伤口愈合的3个阶段,功能敷料分别通过降低炎症反应、调控信号传导和促进组织再生的作用机制来抑制瘢痕的产生,其总结如表1所示。用于抑制皮肤瘢痕的功能敷料,不仅包含了针对某一特定机制的单一作用敷料,而且还有多药物负载发挥多重作用的多功能敷料。虽然出自不同的考虑,但都经过对瘢痕形成机制的深入研究,并对所用聚合物进行了优选和设计,期望达到更好的瘢痕抑制效果。但是,当前用于抑制瘢痕的功能敷料都缺乏对瘢痕形成机制的综合考虑以及瘢痕抑制效果的全面系统的表征。

表1 伤口愈合各阶段的抑制瘢痕措施
4 结束语
通过上述内容分析不难发现,用于抑制皮肤瘢痕的功能敷料,往往是基于研究者们对于瘢痕形成机制的研究,然后根据某一机制或者几种机制对敷料进行材料优选和结构设计。由于瘢痕形成是一个动态复杂的过程,涉及许多信号传导和蛋白质表达的过程,所以到目前为止对于瘢痕形成的机制并没有达到完全的掌握和理解。功能性抑疤敷料的设计和表征也不尽完善,抑制瘢痕的治疗效果受到很多因素限制。除此之外,功能敷料想要达到更好的瘢痕抑制效果,需要多重药物的负载,包括激素、中草药以及生物活性成分等。不同药物的负载,需要考虑其载药形式、释放顺序以及释放速率等问题,给药系统与敷料结构的配合也应该具有持续有效的作用效果,因此,未来在开发和设计抑疤敷料时,不仅要综合考虑影响瘢痕形成的因素,也要注重新型给药系统的研究和敷料结构的优化利用。
