四妙勇安汤通过拮抗Ox-LDL 脂代谢途径对ApoE-/-小鼠动脉粥样硬化颈动脉斑块的影响
2022-08-04许心蕊金秋硕孙克寒杨漫芳张晴玥娄利霞吴爱明
高 照,许心蕊,金秋硕,孙 浩,孙克寒,杨漫芳,张晴玥,李 洋,娄利霞,吴爱明,聂 波,
(1.北京中医药大学东直门医院中医内科学教育部和北京市重点实验室,北京 100700;2.北京中医药大学东直门医院病理科,北京 100700;3.北京中医药大学中药学院,北京 100029)
动脉粥样硬化(atherosclerosis,AS)是心血管和脑血管等危险事件发生的病理学基础[1]。AS 是由脂代谢紊乱、氧化应激因素、炎性刺激以及内皮细胞功能障碍等多因素相互作用而成[2]。在AS 病理进程中,氧化型低密度脂蛋白(Oxidized Low Density Lipoprotein,Ox-LDL)可通过影响脂代谢加重AS,是导致AS 病变的独立危险因素[3,4]。在巨噬细胞(macrophages ,Mφ)中,脂肪酸结合蛋白4(Fatty acid binding protein 4,FABP4)过多能加剧Mφ 脂质的吞噬,而当FABP4 缺乏,可促进胆固醇从Mφ 内向外流出[5,6]。过氧化物酶体增殖物激活受体γ(Peroxisome proliferators-activated receptors γ,PPARγ)是介导胆固醇和游离脂肪酸从细胞内流向细胞外的关键受体,其主要是通过促进胆固醇的逆向转运途径达到防治AS 的目的[7]。基质金属蛋白酶(Matrix metalloproteinases,MMPs)在AS 病变的全过程,特别是在导致AS 斑块不稳定性增加中起着主要的作用。其中,MMP-2 能降低AS 斑块处胶原纤维、使其纤维帽变薄,不稳定增加,是用来评估AS 斑块不稳定性的关键因子[8]。
新近研究表明,Ox-LDL 通过诱导FABP4 的产生,使 斑 块 不 稳 定 性 增 加[5,6,9]。同 时,FABP4 能 抑制PPARγ 的表达导致脂质合成增加,引起脂质代谢紊乱,导致AS 发展[10,11]。本研究团队前期实验发现四妙勇安汤能抑制多种炎症因子减轻血管内膜炎症反应,减少AS 斑块面积,使斑块不稳定性下降;但同时发现四妙勇安汤不具有降低血脂的作用[12,13],是否能够通过减少Ox-LDL 发挥抗AS 作用及其机制尚不清楚。因此,本研究旨在从调控Ox-LDL、FABP4、PPARγ 脂代谢途径,探讨四妙勇安汤对AS 颈动脉斑块稳定性的影响及作用机制。
1 材料与方法
1.1 一般材料
1.1.1 实验动物与饲料 ApoE-/-小鼠由北京维通利华实验动物中心购入[许可证号:SCXK(京)2016-0006],鼠龄为7 w,体重(20±2)g。在室内温度(20±2)℃、相对湿度50%、交替明暗为每12 h 一次的北京中医药大学东直门医院屏障级动物房(动物房编号:SYXK(京)2015-0001)饲养,期间对于小鼠摄食、饮水及活动均不限制。高脂配方参照文献[14],饲 料 成 分 由15% 脂 肪、0.25% 胆 固 醇 和84.75%基础饲料组成,自北京华阜康科技有限公司购买[许可证号:SCXK(京)2014-0008]。
1.1.2 实验药物 实验药物为解毒化瘀方四妙勇安汤:金银花(批号:15051904)90 g、当归(批号:150313061)60 g、玄参(批号:150181431)90 g、甘草(批号:150280731)30 g,由北京中医药大学东直门医院提供;盐酸吡格列酮片,别名:卡司平(批号:国药准字H20050500),自中美华东有限公司购买;阿托伐他汀钙片,别名:立普妥(批号:国药准字H20051408,产品批号:N37492),购买于辉瑞制药有限公司。
1.1.3 主要试剂和仪器 小鼠Ox-LDL 血清酶联免疫吸附法(ELISA)试剂盒自伊莱瑞特生物科技股份Elabscience 有限公司购买(货号:E-ELM0066c);PPARγ、FABP4、MMP-2 以 及GAPDH第一抗体均购自美国Abcam 公司(货号分别为ab45036、ab92501、ab37150 以 及ab9485);羊 抗 兔IgG-HRP、BCA 蛋 白 测 定 试 剂 盒、5%BSA 和 增 强型RIPA 裂解液都购自博士德生物(货号分别为BA1054、AR1189、AR0004、AR0102);SP 二步法试剂盒(货号:SP-9001)、DAB 显色液(货号:ZLI-9018)及中性树胶(货号:ZLI-9555),均自北京中杉金桥(ZSGB-BIO)有限公司购买。AU5800 全自动生化测定仪(美国贝克曼-库尔特有限公司);BX60光学显微镜(日本Olympus 公司);RM2135 组织切片机(德国Arcadia 公司);EG1150 组织包埋机(德国Arcadia 公司);MK3 全自动酶标仪(Thermo 公司);LAS-4000 MINI 生物分子成像仪(日本富士公司)。
1.2 方法
1.2.1 模型制备 全部小鼠于1 周适应性喂养后,参照文献[15],应用颈总动脉(右)套管术(Perivascular carotid collar placement,PCCP)制备ApoE-/-颈AS 小鼠模型。颈部至腋下剃毛并清洁,消毒麻醉后,于颈右侧部剪开约2 cm 切口,使血管暴露于视野中并将呈搏动状态的右颈总动脉分离,直至颈动脉分叉处。随后把内径横切面为0.3 mm 的硅胶套管剪成长2.5 mm 的小段,套在颈右动脉外周并固定上下端。假手术组不结扎,其余步骤相同。从PCCP 术当天起由普饲改为高脂饲料继续养10 周。本研究符合北京中医药大学东直门医院动物伦理规定,并在征得其批准下进行[编号:京中东内(2016)06]。
1.2.2 分组及给药 PCCP 术后随机将40 只小鼠分为模型组、四妙勇安汤组、吡格列酮组、阿托伐他汀组,每组8 只。PCCP 术当天起,按四妙勇安汤34.9 g/kg、盐酸吡格列酮2.28 g/kg、阿托伐他汀2.57 g/kg 的剂量每天(上午8 时30 分)灌胃给药1次,连续8 周。假手术和模型组以相同剂量去离子水灌胃,与各给药组周期保持一致。
1.2.3 全自动生化分析仪器测血清中脂质含量自PCCP 术当日给药起到8 周给药周期结束后对小鼠进行取材,应用摘取小鼠眼球取血方式收集血液,4 ℃离心机3 000 r/min 离心15 min。运用全自动生化仪检测血清中TC、TG、HDL-C、LDL-C 的含量[12]。
1.2.4 酶联免疫吸附(ELISA)检测血清中Ox-LDL浓度 按照说明,根据ELISA 套盒所附实验执行步骤,测小鼠血清含Ox-LDL 量。在酶标仪450 nm 波长处读取各组小鼠血清Ox-LDL 的OD 值,并进行统计学分析。
1.2.5 苏木精-伊红(HE)染色 将每只小鼠右颈总取出搁置在4%多聚甲醛,固定24 h 后脱水进行石蜡包埋,切片厚3 μm,行HE 染色。60 ℃烤片机1 h,按照二甲苯、下行酒精的顺序,脱蜡至水,流水状态冲洗,按苏木素染色液染色、1%盐酸乙醇分化、流水状态冲洗蓝化、伊红染色的顺序进行染色。上行酒精、二甲苯脱水、透明,采用中性树胶黏附盖玻片于载玻片上。并于光镜下(×200)随机选1~3 个视野观察并收集图像,应用Image Pro Plus 6.0 图象处理程序对血管参数测量。测量指标:血管内膜厚度(IT)、中膜厚度(MT)、内弹力板环绕管腔面积(LA)、斑块面积(PA)、内膜与中膜厚度比(IT/MT)以及斑块血管管腔面积比(PA/LA),并取IT、PA、IT/MT、PA/LA 均 值 进 行 统 计 学 分 析[12]。见图1。
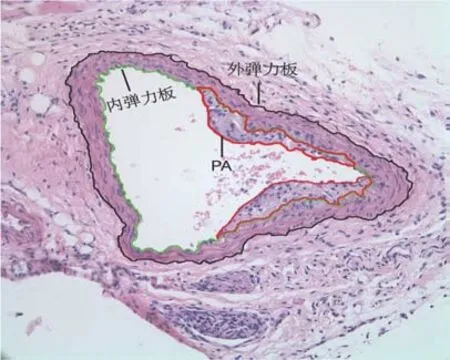
图1 颈动脉IT、PA、IT/MT、PA/LA 测量方法(×200)Fig 1 Measure method of IT,PA,IT/MT,and PA/LA of carotid artery(×200)
1.2.6 免疫组织化学实验 同HE 法制片。在60 ℃烤片机烤2 h,常规脱蜡至水后,顺序经0.01 mol/L枸橼酸盐缓冲液中高温抗原修复,3%过氧化氢破坏内源性过氧化物酶活性,添加一抗FABP4(1∶200)、PPARγ(1∶150)和MMP-2(1∶200)于载 玻片上,置于4 ℃,16 h 后取出滴加二抗辣根过氧化物酶标记山羊抗兔IgG,滴加DAB 显色液(1∶1 000),随后复染胞核。染色结果为:细胞核呈蓝色,PPARγ蛋白在内皮细胞、平滑肌细胞、泡沫细胞等胞核着色,胞质偶见,FABP4 和MMP-2 在内皮细胞、平滑肌细胞、泡沫细胞等胞浆着色。根据染色程度判断其表达情况,镜下见不同程度的黄色或棕黄色为阳性,阴性仅见胞核蓝染[16]。
1.2.7 蛋白免疫印迹实验 全程于冰上进行。依据组织重量加入相应RIPA,并对所提蛋白半定量。25 μg 蛋白上样;电泳、电转采取SDS-聚丙烯酰胺凝胶(SDS-PAGE)方法,5%脱脂奶粉封闭1 h,加入一抗FABP4(1∶1 000)、PPARγ(1∶1 000)、MMP-2(1∶1 000)和GAPDH(1∶1 000)分别倒入相应分子量大小PVDF 膜处,置于4 ℃。16 h 后取出添加二抗:山羊抗兔IgG(1∶5 000)1 h,ECL 发光液显色,凝胶程序系统中曝光、拍照,运用Image J 图像处理软件对目的条带与内参进行灰度值测量,并对两者比值(目的条带/内参)统计分析[17]。
1.3 统计学处理
2 结果
2.1 四妙勇安汤对AS 小鼠血清中脂质含量的影响
与假手术组对比,模型组小鼠血清TC、TG、LDL-C 差异无统计学意义(P>0.05),HDL-C 升高(P<0.05);与模型组比较,四妙勇安汤组和阿托伐他汀组TC、LDL-C 均升高(P<0.05),HDL-C 均降低(P<0.05),TG 无明显变化,差别无统计学意义;吡格列酮组TC、TG 未见明显变化,差别无统计学意义(P>0.05),HDL-C 降低(P<0.05),LDL-C 升高(P<0.05)。见表1。
表1 四妙勇安汤对AS 小鼠血清中脂质含量的影响(n=8,±s,mmol/L)Tab 1 Effect of Simiao Yongan Decoction on lipids of AS mice(n=8,±s,mmol/L)

表1 四妙勇安汤对AS 小鼠血清中脂质含量的影响(n=8,±s,mmol/L)Tab 1 Effect of Simiao Yongan Decoction on lipids of AS mice(n=8,±s,mmol/L)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
LDL-C 10.35±4.68 7.92±1.15 15.60±0.71#14.72±2.14#13.00±3.97#9.129 0.000组别假手术组模型组四妙勇安汤组吡格列酮组阿托伐他汀组F P TC 28.96±1.43 29.74±1.31 43.41±10.94#30.46±1.51 37.62±7.27#8.825 0.000 TG 1.50±0.45 1.57±0.43 1.65±0.64 1.87±0.45 1.69±0.35 0.706 0.593 HDL-C 0.60±0.10 1.17±0.19*0.46±0.16#0.57±0.10#0.72±0.21#24.087 0.000
2.2 四妙勇安汤对AS 小鼠血清中Ox-LDL 的影响
相比于假手术组,模型组小鼠血清Ox-LDL 升高(P<0.05);与模型组比较,四妙勇安汤组、吡格列酮组和阿托伐他汀组Ox-LDL 均降低(P<0.05)。见表2。
表2 四妙勇安汤对AS 小鼠血清Ox-LDL 的影响(n=6,±s,ng/mL)Tab 2 Effect of Simiao Yongan Decoction on Ox-LDL of AS mice(n=6,±s,ng/mL)
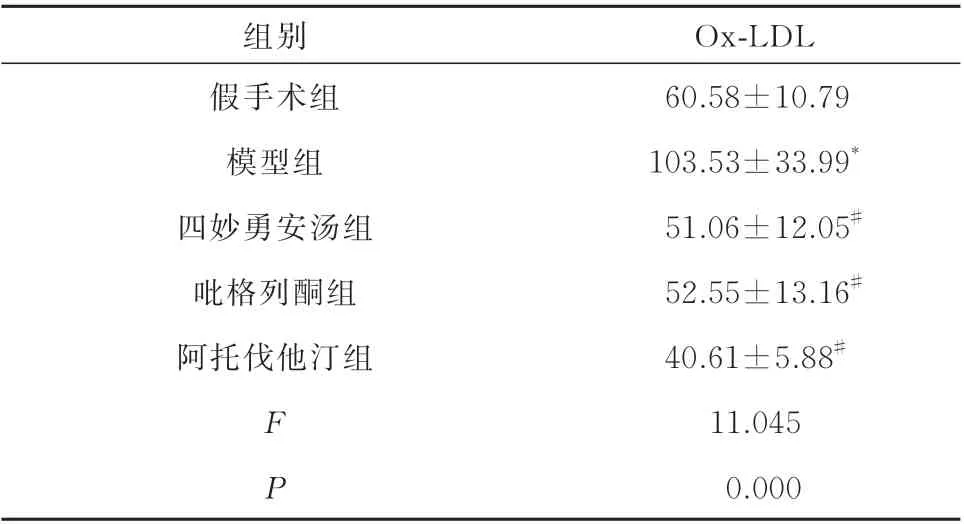
表2 四妙勇安汤对AS 小鼠血清Ox-LDL 的影响(n=6,±s,ng/mL)Tab 2 Effect of Simiao Yongan Decoction on Ox-LDL of AS mice(n=6,±s,ng/mL)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
Ox-LDL 60.58±10.79 103.53±33.99*51.06±12.05#52.55±13.16#40.61±5.88#11.045 0.000组别假手术组模型组四妙勇安汤组吡格列酮组阿托伐他汀组F P
2.3 四妙勇安汤对ApoE-/-AS 小鼠颈动脉病理形态学的影响
HE 染色结果显示:假手术组小鼠右侧颈总动脉结构完整,内膜无增厚,中膜无增殖无迁移,血管壁厚薄均一,未明显观察到AS 班块。相比于假手术组,模型组观察到颈动脉内膜明显增厚,内皮下间隙处有泡沫细胞大量沉积,凸向血管腔(P<0.05),并可见中膜的平滑肌排列不整齐,向内膜处迁移(P<0.05),血管管腔狭窄明显(P<0.05),斑块面积扩大(P<0.05),AS 斑块明显形成。与模型组对比,四妙勇安汤组、吡格列酮组和阿托伐他汀组颈右动脉血管壁IT 降低(P<0.05),平滑肌排列整齐、未见明显变化,IT/MT 降低(P<0.05),颈动脉内膜泡沫细胞含量降低,PA 明显减少。见图2~3。

图2 四妙勇安汤对ApoE-/-AS 小鼠颈动脉病理形态学的影响(HE 染色,×400)Fig 2 Effect of Simiao Yongan Decoction on pathological change in carotid artery of ApoE-/-AS mice(HE staining,×400)

图3 四妙勇安汤对ApoE-/-AS 小鼠颈动脉内膜厚度(IT)、斑块面积(PA)、内膜比中膜厚度(IT/MT)、斑块面积比血管管腔面积(PA/LA)的影响(n=5,±s)Fig 3 Effect of Simiao Yongan Decoction on intima thickness(IT),plaque area(PA),intima-media thickness(IT/MT),and lumen area ratio of plaque vessels(PA/LA)in carotid artery of ApoE-/-AS mice(n=5,±s)
2.4 四妙勇安汤对ApoE-/-AS 小鼠颈动脉组织FABP4、PPARγ 和MMP-2 蛋白表达的影响
免疫组织组化结果可见:假手术组颈动脉组织中FABP4 和MMP-2 阳性表达强度均较弱,PPARγ阳性表达强度较强。与假手术组相比,模型组FABP4 和MMP-2 阳性表达强度均较强,PPARγ 阳性强度较弱。与模型组相比,四妙勇安汤组、吡格列酮组和阿托伐他汀组给药8 周后FABP4 和MMP-2 阳性表达强度均减弱,PPARγ 阳性表达强度较强。见图4。

图4 四妙勇安汤对ApoE-/-AS 小鼠颈动脉FABP4、PPARγ 和MMP-2 蛋白表达的影响(免疫组织化学染色,×400)Fig 4 Effect of Simiao Yongan Decoction on FABP4,PPARγ,and MMP-2 proteins in carotid artery of ApoE-/-AS mice(Histochemistry stain,×400)
2.5 四妙勇安汤对ApoE-/-AS 小鼠脂代谢相关蛋白FABP4、PPARγ 及斑块稳定性蛋白MMP-2 表达水平的影响
Western blot 结果可见:与假手术组对比,模型组FABP4 和MMP-2 蛋白含量均升高(P<0.05),PPARγ 蛋白含量降低(P<0.05)。相比于模型组,四妙勇安汤组FABP4、MMP-2 蛋白含量均下降(P<0.05),PPARγ 蛋白含量增加(P<0.05);吡格列酮组和阿托伐他汀组FABP4 和MMP-2 蛋白含量均 减 少(P<0.05),PPARγ 蛋 白 含 量 增 加(P<0.05)。见图5。

图5 四妙勇安汤对ApoE-/-AS 小鼠脂代谢相关蛋白FABP4、PPARγ 和MMP-2 水平影响Fig 5 Effect of Simiao Yongan Decoction on FABP4,PPARγ,and MMP-2 proteins in carotid artery of ApoE-/-AS mice
2.6 四妙勇安汤调控Ox-LDL 脂代谢途径增加ApoE-/-小鼠AS 斑块稳定性的机制
其增加斑块稳定性的分子机制可能与抑制Ox-LDL 及其脂代谢途径有关。见图6。

图6 四妙勇安汤调控Ox-LDL 脂代谢途径增加ApoE-/-小鼠AS 斑块稳定性的机制Fig 6 Mechanism of effect of Simiao Yongan Decoction on stability of AS plaque of ApoE-/- mice via regulating Ox-LDL lipid metabolic pathway
3 讨论
在AS 病理过程当中,脂质代谢障碍伴随AS 的全过程[18]。Ox-LDL 是脂质代谢异常的直接因素,以拥有较强的趋化性和细胞毒性为其致病特征,能够诱导并加剧其被巨噬细胞识别吞噬,是导致泡沫细胞形成的直接原因[19-21]。Chainika 等[22]研究证实,血清Ox-LDL 升高可视为加剧AS 病变的独立危险因素。LDL-C 经历氧化修饰转变成Ox-LDL,是导致AS 发生、发展必不可少的因素。本研究通过高脂联合PCCP 术制备ApoE-/-小鼠AS 模型,给予四妙勇安汤药物干预,发现它能显著降低颈动脉斑块AS 小鼠血清Ox-LDL 水平,能够在不降低TC、LDL-C 情况下,使AS 小鼠斑块面积减少,抗AS 作用疗效显著。
血管IT、PA、IT/MT 以及PA/LA 的测量是预测AS 及心脑血管疾病等的重要因子[12]。本研究中颈动脉HE 染色可见模型组内膜厚度、平滑肌排列不整齐并增殖迁移,斑块面积及血管狭窄率显著增加,而给予四妙勇安汤治疗能够使IT、PA、IT/MT和PA/LA 均降低,进而表明四妙勇安汤干预能减少内膜厚度、抑制中膜平滑肌增殖,并有效减少颈动脉斑块面积和血管狭窄率,使斑块稳定性增加。
FABP4 作为游离脂肪酸结合伴侣蛋白,在脂代谢过程中具有转运、靶向定位的作用[17]。有研究表明[23],FABP4 在胆固醇代谢过程中具有重要调节作用,Ox-LDL 含量增加可诱导Mφ 中FABP4 含量升高,增多Mφ 内胆固醇含量、导致AS 过程中泡沫细胞的产生和堆积。PPARγ 的活化依靠配体激活,隶属于核内受体超家族,参与机体脂质代谢的调节,能改善小鼠脂质代谢紊乱,干预AS 病理进程[24]。研究表明,激活PPARγ 能够拮抗Ox-LDL 介导的脂质 代 谢 紊 乱[25],降 低MMP-2 表 达,增 加 斑 块 稳 定性[26]。MMP-2 是蛋白水解酶之一,在AS 过程中,通过降解多种胶原和基底膜成分,裂解AS 斑块胶原纤维、减少斑块处纤维帽的厚度,MMP-2 含量增加 是AS 斑 块 不 稳 定 性 升 高 的 重 要 评 价 因 子[27,28]。本研究免疫组化和WB 结果均表明:四妙勇安汤可激活颈动脉PPARγ,显著降低FABP4 和MMP-2 的蛋白表达。因而,推测四妙勇安汤通过抑制Ox-LDL 的产生,抑制FABP4 的表达,激活PPARγ,使斑块稳定性增加,MMP-2 降低,发挥抗AS 作用。
研究显示[29],他汀类药能改善内皮细胞功能、通过抗炎等多种途径防治AS。但Zadelaar 等[30]研究发现,由于ApoE-/-小鼠缺乏胆固醇相关合成蛋白低密度脂蛋白受体等,所以没有降低ApoE-/-小鼠 胆 固 醇 的 作 用,Zhang 等[31]报 道 的 他 汀 类 在ApoE-/-AS 小鼠具有升高胆固醇作用。本研究发现阿托伐他汀组虽然使ApoE-/-AS 小鼠血清TC、LDL-C 含量增加,但能通过抑制Ox-LDL 的产生,减少FABP4 和MMP-2 含量,增加斑块的稳定性。与上述报道他汀类在ApoE-/-AS 小鼠不具有降低胆固醇作用实验结果相一致。与Claesen 等[32]报道的在ApoE 缺失小鼠中,他汀类药物通过多向效应干预AS,而不依赖于降低胆固醇的结果也一致。PPARγ 激动剂吡格列酮,可通过调节糖脂代谢、增加血管内皮功能,抑制平滑肌增殖等多种途径发挥抗AS 的作用[33]。本研究设立PPARγ 激动剂吡格列酮为阳性药,因前期研究表明四妙勇安汤能够激活血管和肝脏的PPARγ 表达[14,34],本研究进一步证明其能够激活颈动脉中PPARγ,增加其表达,发挥防治AS 的作用,其抗AS 作用与吡格列酮药物作用一致。本研究的假手术组与模型组小鼠同为ApoE-/-小鼠高脂饲料喂养,因此血脂检测发现TC、LDL-C 均升高,然而,从HE 染色病理结果观察到假手术组颈右动脉未形成斑块,模型组颈AS 斑块明显形成,验证了颈动脉套管有利于快速导致斑块的产生,而假手术组只剥离血管不套管不会形成斑块,与模型组形成明显区别。
综上所述,四妙勇安汤通过拮抗ApoE-/-AS小鼠Ox-LDL 介导的血管壁损伤,激活PPARγ,抑制FABP4 表达[23,25];同时,PPARγ 活性增加能够减轻Ox-LDL 诱导的血管损伤,降低MMP-2,使斑块稳定性增加,发挥稳定AS 斑块作用[35,36]。
本研究仅从整体动物水平对四妙勇安汤调控Ox-LDL 脂代谢途径发挥稳定AS 斑块的机制进行了初步的探讨,后续将从细胞水平进行深入的实验验证。
