白桦BpPIN3基因启动子序列及应答特性分析
2022-08-04方功桂穆怀志
陈 坤 方功桂 穆怀志 姜 静
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
生长素(IAA)是一种非常重要的植物激素,参与植物的许多生长发育过程,如根系形成、顶端优势、花序和叶序发育、维管组织分化、果实成熟,以及对光照和重力的响应等。而在植物中观察到异常的表型多是由于内源生长素浓度过高或不足引起的。生长素运输载体蛋白作为生长素的运输载体,可通过在植物组织或器官中建立生长素的不对称分布来建立生长素浓度梯度,进而在植物生长发育过程中表现出其生理效应。在植物生长素运输载体中PIN 蛋白家族是最重要的生长素外排载体基因家族之一,主要负责向胞外运输生长素。拟南芥()研究显示,其共有8 个PIN 家族成员(~),该家族成员均为膜蛋白。其中是生长素动态运输的重要组件,主要参与植物胚胎生长素梯度的维持,以及维管束的分化等;定位于根尖组织细胞中,负责生长素的分配进而控制根的向地性;主要参与植物的向性生长和侧向器官的形态建成;、主要负责生长素的非极性定位;而内质网定位的PINs主要包括、和,主要参与细胞内生长素的稳态和代谢。拟南芥中的分布较广,在根分生组织的中柱鞘细胞、根冠柱,以及幼芽的内皮层细胞中都可以观测到其表达,能够将重力刺激信号转化为生长素的非对称分布,从而控制植物的向性生长,同时在光照条件下,受基因的影响,通过介导的膜泡运输过程受到影响,进而导致生长素的分布发生变化来参与植物向光性的过程。
除拟南芥外,迄今为止,已通过全基因组测序方法在30 余种植物中鉴定出基因。其中基因在碎米荠()中被证明参与植物小叶的分化;在玉米()中被证明其参与玉米胚胎发育,以及生殖发育过程;在番茄()中,通过调节生长素积累过程进而控制番茄子叶的脱落。番茄中研究发现、参与茎发育过程。在烟草()中,负调控腋芽生长。紫苜蓿中,影响植物根瘤数量。在棉花()中,PINs 蛋白具有调节棉花纤维生长的作用。在木本植物中,参与毛果杨()侧根形成过程,参与杨树的叶片形态建成过程。通过这些植物关于PINs的相关研究揭示了生长素外排载体基因在生长素介导的植物生长和发育过程中的作用机理。
本研究团队前期以欧洲白桦()的种内变种裂叶桦(‘Dalecarlica’)为试验对象,基于转录组测序技术,构建了白桦叶脉遗传调控网络。基于前期白桦叶脉遗传调控网络,发现生长素输出载体PIN(PIN-FORMED)蛋白参与白桦叶脉发育分子调控过程,同时团队前期已经将白桦中的PIN 家族基因鉴定出来,发现白桦的基因组中,家族基因有6 个成员。然而,关于白桦PINs家族中的基因表达水平和非生物胁迫之间的联系的潜在机制在很大程度上是未知的。鉴于此,以白桦为试验材料,在对基因启动子顺式作用元件预测的基础上,开展基因的不同组织部位表达特性分析,IAA、GA、ABA 及光胁迫处理下基因应答特性分析。为阐明在白桦生长发育和非生物胁迫中的作用机制提供理论依据。
1 材料与方法
1.1材料
外源激素及光胁迫处理材料:东北林业大学林木遗传育种国家重点实验室保存的白桦()继代苗。分别取生长一致的无根苗转接于生根培养基(木本植物专用培养基Woody Plant Basal Medium(WPM)+0.4 mg·L吲哚丁酸(IBA)+20 g·L蔗糖,pH=5.8)中培养20 d左右,转接至土壤基质培养基(蛭石∶草炭土=2∶1,WPM+20 g·L蔗糖,pH=5.8)中培养40 d 左右,培养条件为16 h/8 h 光暗循环,平均温度约为25 ℃。每处理15株苗,均重复3次。
组织表达特性研究材料:定植于东北林业大学白桦强化种子园(45.724726°N,126.636002°E)中的1年生和2年生白桦无性系苗木。
试剂:RNA 提取试剂盒(RNeasy Plant Mini Kit,百泰克生物技术有限公司)、IAA(Sigma,USA)、GA(Sigma,USA)、ABA(Sigma,USA)。
1.2方法
1.2.1启动子序列响应元件预测
利 用NCBI(https://www.ncbi.nlm.nih.gov/)在线网站获得(基因号:Bpev01.c1162.g0001.m0001),以及其他13 个物种同源基因启动子上游2 001 bp 序列。利用在线工具PlantCARE(http://bioinformatics.psb.ugent.be/webt‑ools/plantcare/html)和PLACE(http://www.dna.affrc.go.jp/PLACE/signalscan.html)分析14 个物种的14个同源基因起始密码子上游2 kB 的启动子区域的顺式调控元件。选择低温,激素反应和光反应相关的顺式作用元件motif来分析启动子非生物胁迫响应特异性,然后使用TBtools 对其进行可视化。
于2020 年6 月,选取1 年生和2 年生白桦无性系苗木各5株,分别取顶芽、第1~2片叶、嫩茎及根组织,相同组织部位混样后分为3 份,用液氮迅速冷冻,置于超低温冰箱中-80 ℃保存备用。
根部取材具体操作如下:整株植物挖出后,用流水冲洗去除根系上附着的土壤,剪取幼嫩根尖组织部位吸干水分后置于液氮中保存。
外源激素处理:参考刘宇等的方法进行激素处理。将100 μmol·LIAA、100 μmol·LGA、200 μmol·LABA分别喷洒在组培苗叶片的表面,每瓶组培苗喷洒处理溶液约20 mL,使叶片表面湿润;在喷洒0、2、4、8、16、24、48 h 后,采集所有叶片和根(根组织取材方法同上),迅速放入液氮中冷冻并置于冰箱中-80 ℃保存备用。
光胁迫处理:选取已生根的组培苗遮光暗处理3 h 后,随机选取15 株组培苗,采集所有叶片和根,迅速放入液氮中冷冻并置于冰箱-80 ℃中保存备用。并且在遮光处理3 h 后将组培苗置于约25 ℃条件下进行连续光照处理(光照强度为1 100 lx),分别在连续光照1、3、6、12、24、48、72 h 后,采集所有叶片和根,迅速放入液氮中冷冻并置于冰箱中-80 ℃保存、备用。
以上述采集样品为材料,分别采用植物RNeasy提取试剂盒提取总RNA。用不含RNase的DNase Ⅰ(Promega)处理总RNA,以去除DNA 污染,通过分光光度法准确定量RNA 浓度,取1 μg总RNA 于2%琼脂糖凝胶上分离,检测其完整性。然后以Oligo(dT)作为引物使用ReverTra AceqP‑CR RT Master Mix 试剂盒(ToYoBo)对DNase 处理的RNA(2 μg)进行反转录,总体积为20 μL。将合成的cDNA 稀释10 倍后置于冰箱中-20 ℃保存,备用。
根据基因片段序列使用Oligo7.0软件设计用于实时RT-PCR 分析的引物,引物为BpPIN3F(5′-CTGGGCCGGTGAGGAATCTA-3′)和BpPIN3R(5′-GTCGATCTCGATACTCTCCGATGCC-3′)。以18S rRNA(18S)为内参基因,引物为18SF(5′-ATCTTGGGTTGGGCAGATGG-3′)和18SR(5′-CATTACTCCGATCCCGAAGG-3′)。用ABI7500 实时荧光定量PCR 仪进行PCR 扩增,具体操作参照黄海娇等的方法。
使用18S 作为内参基因,计算相对表达量时,组织特异性试验中,将1年生白桦顶芽表达量设为“1”;不同激素和光胁迫处理下,以同期未处理材料为对照组,将其表达量设为“1”,采用7500 Sys‑tem 软件和2法进行数据分析,计算目的基因的相对表达水平。采用SPSS 22.0 对数据进行统计分析。所有数据用平均值±标准差表示,多组平均值之间进行方差齐性检验后,采用单因素方差分析(one-way ANOVA),并采用邓肯新复极差法比较对照组与处理组间的差异显著性,<0.05 代表差异显著。Graph Pad Prism 8.0软件作图分析。
2 结果与分析
2.1 BpPIN3基因启动子序列分析
在线分析软件Plantcare(http://bioinformatics.psb. ugent. be/webtools/plantcare/html/)和PLACE(http://www.dna.affrc.go.jp/PLACE/signalscan.html)分析显示,该启动子序列具有基本转录元件如核心元件TATA-box 和控制转录效率及频率的CAAT-box,同时在的启动子中发现了多个具有胁迫响应和激素响应的顺式作用元件。如表1 和图1 所示,包括茉莉酸甲酯(MeJA)响应元件(CGTCA-motif)、干旱胁迫响应元件(MBS)、ABA响应元件(ABRE)、赤霉素响应元件(GARE-box 和P-box),以及各种光响应元件如GT1-motif、G-box、TCT-box、box 4。在不同物种启动子元件差异分析发现:不同物种的光响应元件数量存在差异,其他生理性响应元件只在个别物种特异性出现,其主要差异体现在不同激素响应元件和胁迫响应元件的种类以及数量上。白桦启动子中光响应元件,ABA响应元件以及赤霉素响应元件的数量要明显多于其他物种启动子。
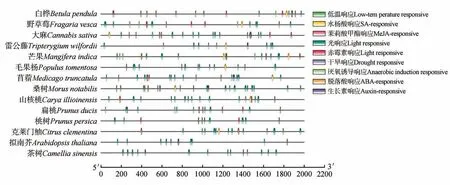
图1 14个物种的14个PIN3同源基因启动子元件展示Fig.1 14 PIN3 homologous gene promoter elements display of 14 species

表1 BpPIN3启动子区域主要顺式作用元件预测Table 1 Prediction of major cis-acting elements in BpPIN3 promoter region
2.2 BpPIN3组织表达模式分析
白桦在不同组织部位的qRT-PCR 分析显示(见图2),无论是1年生还是2年生的白桦,该基因在不同组织部位的相对表达量显著不同(<0.05),其中1年生时,在第2叶片和茎段的相对表达量最高,而2 年生时其在第1 叶片的相对表达量最高。同时发现,2 年生的白桦的表达量明显高于1 年生白桦,例如,2 年生时其顶芽表达量较1 年生的顶芽高151.76倍。
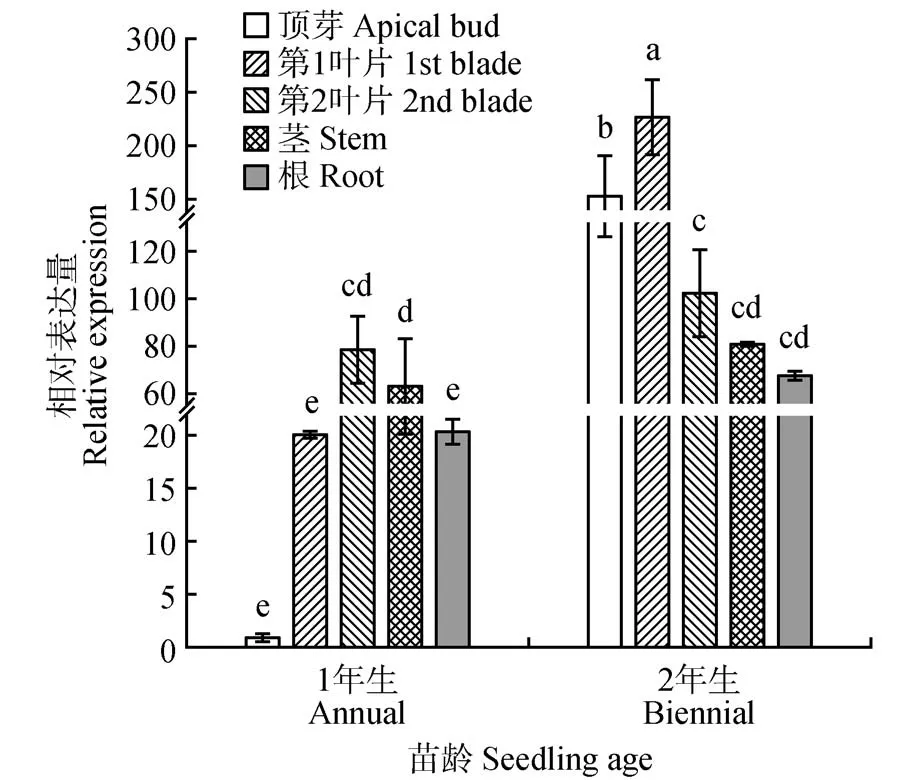
图2 白桦BpPIN3不同组织部位的相对表达量不同小写字母代表不同组织间差异显著(P<0.05)Fig.2 Relative expression of BpPIN3 in different tissues of B.platyphyllaDifferent lowercase letters represent significant differences between different tissue(sP<0.05)
2.3 BpPIN3基因响应IAA 、GA3、ABA及光胁迫的表达特性分析
顺式作用元件预测结果表明,基因启动子上具有IAA、GA和ABA 多种激素相关以及光响应相关的顺式作用元件,试验选取IAA、GA和ABA 等3 种激素及光胁迫处理白桦组培苗,以不同激素和光照时间处理的白桦组培苗的cDNA为模板,以同期未处理的白桦组培苗为对照组,利用实时荧光定量PCR 技术对各处理条件下在不同组织及处理时间的表达模式进行分析。
经不同激素处理后,的相对表达分析显示,IAA、ABA 处理后的白桦根组织中均呈上调表达趋势,IAA 处理后的24 h 时的表达水平达到最高值,较0 h上调了2 082.39倍(见图3A),而ABA 处理后的则是在48 h 时的表达水平达到最高值,较0 h 上调了29.06 倍(见图3C);GA处理后的根组织中仅在4、8 h 时呈显著下调表达,其他时间点也是呈上调表达(见图3B)。3 种激素处理后白桦叶片组织中该基因的应答不尽相同,例如,在IAA 处理的2、8、16、24 h 时间点均显著上调表达,只有4、48 h 呈现下调表达(见图3A);GA处理条件下,在叶片中呈显著上调表达,尤其在8 h 时该基因表达量最高,较0 h 上调了1 663.78 倍(见图3B);ABA 处理后,只有4、16 h呈现上调表达(见图3C)。
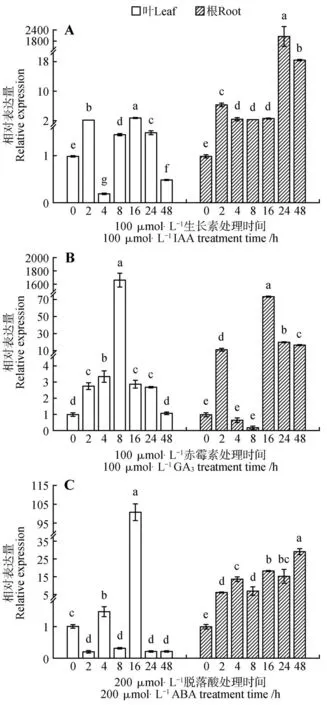
图3 生长素(IAA)、赤霉素(GA3)和脱落酸(ABA)处理后白桦BpPIN3基因相对表达量的变化A.100 μmol·L-1 IAA处理;B.100 μmol·L-1 GA3处理;C.200 μmol·L-1 ABA处理;不同小写字母代表不同处理间差异显著(P<0.05);下同Fig.3 Changes of relative expression of BpPIN3 gene in B.platyphylla after IAA,GA and ABA treatmentA.100 μmol·L-1 IAA treatment;B.100 μmol·L-1GA3 treatment;C.200 μmol·L-1 ABA treatment;Different lowercaseletters represent distinct differences between different treatments(P<0.05);The same as below
遮光3 d 后连续光照胁迫条件下白桦基因的相对表达量分析显示:无论在叶片还在根组织中,均呈显著上调或上调表达(见图4),在叶片中处理的3、6 h 时该基因被显著诱导表达,而在根组织中12 h 时该基因显著上调表达,较0 h上调表达21.14倍。
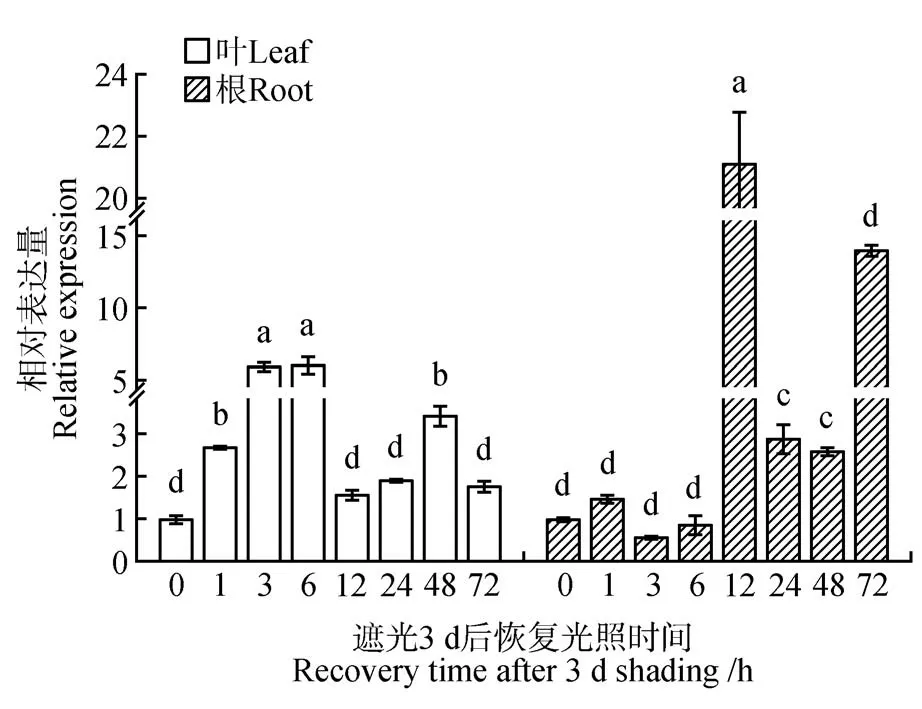
图4 遮光3 天后连续光照胁迫条件下白桦BpPIN3 基因的相对表达量的变化Fig.4 Changes in the relative expression of BpPIN3 gene in B. platyphylla under continuous light stress after shading for 3 d
试验结果表明,在白桦中,当其受到非生物胁迫时,通过上调或下调表达发挥其功能。外源生长素和赤霉素处理后,叶片组织白桦基因的相对表达量呈上调表达趋势,但经脱落酸处理后,除4、16 h 相对表达量显著提高外,其余处理时间该基因的相对表达量则未能显著提高;而这3种激素处理后,白桦根组织中的的相对表达量均呈现上调表达趋势。经遮光3 d后持续光照的胁迫处理后,叶片组织在显著诱导的表达,但在根组织中12 h 后才开始被诱导表达。总之白桦参与IAA、GA和ABA信号转导途径,以及植物的光响应过程。但在不同激素处理、光胁迫以及处理时间条件下白桦的表达模式各异。
3 讨论
植物在生命周期中不可避免地受到盐、冷、高温、光、外源激素和干旱等非生物胁迫。一系列证据也表明生长素在参与调节植物对各种生物胁迫和环境刺激的响应中起关键作用,环境胁迫响应依赖生长素在不同植物组织内的稳态。生长素的稳态常常受到非生物胁迫的干扰,从而导致植物生长发育的变化。研究植物体内生长素运输载体基因与植物形态建成以及响应抗逆调控的关系,以辅助育种工作,有着重要的理论和实践意义。
生长素通过调控大量被认为参与非生物胁迫应答的生长素响应基因来介导植物的各种非生物胁迫应答。据报道,生长素的再分配是植物在挑战环境中生存的重要过程。各种环境和非生物信号可通过调节生长素运输和PIN 蛋白极性来改变生长素的分布进而参与对非生物胁迫(如激素、干旱、冷、光胁迫和碱性胁迫)的响应。在水稻()中,基因表现出组织特异性,叶中被发现受到激素的调控,研究表明除和外,其余基因均受到IAA诱导表达。在玉米的研究中发现,经IAA 处理后,茎 组 织 中、、、和的表达水平显著上调;根中和的表达水平显著上调,其余许 多 基 因,如、、、、和的表达水平则显著下调。对欧洲白桦及其种内变种裂叶桦间的不同组织部位中表达特性分析显示,在两种桦树中均明显下调表达,说明其在白桦生长发育过程中起重要作用。对白桦启动子克隆以及外源激素应答分析试验证明,在白桦第1 叶的裂叶边缘和第2 叶叶柄及根组织中经ABA、GA、Me-JA、SA 和IAA 处理后均有响应,响应的变化趋势也基本一致。以上研究均证明广泛参与植物体内生长素信号调控网络,在植物器官发育以及形态建成过程中发挥着重要作用,同时也是胁迫响应和防御反应的重要参与者。
在白桦中,通过进一步的研究,包括对生长素外排载体的生启动子分析以及基因表达特性和应答特性分析,将提高我们对白桦中生长素转运体与非生物胁迫关系的认识。启动子顺式作用元件分析表明,该基因启动子的转录激活受水杨酸、赤霉素、脱落酸、茉莉酸甲酯等激素的调控以及光响应、干旱诱导、低温等环境胁迫的调控,特别是脱落酸和光响应元件,分别各为7 个(见表1)并且响应元件数量多于其他物种基因。本研究对白桦的组织表达特性分析显示,该基因具有组织特异性,在顶芽、叶片、茎和根等组织部分均有表达,且在不同的组织中表现出不同的基因表达模式。同样,在其他植物中,例如,在茶树()中,花组织中表达量最高,根中表达量最低,并且随着芽的发育表达量呈上调表达趋势。在拟南芥中,在第十五花期的花中表达量最高,而在心皮组织中表达量最低。在裂叶桦中嫩茎的表达量最高,而在欧洲白桦中顶芽的表达量最高,裂叶桦和欧洲白桦的叶组织中基因的表达量均低于其他组织部位。在不同植物组织中的这种不同响应可能解释为植物适应不同组织的特定作用、发育和环境条件的需要。通过1 年生与2 年生植株组织部位间比较发现,各组织部位中的表达量均较前一年显著上调,这些结果表明,可能在白桦的各个时期和各个组织部位都发挥作用,并随着白桦的生长发育,作用效果愈发显著,推测该基因易受外界条件变化影响。本研究中,在用外源激素IAA、GA、ABA,以及光胁迫条件分别处理后白桦叶片和根部的表达情况表明,在叶片中,在GA以及光胁迫条件下呈稳定的上调表达趋势,而在其他两种激素处理下,除16、48 h 外,ABA 处理下基因表现出与IAA 处理下相反的表达模式。说明在白桦叶片中,这种差异可能是由于ABA 对生长素水平的反作用造成的:ABA 既可以通过激活IAA 结合降低生长素含量,也可以通过激活IAA 合成促进其积累,进而影响叶片中生长素外排载体基因的表达量。在根组织中,感知外源GA和光胁迫处理后的表达差异只有在处理后一段时间(GA处理16 h,光胁迫12 h)后才出现稳定的上调表达趋势,而在ABA 和IAA 处理下基因快速呈现出上调表达趋势。不同外源激素以及光胁迫处理下,白桦根部基因激活时间的差异很可能是由于该基因在白桦体内参与各激素信号转导途径和光响应过程中传递方式的差异所导致(图3:A~C,图4)。研究表明单侧光和重力刺激都会刺激植物体内3 极化,进而导致植物器官形态发生变化。紫苜蓿中,在低R/FR 光处理下,被诱导表达,对遮荫产生响应,说明和在不同环境下对避光反应起双重调控作用。本研究发现遮光处理后,基因在白桦叶片以及根部中均被诱导表达,对光照反应产生响应,证明参与白桦光响应的调控过程,但感应外源激素和光胁迫刺激而表达的基因是如何参与调节白桦适应外界环境刺激,仍有待深入研究。
本研究分析了白桦基因的启动子顺式作用元件并研究了白桦不同发育时期不同组织部位以及在外源激素以及光胁迫条件下不同组织间的表达差异,探讨了生长素外排载体基因在白桦IAA、GA和ABA 信号转导途径以及光响应过程中的表达模式,为深入揭示生长素调控抗逆分子机制以及生长发育提供了理论依据。但生长素运输载体数量众多,且参与生长素调控抗逆以及影响植物生长发育的基因有很多。如生长素内流载体(AUX/LAX)、生长素响应因子ARF、ATP 结合盒转运蛋白家(ABCB/MDR/PGP)、生长素受体基因TIR 等。因此,作为生长素信号调控网络的关键点,下一步应将与其他基因相结合,从其功能以及信号转导方面深入挖掘生长素外排载体基因调控白桦器官形成与发育过程中的作用机制。
4 结论
通过分析白桦上游2 001 bp的启动子序列发现启动子序列包含赤霉素、脱落酸、茉莉酸甲酯等不同类型的生长素响应元件,以及多个与逆境相关的顺式调控元件。组织表达特性试验证明在不同生长年份白桦的多个组织部位均有表达,尤其在叶片中表达量较高,并且所有组织部位中第二年的表达量均高于第一年。不同激素和光胁迫处理发现,基因受外源IAA、GA和ABA 诱导,同时发现参与白桦光响应调控过程。
