植物感受盐胁迫及相关钙信号的研究进展
2022-08-04陈娇娆胡章立
陈娇娆 续 旭 胡章立 杨 爽,2*
(1. 深圳大学生命与海洋科学学院,深圳 518060;2. 深圳大学物理与光电工程学院,深圳 518060)
土壤盐渍化是一个日益严峻的全球性问题,主要分布在干旱和半干旱地区,占可耕种土地面积约20%。主要农作物如水稻()、小麦()、玉米()等都是甜土植物,当土壤盐浓度过高时,这些主要农作物的产量会大幅降低。随着世界人口的不断增多,人类对食物的需求也随之增多。根据预测,我国粮食消费总量需求在2030 年将达到6.5 亿t。因此,植物感受盐胁迫的机制以及关于盐胁迫对植物生长发育影响的研究对粮食安全具有重要意义。
土壤盐渍化的可溶性盐离子有多种类型,如阴离子CO、HCO、Cl、SO、PO等,阳离子如Na、K、Ca、Mg等,其中主要由中性盐(NaCl、NaSO)造成的胁迫为中性盐胁迫;由碱性盐(如NaCO、NaHCO等)引起的胁迫为碱性盐胁迫。盐渍化产生的盐胁迫对植物的危害包括渗透胁迫、离子毒害、营养失衡和氧化损伤等。土壤中高浓度的盐离子提高了环境中的渗透势,降低了植物根系的吸水能力。盐胁迫下,植物被动吸收Na和Cl并在体内积累,对自身产生毒害作用,同时干扰K等其他营养元素的吸收,降低光合效率,抑制细胞生长并引起激素的变化。盐胁迫下产生大量活性氧(reactive oxygen species,ROS),ROS 对部分DNA、RNA及蛋白质造成损伤,并且破坏细胞膜的完整性。值得注意的是,盐胁迫引起的渗透胁迫和离子胁迫的信号通路不同,渗透胁迫是水分亏缺的常见后果,并不是盐胁迫特有的。
Ca是植物细胞内重要的第二信使,植物在外界刺激下,相关受体接收刺激在细胞内产生Ca信号,调控下游响应基因使植物能够应对各类逆境胁迫,如Ca浓度的升高可以保护植物免受Na的毒害,当根感知Na后,通过Ca信号在细胞内激活SOS信号转导级联反应,有助于Na排出细胞外,维持细胞Na/K稳态。在这篇综述中,我们讨论了与Ca信号相关的植物盐胁迫响应的最新研究成果,重点是植物盐感知及其传导相关的Ca信号事件。
1 盐胁迫下植物Ca2+信号的响应
由于植物的固着性,植物在长期进化过程中发育进化出合适的机制来适应高盐环境。盐胁迫在植物中诱导离子胁迫、渗透胁迫以及一系列次生胁迫。植物受到盐胁迫时,相关盐受体感知刺激并将其转化成Ca信号,完成将外界刺激转化为体内信号的过程。细胞质游离Ca的浓度([Ca])和分布构成了Ca信号的基础。植物[Ca]在100~200 nmol·L,细 胞 外 游 离Ca浓 度 为1~10 mmol·L,一些细胞器如液泡、内质网、线粒体等Ca含量比细胞质中更高,也被称为植物中的钙库。非损伤微测技术(non-invasive micro-test technique,NMT)是近年来开发的一种新型获取离子跨膜流动变化的技术。NMT 可记录多种离子流,如K流、H流、Cl流或Ca流等,具有高灵敏度、高空间分辨率、可测种类多的特点。使用NMT检测Ca流可直观观察到逆境下Ca流速和方向的变化,研究Ca流对其他离子/分子流的影响,探究Ca在植物抗逆过程中的作用。NMT 在植物中实时记录Ca流已经得到广泛应用,如通过NMT发现ROS 的积累在保卫细胞中诱导Ca信号的产生,同时发现当ABA 浓度过高时,OsANN4 通过调节ROS 产生、介导Ca流入细胞与OsCDPK24 相互作用。在动物细胞中也得到了应用,如NMT测量大脑神经元中Ca跨膜运输。
植物受到外界冷胁迫、机械胁迫、干旱胁迫或盐胁迫时会触发[Ca]瞬时增加,达到μmol·L水平。[Ca]的升高是通过Ca通道实现的,Ca通道允许Ca从细胞外或细胞器进入细胞质中。当胞内Ca瞬时升高激活下游响应机制后,钙离子泵可以通过将过量的Ca排出细胞外或者储存在钙泵中,钙泵包括液泡、线粒、内质网等,如CAXs是Ca/阳离子反向转运蛋白(Ca/cation antiport‑er,CaCA)超家族的一个亚群,CAXs 蛋白介导细胞质Ca进入液泡以防止Ca在细胞质中过度积累,盐胁迫下,SOS2 可通过调节CAX1 维持细胞内Ca平衡。
细胞壁是最早接受外界环境刺激的细胞结构,植物细胞壁由纤维素、半纤维素、果胶和许多糖蛋白组成。受体激酶FER(FERONIA)能感受盐胁迫下植物细胞壁酸化的刺激,FER 定位于细胞膜上,在植物遭受盐胁迫时对维持细胞壁结构起关键作用。在盐胁迫下,细胞壁结构遭受离子损害,该损伤被FER 感知,FER 通过未知途径激活Ca通道,在根细胞中产生Ca信号。FER 功能的丧失导致盐诱导的Ca信号减少和对高盐条件的敏感性增加。此外,细胞壁富含亮氨酸重复延伸蛋白3/4/5(Leucine-rich repeat extensins,LRX3/4/5)、快速碱化因子22/23(Rapid alkalinization fac‑tor,RALF22/23)和FER 作为一个模块能够通过调控激素稳态和ROS积累同时影响植物的生长和盐胁迫耐受性。
目前关于植物盐受体的研究进展表明,位于植物细胞膜上的编码葡萄糖醛酸转移酶(monoca‑tion-induced[Ca]increases 1,MOCA1),将葡萄糖醛酸(glucuronic acid,GlcA)转移到肌醇磷酰肌酰胺(inositol phosphorylceramide,IPC)上,在细胞膜外侧产生糖基肌醇磷酰肌酰胺(glycosyl inositol phosphorylceramide,GIPC)。GIPCs 是长的脂肪酸链,具有带负电荷的葡萄糖醛酸基团,在盐胁迫下能直接结合Na,打开Ca通道,促进[Ca]升高。用200 mmol·LNaCl 溶液处理突变体显示[Ca]含量显著低于正常值,用相同浓度K或Li处理幼苗,突变体中的[Ca]变化与Na处理结果相似。结合一价阳离子能力下降,导致[Ca]无法正常升高和高盐敏感表型。GIPCs 作为单价阳离子感受器,在植物盐信号通路中引发Ca信号产生。然而,GIPC 介导植物Ca通道激活的确切分子机制尚不清楚(见图1)。此外,在高浓度盐胁迫下,植物体内有多个分子开关进行响应,如环核苷酸门控离子通道(cyclic nucleotidegated channels,CNGCs)、高亲和力K通道(high-af‑finity Kchannels,HKTs)、谷氨酸激活通道(gluta‑mate receptors,GLRs)等,进而将胞外K和Na运输到细胞内(见图2)。

图1 盐胁迫导致渗透胁迫、离子胁迫的早期信号OSCA1.高渗透压诱导[Ca2+]i升高1;MOCA1.单价阳离子诱导[Ca2+]i升高1;GIPC.糖基肌醇磷酰肌酰胺;IPC.肌醇磷酰肌酰胺;?.未被发现的感受盐胁迫的钙离子通道Fig.1 Early signal of osmotic stress and ion stress induced by salt stressOSCA1.Hyperosmolality-induced[Ca2+]i increase 1;MOCA1.Monocation-induced[Ca2+]i increases 1;GIPC.Glycosyl inositol phosphorylceramide;IPC.Inositol phosphorylceramide;?.Indicates unknown salt stress induced Ca2+channel
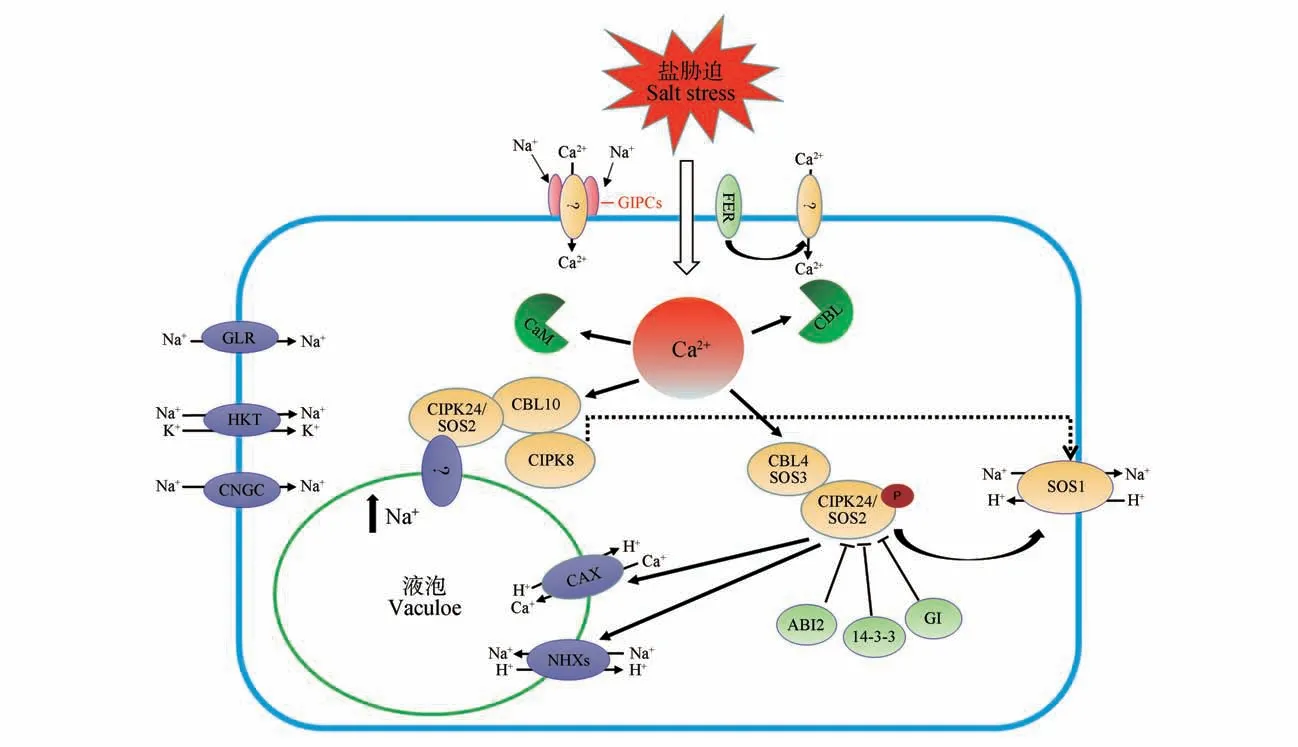
图2 植物盐胁迫应答中的Ca2+信号ABI.脱落酸不敏感蛋白;CaM.钙调蛋白;CAX.Ca2+/H+反向转运蛋白;CBL.钙调磷酸酶B 样蛋白;CIPK.CBL 互作蛋白激酶;CNGC.环核苷酸门控离子通道;FER.FERONIA 受体激酶;GIPC.糖基肌醇磷酰肌酰胺;GI.GIGANTEA 蛋白;GLR.谷氨酸激活通道;HKT.高亲和力K+通道;NHX.Na+/H+反向转运蛋白;SOS.盐过敏感;Vacuole.液泡;14-3-3.14-3-3 蛋白;箭头和条形.激活和抑制;虚线和问号.不确定的途径或未知的成分有待识别Fig.2 Calcium signaling in plant response to salt stressABI.ABA-insensitive;CaX. Ca2+/H+ exchanger;CBL.Calcineurin B-like proteins;CIPK.CBL-interacting protein kinase;CNGC.Cyclic nucleotidegated channel;FER.FERONIA;GIPC.Glycosyl inositol phosphorylceramide;GI.GIGANTEA protein;GLR.Glutamate receptor;HKT.High-affinity K+channel;NHX.Na+/H+ exchanger;SOS.Salt overly sensitive;Vacuole.Vacuole;14-3-3. 14-3-3 protein;The arrow and bars,indicate positive and negative regulation;Dashed lines and question marks,indicate uncertain and unknown mechanism
植物受到盐胁迫时渗透压降低导致水分流失。首个被发现的渗透感受器是使用山梨醇模拟干旱处理,正向遗传筛选拟南芥()突变体库发现的OSCA1(hyperosmolality-in‑duced[Ca]increase 1)。当用山梨醇处理时,无法正常产生钙信号,[Ca]显著低于对照组。在渗透胁迫条件下生长的幼苗中观察到初生根长度变短和叶面积减少,表明其对渗透胁迫的敏感性增加(见图1)。OSCA1是在植物、酵母和人类中保守的Ca通道,OSCA1 胞质结构域的螺旋臂锚定在脂质双层上,当细胞处于缺水环境中,OSCA1 快速感知到细胞外高渗透压引起的质膜张力,从而打开通道,在短时间内允许大量Ca流入细胞内。现已在拟南芥中发现15 个OS‑CA1 同源基因,序列一致性为14%~85%,OSCA1.2和OSCA1 序列同源性约85%,均可在高渗环境中激活,除Ca外,它们还可渗透到单价阳离子,如Na和K。某些基因在气孔保卫细胞中特异性表达,受昼夜节律调控,表明OSCA1参与生物钟的调控。在水稻中具有11 个与OSCA1 同源的基因,OsOSCA1.4 定位于质膜中,能被高渗透压激活,促进胞内Ca增加,进而调节气孔运动和根系生长。拟南芥中Ca渗透性通道OSCA1.3 在免疫信号传递过程中控制气孔关闭,当植物感知到相关病原体分子时,OSCA1.3 被迅速磷酸化,激活通道,触发Ca内流,介导免疫信号传递过程中气孔关闭。在酵母中具有3个同源基因,人类中也发现了同源物,分别是TMEM63A、TMEM63B 和TMEM63C。
2 盐胁迫下Ca2+信号的解码
Ca信号的解码过程包括Ca信号感知及Ca信号传递。细胞内产生Ca信号,由Ca感受元件识别并结合,通过蛋白质之间的相互作用或者构象变化,将Ca信号传递到下游并引起相应的生理过程。在高等植物中已经鉴定出多种Ca感受元件,包括钙调蛋白(calmodulins,CaMs)、钙调素样蛋白(CAM-like proteins,CMLs)、钙依赖性蛋白激酶(calcium-dependent protein kinases,CDPKs)和钙调磷酸酶B 样蛋白(calcineurin B-like proteins,CBLs)。Ca感受元件主要分为两类:Ca响应元件和Ca信号传感元件。Ca响应元件通常结合Ca并发生构象改变,从而改变蛋白质自身结构和活性,通过分子内相互作用触发特定生化反应,如CDPK。而Ca信号传感原件,因为缺乏响应结构域,所以这类感受原件先与Ca结合发生构象改变,再传递给响应Ca信号的互作蛋白,互作蛋白根据酶活性或结构的某些变化做出响应,通过分子间相互作用实现生化响应,如CaM、CML 和CBL。
2.1 CDPKs在Ca2+信号解码中的作用
CDPKs是一个庞大的感受Ca信号家族,只存在于植物、原生生物、卵菌和绿藻中,而不存在于动物和真菌中。CDPKs 在拟南芥中有34 个成员,水稻有29 个成员,小麦有20 个成员。CDPK 是分子量为40~90 kDa 的单体蛋白质,由5 个结构域组成:N 端结构域、蛋白激酶催化结构域、自身抑制结构域、钙调蛋白样调节结构域(calmodulinlike regulatory domains,CaM-LD)和C 端结构域。CaM-LD 结构域包含EF-手性结构(一种螺旋—环—螺旋结构),可以与Ca结合,识别Ca信号,EF-手性结构大多成对存在,以增加结构的稳定性。CaM-LD 的C 端与Ca结合亲和力高,在低Ca水平下,这种结构通过与蛋白质的自抑制区相互作用而稳定。反之,当Ca浓度升高,Ca与CaM-LD的低亲和力N 端结合引起的构象改变,自抑制结构域被释放。研究发现,AtCPK1 通过降低HO和丙二醛的产生,增加脯氨酸的积累来调节盐和干旱胁迫。在水稻中,高盐情况下OsCDPK4 在保护膜脂质过氧化中发挥积极作用。用NaCl 处理,突变体植株根系中Na水平升高,且高于野生型植株。此外,NaCl 处理后突变体的HO产生水平高于野生型,所以CPK12 是植物适应盐胁迫所必需的。CPK23 响应干旱和盐胁迫,与CPK21 在保卫细胞中共同作用于脱落酸(abscisic acid,ABA)信号途径的细胞阴离子通道SLAC1,ABA 含量在盐胁迫和干旱胁迫下也显著增加。NaCl 诱导CPK27 的表达,在种子发芽和幼苗生长方面,突变体对盐胁迫的敏感性比野生型植物高得多。
2.2 CaMs和CMLs在Ca2+信号解码中的作用
Ca信号传感元件主要由CaMs和CMLs组成。CaM 是这类Ca传感元件的重要成员,存在于所有真核生物中,分子量在16.7~16.8 kDa,在拟南芥中,只有7 个典型的CaM 基因,而已鉴定的CML 基因超过50 个。所有AtCaMs 都具有非常相似的蛋白序列,有149 个氨基酸,含有4 个EF-手性结构。相比之下,AtCMLs 有80~330 个氨基酸,含有2~4个EF-手性结构。CaM 与Ca结合导致构象改变。这种变化暴露了CaM 的疏水表面,这有助于以Ca依赖的方式与靶蛋白相互作用,从而改变它们的活性。CaM 与Ca结合形成活化的Ca-CaM复合物,该复合物与靶酶结合导致其活化,这些靶酶包括环核苷酸磷酸二酯酶(cyclic nucleotide phosphodiesterase,PDE)、腺苷酸环化酶和烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleo‑tide,NAD)激酶等。研究表明,CaM 在激活胁迫相关蛋白、增强植物的非生物胁迫耐受性方面发挥着重要作用,如AtCaM1/4 在盐胁迫下表达上调,通过与-亚硝基谷胱甘肽还原酶结合在NO 信号通路中增强耐盐性。据报道,许多CML 基因参与了非生物胁迫信号传导。结果表明,在植物对盐胁迫的反应中,Ca传感元件可能在连接Ca信号和下游靶蛋白中起重要作用(见图2)。Ca信号传感元件中的另一个重要成员是CBL,CBLs 和CBL 互作蛋白激酶(CBL-interacting protein kinase,CIPKs)通常形成CBL-CIPK 复合物感知盐胁迫下植物的钙信号并将信号传递到下游。
2.3 CBL-CIPK 复合物在Ca2+信号解码中的作用
CBLs 是一组独特的Ca感受器,通过激活植物特异性蛋白激酶家族CIPKs 来解码Ca信号。CBL-CIPK 复合物构成了一个信号网络,通过磷酸化下游靶蛋白改变其生物活性以响应各种细胞外信号,如营养缺乏和非生物胁迫。大多数CBL 蛋白定位于质膜和液泡膜,因此,CBL-CIPK 复合物通过靶向质膜和液泡膜中的转运蛋白和通道来控制膜转运的功能。这一特征将Ca信号与植物营养感知和体内离子平衡联系起来。CBL-CIPK 信号网络的基因组组成已经在整个植物界的各种已测序植物物种中建立。在拟南芥中的10 个CBLs 和26 个CIPKs 中,每个CBL 与一个CIPK 相互作用,每个CIPK 与一个或多个CBL 相互作用。因此,一些CBL 有共同的CIPK,一些CIPK 结合共同的CBL。这种蛋白质间相互作用的特异性和重叠性赋予植物体内CIPK 复合物功能特异性和协同性。
CBL 蛋白具有4 个EF-手性结构域,负责结合Ca。与CBL 相对紧凑的结构不同,CIPK 包含多个功能不同的结构域,所有CIPK 在N 端有一个激酶结构域,在C 端有几个调控结构域,包括CBL 结合结构域。CBL-CIPK 相互作用能够增强CIPK 的活性,是因为CBL 与CIPK 的结合将N 末端激酶结构域从C 末端自身抑制结构域中释放出来。与CBL 相互作用结构域相邻,CIPK 蛋白包含另一个特征不太明显的蛋白磷酸酶相互作用结构域(pro‑tein phosphatase interaction,PPI)。该结构域负责与2 型蛋白磷酸酶(2C-type protein phosphatase,PP2C)作用,如脱落酸不敏感1(ABA-insensitive 1,ABI1)和ABI2。在结构分析中,CBL相互作用结构域和PPI 结构域可能重叠,表明CBL 和PP2C 与CIPK 的相互作用可能是互斥的。这样的结构特征可能提供了一种机制,即通过同时阻止CBL 激活和CIPK 的磷酸酶失活,为下游底物的调控修饰提供开关。为了解码特定时间和空间的Ca信号,一些Ca感受器必须定位于紧邻Ca释放位点的不同膜室。植物CBL-CIPK 的一个关键特征是它们能够在不同的生物膜上起作用,使它们能够解码空间上不同的Ca信号。在拟南芥中,一半的CBLs 成员(CBL1、4、5、8、9)含有一个N 末端脂质修饰基序或一个将蛋白质锚定在质膜上的多元结构域。其他一些成员(CBL2、3、6、10)含有与液泡膜相关的序列。CBLs可以将CIPKs 招募到指定的膜(质膜或液泡膜)上,以一组独特的底物为目标。
盐过敏感(salt overly sensitive,SOS)途径是第一个确定的维持植物细胞离子稳态的CBL-CIPK途径,能够通过多种途径增强植物的耐盐性。植物在盐环境中正是通过盐受体GIPC 感受到盐胁迫后,激活SOS 途径将Na转运出胞外抵御盐胁迫,SOS 途 径 主 要 基 于SOS3(AtCBL4)、SOS2(AtCIPK24)和SOS1(Na/H反向转运蛋白)。SOS3感知盐胁迫诱导的胞内Ca升高,结合Ca的SOS3与SOS2 相互作用并激活SOS2。SOS3 的N 端被肌氨酰化并与质膜结合,从而使SOS3-SOS2 复合物到质膜上,SOS2 是一种蛋白激酶,在正常条件下是一种自抑制激酶,但在盐胁迫条件下,SOS3 与SOS2 的自抑制结构域结合,从而释放其自抑制作用磷酸化SOS1。SOS1 的胞质C 末端区域较长,在最末端有一个自抑制结构域,自抑制结构域的丝氨酸残基被SOS2 磷酸化。磷酸化后,SOS1 的Na/H反转运子活性增强,利用H梯度驱动Na外排,因此降低细胞质内Na浓度并促进Na的稳态和长距离的转运。此外,SOS2 还能通过与液泡Na/H交换器(Na/Hexchanger,NHX)相互作用并调节Na/H比率,将过量的Na隔离到液泡中从而维持离子平衡,而ABI2、GI 和14-3-3 蛋白可抑制SOS2激酶活性。CBL10 主要在芽和叶中表达,可在液泡膜上与SOS2 相互作用,激活位于液泡膜上Na通道或转运体,转运细胞质Na,并且CBL10 可以激活CIPK8,通过SOS1 将胞内过量Na排出胞外(见图2)。
3 讨论与展望
盐胁迫对植物生长、发育和作物产量产生严重的不利影响。作为固着生物,植物进化出复杂的调控机制,能够快速感受盐胁迫引起的离子胁迫、渗透胁迫以及次级胁迫,瞬时升高[Ca]浓度并激活下游响应信号通路来抵抗盐胁迫。在过去的20年里,大量的基因组学、遗传学和分子生理学研究已经在一定程度上阐明植物对盐胁迫反应的运输调节和信号机制,许多信号级联已被确定为能够调节胞内Na浓度以响应外界环境的变化。Ca信号是响应盐胁迫最重要的信号级联方式之一,植物盐感受器GIPC 等参与盐胁迫诱导的细胞质内[Ca]的增加,Ca感受元件CaM、CML、CBL和CIPK 介导Ca信号传导,而CBL-CIPK 是解码盐胁迫下Ca信号并将该特异性信号转化为应对下游反应的中心和关键。
目前,Ca信号参与植物盐胁迫响应的研究已取得初步进展,对Ca信号通路的研究,为深入了解植物信号转导机理提供帮助,为提高植物适应盐胁迫环境的研究拓展了新思路。本文通过总结盐胁迫下Ca信号通路中Ca感受器,Ca转运系统等元件,对Ca信号通路上各组分参与植物盐胁迫响应的研究进行了归纳总结。目前Ca信号通路上部分元件的上下游元件还未被完全发现,利用免疫共沉淀、双分子荧光互补与酵母双杂交等技术,将找出激活盐胁迫下植物Ca通道的上下游蛋白组分及其功能和特性。在植物育种方面,可利用分子标记辅助育种、诱变育种、遗传转化和基因组编辑等技术将研究成果应用到作物栽培中,从而获得耐盐品种。综上所述,Ca作为细胞内重要第二信使,解析Ca信号通路在植物盐胁迫防御中的作用将推动植物抗盐的研究,也为增强农作物抗盐能力提供理论支撑。
