菱角壳黄酮提取工艺优化及抑肿瘤细胞增殖活性作用
2022-08-03雷秋琪叶诗洁黄永康王宏勋王丽梅
雷秋琪,叶诗洁,黄永康,杨 过,周 敏,3,王宏勋,3,王丽梅,3,
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.武汉轻工大学生命科学与技术学院,湖北武汉 430023;3.湖北省生鲜食品工程技术研究中心,湖北武汉 430023)
菱角作为我国民间一种药用佳果已有几千年的历史[1]。根据《中华药海》所记载:“菱壳性味微苦、涩,性凉,入肺、脾、肠三经,具有解毒疗疮、涩肠止泻、清华湿热的功效”。《中药大辞典》记载:“菱壳可治腹泻、脱肛、痔疮、黄水疮、天泡疮”。研究表明,菱角壳具有抗肿瘤细胞增殖、抗氧化、抗菌、降糖和抗炎等作用[2-5]。在中国的民间用药中,菱角壳被用于辅助治疗癌症[6-10]。牛凤兰等[11]用富含三羟基苯甲酸二聚体粗菱壳水提物对MFC 荷瘤小鼠进行体内实验,发现菱角壳水提物具有抑瘤效果而且存在量效关系。文献报道菱角壳中含有生物碱、酚酸类、萜类、黄酮类及多糖等功能成分[12-14]。李丽等[15]对东北菱黄酮类化合物的成分进行定性定量分析,发现其中可能含有黄酮苷或苷元、山奈酚、高良姜素的2 个对映异构体以及多种其他成分。黄酮[16-17]具有抗氧化性[18-19],可作为天然抗氧化剂用于食品行业。另外,黄酮还具有抗肿瘤、抗炎镇痛、保护肝脏等功效[20-25],可用于相关疾病的药物开发。常见的黄酮提取方式有热水浸提法[26]、有机溶剂提取法[27]、超声波提取法[28-29]、酶解法[30]、膜分离提取法[31]、超临界流体萃取[32]。其中,热水浸提、有机溶剂提取法等是实验室常见提取工艺。主要依据相似相溶的原理[27],一般具有操作简单、实验器材要求低、节约成本等诸多优点。另外, 酶解法具有高度专一的特性,能够避免使用有机试剂且具有较高的提取率,但作用条件不便于调控。膜分离浓缩可以减少干燥时间,提高干燥效率。超临界CO2萃取是目前国际上公认的先进物理萃取技术,主要是运用其溶剂力将超临界流体与萃取物接触,选择性分离提纯。但这三种提取方式均成本较高,不适于大规模生产。
根据目前的研究现状,黄酮已经广泛用于植物抗肿瘤活性的研究中[33],但将菱角壳黄酮用于抗肿瘤活性的文献并不多见。其中Hela 作为常见的人源肿瘤细胞[34-35],也没有相关报道将其用于验证菱角壳黄酮的抗肿瘤活性。常见的用来检测肿瘤细胞增殖活性的方法有很多[36-37],如:台盼蓝染色法、3H 放射性同位素掺入法、MTT 法、细胞仪法等。MTT 法形成的蓝紫色结晶甲瓒(Formazan)物质不溶于水[28],添加有机溶剂溶解后,因为弃去上清液的同时可能会丢失少部分的Formazan,因此可能会产生误差。为了减少实验误差,目前更常用CCK-8 法检测细胞增殖活性。CCK-8 法比MTT 法对细胞浓度变化更敏感,测得的结果则更为准确。
因此,本研究以湖北洪湖菱角种植区所产的菱角取壳做为原料,采用单因素实验结合响应面分析法优化菱角壳黄酮提取工艺,运用CCK-8 法检测菱角壳黄酮对人宫颈癌Hela 细胞增殖的影响。拓展黄酮类物质的提取来源,为菱角壳黄酮的体外的抗肿瘤活性研究及菱角壳的开发利用理论基础。
1 材料与方法
1.1 材料与仪器
菱角壳(两角菱,Water chestnut shell) 湖北洪湖菱角种植地;人宫颈癌Hela 细胞株 武汉百迈生物科技有限公司;无水乙醇(分析纯)、芦丁标品、亚硝酸钠(NaNO2,分析纯)、硝酸铝(Al(NO3)3,分析纯)、氢氧化钠(NaOH,分析纯) 国药集团化学试剂有限公司;磷酸缓冲盐溶液(PBS)、DMEM(Dulbecco’s modified Eagle's medium)高糖培养基 塞默尔飞世尔生物化学制品有限公司;5-氟尿嘧啶(5-Fu)sigma 公司;胎牛血清(Fetal Bovine Serum) 浙江天杭生物科技有限公司;青霉素链霉素溶液-双抗(后文均简称双抗) 上海斯信生物科技有限公司;胰蛋白酶(Trypsin)、乙二胺四乙酸(EDTA) 吉诺生物医药技术有限公司;二甲基亚砜(DMSO) 湖北百奥斯生物科技有限公司;细胞活力检测试剂盒(cell counting kit-8,CCK-8) 日本同仁试剂公司。
BL 2000F 型电子天平 上海升隆电子科技有限公司;PL402-L 型电子天平 梅特勒-托利多仪器有限公司;HH-S114 型电热恒温水浴锅 上海太仓精宏仪器设备有限公司;721-100 型紫外可见分光光度计 上海菁华科技仪器有限公司;T25 细胞培养瓶、冻存管 北京中创先锋科技有限责任公司;96 孔培养板 上海化科实验器材有限公司;CW-CJ-2FD 型双人单面净化工作台 苏州净化设备公司;SCHP-80 型CO2培养箱 深圳市奥德玛电子科技有限公司;BX19-HK830 型倒置显微镜 奥林巴斯有限公司;SUNRISE 型酶标仪 奥地利Tecan 公司;普通冰箱、-80 ℃低温冰箱 海尔集团;DHG-9145A 型电热恒温鼓风干燥箱 上海恒科学仪器有限公司;TGL-16GB 型离心机 北京医用离心机厂制造;GR60DA 型立式自动压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;SCIENTZ-12N 型真空冷冻干燥机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 样品处理 选用新鲜的菱角,摘去果肉,将菱角壳洗干净之后放在40 ℃烘箱中烘干,用药物粉碎机粉碎,过80 目筛得菱角壳粉,4 ℃下避光保存备用。
1.2.2 单因素实验 通过实验室原有实验基础以及相关文献资料,确定了对菱角壳总黄酮含量有明显影响的四个因素:提取时间、料液比、乙醇浓度、提取时间。
a:提取时间对菱角壳黄酮提取得率的影响:准确称取15 份菱角壳粉,每份1.0 g,置于500 mL 三角瓶中,分为五个实验组,每组三个平行。选取浓度为70%的乙醇水溶液作为其提取溶剂,选取1:30 的料液比,将三角瓶分别放置在50 ℃恒温水浴锅中提取,并分别提取10、30、50、70、90 min,提取结束后用纱布进行过滤,得到样品液,冷却待测。
b:料液比对菱角壳黄酮提取得率的影响:选取浓度为70%的乙醇水溶液作为其提取溶剂,料液比分别为1:20、1:30、1:40、l:50、1:60,将三角瓶分别放置在50 ℃恒温水浴锅中提取50 min,其余实验操作与提取时间实验组相同。
c:乙醇浓度对菱角壳黄酮提取得率的影响:分别选取浓度为30%、40%、50%、60%、70%的乙醇水溶液作为其提取溶剂,料液比为1:30,将三角瓶分别放置在50 ℃恒温水浴锅中提取50 min,其余实验操作与提取时间实验组相同。
d:提取温度对菱角壳黄酮提取得率的影响:选取浓度为70%的乙醇水溶液作为其提取溶剂,料液比为1:30,将三角瓶分别放置在40、50、60、70、80 ℃恒温水浴锅中提取50 min,其余实验操作与提取时间实验组相同。
1.2.3 Box-Behnken 试验设计 如表1所示,根据单因素实验的结果,结合Box-Behnken 中心组合的试验来设计优化试验,分析影响菱角壳黄酮提取得率主要因素,得出最佳提取工艺。

表1 响应面试验因素水平Table 1 Response surface experimental factor level
1.2.4 总黄酮含量的测定方法:
1.2.4.1 制作标准曲线 分别准确量取0.3 mg/mL芦丁标准品溶液(无水乙醇溶解)1、2、3、4、5、6、7、8 mL 置于25 mL 容量瓶中,取无水乙醇分别补充至1 mL,加超纯水至12.5 mL,再加入5% NaNO2溶液0.7 mL,充分混合均匀,静置5 min。再加入10%Al(NO3)3溶液0.7 mL,混合均匀,静置6 min 后,加入1 mol/L NaOH 溶液5 mL。最后加入无水乙醇补充样液的总体积至25 mL,混合均匀,静置10 min。另取1 mL 无水乙醇,按照相同步骤进行处理后作为空白对照,在最大吸收波长510 nm 处,使用紫外可见分光光度计测定吸光度,以吸光度Y 值为纵坐标(Y),以相应试管中浓度X(mg/mL)为横坐标(X),绘制标准曲线,得出回归方程。
1.2.4.2 测定样品中总黄酮含量 取1 mL 样品液(无水乙醇溶解),置于25 mL 容量瓶中,加超纯水至12.5 mL,再加入5% NaNO2溶液0.7 mL,混合均匀,静置5 min。再加入10% Al(NO3)3溶液0.7 mL,混合均匀,静置6 min,加入1 mol/L NaOH 溶液5 mL,最后加入无水乙醇水补液至25 mL,摇匀之后再静置10 min。直接取1 mL 超纯水按照相同步骤进行处理后作为空白对照,在最大吸收波长510 nm 处,使用紫外可见分光光度计测定吸光度,最后结合标准曲线计算测定样品中总黄酮浓度计算总黄酮提取得率。样品中总黄酮得率式中,C 为由标曲得出的总黄酮浓度,mg/mL;V 为样液总体积,mL;m 为菱角壳粉的质量,g。
1.2.5 菱角壳黄酮对Hela 细胞增殖活性的影响
1.2.5.1 药品配制方法 a:培养基:以DMEM 高糖培养基:胎牛血清:双抗=90:10:1 的比例,取45 mL的DMEM 高糖培养基5 mL 胎牛血清、0.5 mL 双抗配制成50 mL 培养基。
b:冻存液:将DMEM 高糖培养基、胎牛血清、DMSO 按照7:3:1 比例混合配制成冻存液,密封保存于4 ℃冰箱。
1.2.5.2 菱角壳黄酮纯化及样品配制 根据实验室研究基础以及现有研究成果[38-39],采用AB-8 大孔树脂对菱角壳黄酮粗体物进行纯化,以进行后续实验。预处理:将AB-8 大孔吸附树脂用无水乙醇浸泡24 h 以充分溶胀后,95%乙醇冲洗至洗出液加5 倍量超纯水时无白色浑浊,超纯水洗三次,密封保存,备用。再生:将使用过树脂用无水乙醇洗脱至无色后,0.5 mol/L 盐酸浸泡2 h,水洗至中性,0.5 mol/L NaOH 浸泡2 h,水洗至中性。纯化工艺为:将处理过的AB-8 大孔吸附树脂加入26×50 mm 层析柱中,吸附流速0.8 mL/min,一次洗脱上样体积为20 mL,样品浓度10 mg/mL,用70%乙醇溶液洗脱,洗脱样品的流速为0.8 mL/min,经纯化浓缩冻干后得到菱角壳黄酮纯化物。
菱角壳黄酮溶液的配制:按照1.2.1 中得出的提取工艺进行菱角壳黄酮粗提取物的提取,并取一定量菱角壳黄酮粗提物按照上述方法进行纯化。分别称量80 mg 菱角壳黄酮粗提物、菱角壳黄酮纯化物、5-Fu 溶解于1 mL DMSO 溶液中,用DMEM 培养基分别稀释到50、100、200、400、500、600、700、800 μg/mL。黄酮不溶于水,可溶于DMSO,而DMSO溶液本身对细胞具有毒害作用,以DMSO 作为溶剂配置相应浓度的药品时,其浓度不可高于0.5%。
1.2.5.3 Hela 细胞复苏 将冻存于-80 ℃冰箱装有Hela 细胞的冻存管取出后迅速放入37 ℃水浴锅中快速解冻,解冻后立即停止水浴,将冻存管移入超净工作台,用移液枪轻轻吹打细胞使之悬浮混匀,将冻存管所有细胞转移到离心管中离心(1000 r/min,5 min),离心结束后弃去离心管中的上清液。在离心管中加入1 mL DMEM 高糖培养基,用移液枪轻轻吹打离心管底部,使底部细胞悬浮并与DMEM 高糖培养基充分混匀。将细胞转移到T25 细胞培养瓶中,加入4 mL DMEM 高糖培养基,将瓶盖拧紧,水平划十字摇匀后将培养瓶放入37 ℃、5% CO2培养箱中培养。放入培养箱之前注意用75%酒精喷洒培养瓶,以达到灭菌目的。放入培养箱之后适度将瓶盖拧紧后再回转半圈,以达到与培养箱通气目的。每24 h 换液一次:把培养基吸出,加1 mL PBS,盖上瓶盖轻轻摇动后弃去PBS,反复清洗三次,在培养瓶中加入5 mL DMEM 高糖培养基,最后放入37 ℃、5%CO2培养箱培养。
1.2.5.4 细胞传代 首先在倒置显微镜下观察,将融合度大于90%的培养瓶挑出,弃去培养基,向培养瓶中加入1 mL PBS 清洗细胞,随后弃去PBS,反复三次,在培养瓶中加入1 mL 胰蛋白酶消化1 min,立即弃去胰蛋白酶。在培养瓶中加入1 mL DMEM 高糖培养基,终止消化,用移液枪将瓶壁上剩余的细胞轻轻吹打使之脱落。将培养瓶中的细胞转移到15 mL离心管内,1000 r/min 离心5 min,弃去上清液。按照适当密度在离心管中加入2~3 mL 培养基,用移液枪轻轻吹打使离心管底部细胞浮起,再将离心管中细胞转移1 mL 至装有4 mL 培养基的T25 瓶内,轻轻摇匀,定期观看细胞生长状态。Hela 细胞传代培养若干代后,待Hela 细胞处于对数生长期时,细胞活力增强,细胞密度明显增大,此时的细胞就可以用于CCK-8 法测定药物对肿瘤细胞的增殖抑制作用。
1.2.5.5 细胞冻存 取对数生长期细胞,冻存前2 h换液一次,用胰蛋白酶消化制成细胞悬浮液,转移到离心管中离心(1000 r/min、5 min)后弃去上清液。在离心管中添加1.5 mL 冻存液,用移液枪轻轻吹打细胞,使之悬浮并与冻存液混匀后,将细胞转移至冻存管中。用封口膜密封,贴上标签,标记名称、时间。实行分阶段降温:4 ℃保存2 h,随后-20 ℃保存2 h,最后将细胞转移至-80 ℃下冻存。
1.2.5.6 CCK-8 法测定菱角壳黄酮对Hela 细胞增殖抑制作用 实验开始前首先用胰蛋白酶消化细胞,将细胞制成悬浮液,置于15 mL 离心管中离心(1000 r/min,5 min),最后在离心管中加入8 mL 培养基。将浓度为1×105cells/mL 的Hela 细胞悬浮液接种96 孔培养板,取三瓶细胞分别接种于三个96 孔培养板,每个孔加入100 μL 细胞液。一个培养板用3 种药品,每种药品有5 个浓度,每一个浓度5 个复孔,同时设置5 个空白对照孔。三个培养板置于37 ℃、5%CO2培养箱中48 h,使孔板中细胞生长状态同步,培养期间有换液步骤。48 h 后,向培养板中分别加入200 μL 浓度分别为50、100、200、400、800 μg/mL的菱角壳黄酮粗提物、菱角壳黄酮纯化物、5-Fu。其中5-Fu 作为阳性对照,另外加入200 μL 培养基作为空白对照,分别培养12、24、48 h。达到适当时间后移除孔板中的培养基,加入100 μL 新鲜培养基,避光加入10 μL CCK-8 试剂,置于37 ℃、5% CO2培养箱中孵育3 h,用酶标仪于450 nm 条件下读数,测出OD 值。按照以下计算公式计算细胞增殖抑制率:细胞增殖抑制率其中,OD实验组值:菱角壳黄酮提取物或5-Fu 处理孔的OD 值;OD对照组值:无药物处理孔的OD 值。
根据不同样品不同浓度对Hela 细胞的增殖抑制率,选择抑制率在50%左右的浓度范围,进一步试验得出半抑制质量浓度,即IC50值。以样品浓度作为横坐标,抑制率IC%为纵坐标,作线性回归方程,分别计算菱角壳黄酮粗提物、纯化物,以及5-Fu 作用12、24、48 h 的IC50值。
1.3 数据处理
本文中,单因素实验与响应面试验的实验组样品平行次数与测试平行次数均为3次,而CCK-8 法测定菱角壳黄酮对Hela 细胞增殖抑制作用的实验中,均复孔5次,以均值表示最终结果。利用Excel 2020、SPSS16.0、Design ExpertV8.0.6.1 软件进行数据分析以及绘图处理。
2 结果与分析
2.1 单因素实验结果分析
2.1.1 提取时间对菱角壳黄酮得率的影响 如图1所示,在实验组中,提取时间为30 min 时菱角壳黄酮得率最高为3.04%。当提取时间小于30 min 时,菱角壳黄酮提取得率随着提取时间的增加而上升成,而后,随着提取时间增加,菱角壳黄酮得率会随之下降。原因可能是提取时间过长,使得原料中的其他醇溶性物质被溶解,进而导致杂质增加,使得黄酮提取率下降。因此,选择提取时间10、30、50 min 作为响应面试验的因素水平。提取时间的变化对菱角壳黄酮提取得率的影响极显著(P<0.01),以上结果表明提取时间对菱角壳黄酮得率有影响。

图1 提取时间对菱角壳黄酮提取得率的影响Fig.1 Effect of extraction time on the extraction yield of water chestnut flavonoids
2.1.2 料液比对菱角壳黄酮得率的影响结果分析如图2所示,在实验组中,料液比为1:30 g/mL 时菱角壳黄酮提取效果最佳,此时的菱角壳黄酮得率为3.13%。料液比超过1:30 g/mL 之后,菱角壳黄酮得率呈下降趋势。产生这种现象的原因可能是溶剂用量少时,提取不够充分,但随着溶剂增多,其它杂质的溶出率也会增大。因此,选择料液比1:20、1:30、1:40 g/mL 作为响应面试验的因素水平。料液比的变化对菱角壳黄酮得率的影响极显著(P<0.01),以上结果表明料液比对菱角壳黄酮得率有影响。

图2 料液比对菱角壳黄酮提取得率的影响Fig.2 Effect of the ratio of material to liquid on the extraction yield of water chestnut flavonoids
2.1.3 乙醇浓度对菱角壳黄酮得率的影响结果分析由图3所示,在实验组中,乙醇浓度为50%时菱角壳黄酮提取得率最高为3.20%。当乙醇的浓度超出50%时,菱角壳中总黄酮得率与乙醇浓度成反比。原因可能是乙醇浓度过高,某些醇溶性杂质和脂溶性物质的溶出率会增大,使黄酮类物质的溶出受到影响,从而造成菱角壳黄酮的提取率下降。因此,选择乙醇浓度40%、50%、60%作为响应面实验的因素水平。乙醇浓度的变化对菱角壳黄酮得率的影响极显著(P<0.01),以上结果表明乙醇浓度对菱角壳黄酮得率有影响。
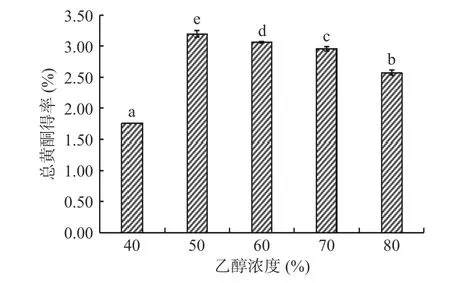
图3 乙醇浓度对菱角壳黄酮提取得率的影响Fig.3 Effect of ethanol concentration on the extraction yield of water chestnut flavonoids
2.1.4 提取温度对菱角壳黄酮得率的影响结果分析如图4所示,在实验组中,提取温度为60 ℃时,菱角壳黄酮提取效果最佳,对应总黄酮提取率为3.11%。当提取温度变化时,40、50、70 ℃处理,以及60、70 ℃处理之间对于菱角壳黄酮提取得率的影响差异并不显著(P>0.05)。以上结果表明提取温度对菱角壳黄酮提取得率没有影响,因此在进行响应面试验设计时可以舍去对该因素的讨论,固定提取温度为60 ℃。

图4 提取温度对菱角壳总黄酮提取得率的影响Fig.4 Effect of extraction temperature on the extraction yield of total flavonoids from water chestnut shell
2.2 响应面试验结果分析
2.2.1 响应面试验结果 根据Design Expert 软件提供的模型,选取提取时间(X1,min)、料液比(X2,g/mL)、乙醇的浓度(X3,%)为变量因素,设定响应值为菱角壳总黄酮得率(Y,%),响应面试验结果如表2:

表2 响应面试验结果Table 2 Response surface experimental design and results
2.2.2 回归模型建立及方差分析 通过Design-Expert软件进行回归分析得到回归方程:Y=-9.77070+0.11095X1+161.07200X2+0.34237X3-0.10900X1X2+1.36250E-004X1X3-0.80800X2X3-2.07225E-表3所示,模型P<0.0001,达到极显著水平;失拟项P>0.05,表示方程拟合度良好。方差分析的结果表明提取时间、料液比和乙醇浓度对菱角壳黄酮得率的影响均极显著(P<0.01)。P(X1X2)>0.05、P(X1X3)>0.05、P(X2X3)<0.01,由此证明,料液比(X2)和乙醇浓度(X3)的交互作用对菱角壳黄酮得率的影响显著,其余交互作用的影响不显著。
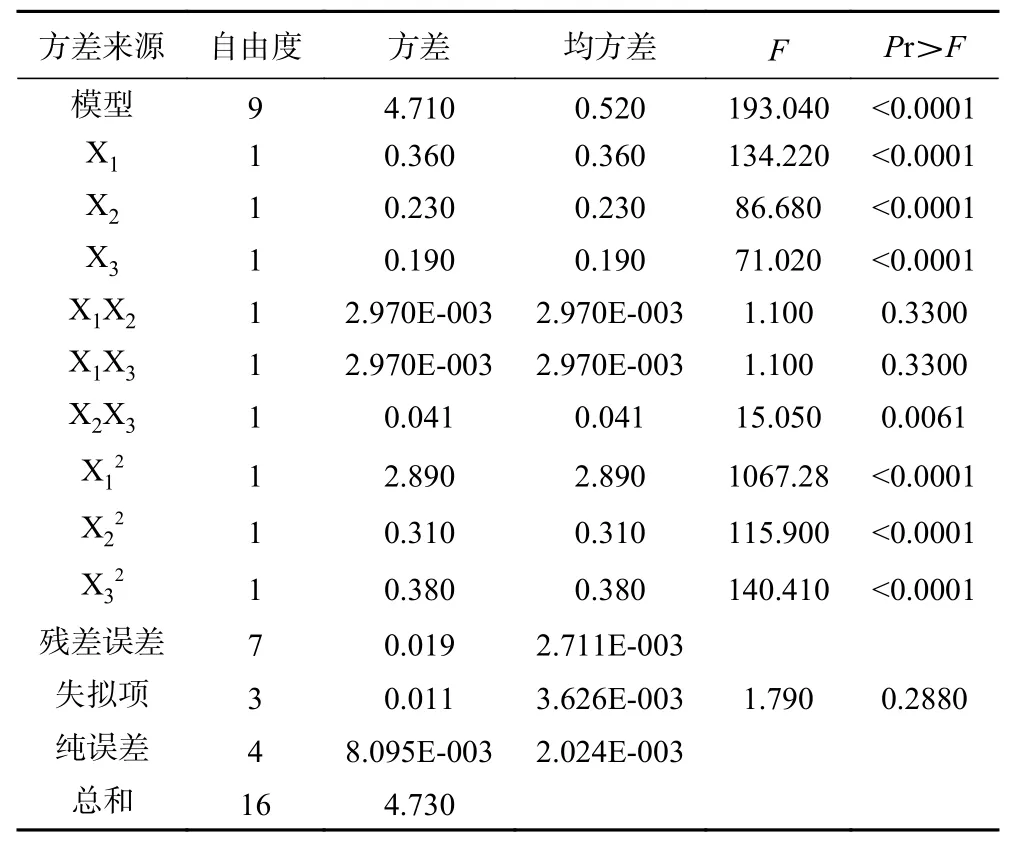
表3 回归模型方差分析Table 3 Analysis of variance of regression model
2.2.3 两两因素交互作用分析 为了使结果更直观,做出三维空间图进行进一步的分析:响应面坡度越陡峭,表明响应值对于条件的改变越敏感,该因素对菱角壳黄酮得率的影响越大;反之则表明该因素对菱角壳黄酮得率的影响越小。如图5所示,在各因素两两交互作用对总黄酮得率的影响中,提取时间与料液比的交互作用显著,提取时间与乙醇浓度、料液比与乙醇浓度的交互作用对菱角壳黄酮得率的影响不显著,这与方差分析的结果一致。

图5 各因素两两交互作用对总黄酮得率的影响Fig.5 Effect of the interaction of various factors on the yield of total flavonoids
2.2.4 优化工艺的验证实验 通过 Design-Expert 软件设计响应面试验优化菱角壳黄酮提取工艺的条件,结果显示最佳提取工艺:提取时间27.65 min、料液比1:33.33 g/mL、乙醇浓度53.13%,对应的总黄酮得率为3.512%。为了实际操作可行,将最佳工艺条件修正为:提取时间28 min、料液比1:33 g/mL、乙醇浓度53%,对应的总黄酮得率为3.512%,对该工艺条件下进行验证,重复实验三次,得到菱角壳总黄酮得率为3.455%±0.16%。实际值与模型预测值相近,表明该模型具有一定的可行性。
2.3 菱角壳黄酮对Hela 细胞增殖的影响
2.3.1 不同药物不同条件对Hela 细胞增殖的影响根据不同浓度、不同作用时间的菱角壳黄酮粗提物溶液、菱角壳黄酮纯化物溶液、5-Fu 溶液对Hela 细胞增殖的抑制率,评价菱角壳黄酮对Hela 细胞的增殖抑制效果。5-Fu,即胸苷酸合成酶抑制药,是尿嘧啶5 位上的氢被氟取代的衍生物。5-Fu 在细胞内转变为5-氟尿嘧啶脱氧核苷酸(5F-dUMP),而抑制脱氧胸苷酸合成酶,阻止脱氧尿苷酸(dUMP)甲基化转变为脱氧胸苷酸(dTMP),从而影响DNA 的合成。此外,5-FU 在体内可转化为5-氟尿嘧啶核苷,以伪代谢产物形式掺入RNA 中干扰蛋白质的合成,从而干扰细胞增殖,可作为阳性对照。
根据表4可知菱角壳黄酮粗提物、纯化物均对Hela 细胞具有抑制作用,这种抑制作用在实验范围内,均弱于阳性对照5-Fu。同时,菱角壳提取物对Hela 细胞增殖的抑制作用与提取物的浓度、作用时间均呈正相关,会随着作用时间的增加或作用浓度的升高而增长。本文中的实验组参数范围内,并未出现高浓度或长时间抑制作用。此外,药物浓度低至50 μg/mL 时,作用相同时间,5-Fu 抑制率>菱角壳黄酮粗提物抑制率>菱角壳黄酮纯化物溶液抑制率,;当药物浓度在100~800 μg/mL 时,5-Fu 溶液抑制率>菱角壳黄酮纯化物抑制率>菱角壳黄酮粗提物溶液抑制率。出现这种现象的原因可能是,低浓度的菱角壳黄酮对于Hela 细胞的毒性作用不明显,需要浓度累积,并且由于其对于微生物的抑制作用反而会为Hela 细胞提供更好的生长环境。黄酮类物质对于Hela 细胞等肿瘤细胞具有一定的细胞毒性,可通过促进细胞凋亡来抑制其增殖。根据现有文献报道[40-41],大多数情况下这种抑制作用,有一定的浓度依赖,与本文的研究结果一致。

表4 不同药物不同条件下对Hela 细胞增殖的抑制作用Table 4 Inhibitory effects of different drugs on the growth of Hela cells under different conditions
2.3.2 不同药物抑制Hela 细胞的IC50值 IC50值[42-43](half maximal inhibitory concentration)是指示某一物质(主要指抑制剂)或者药物在抑制某些生物程序的时半量。在凋亡方面,可以理解为一定浓度的某种药物诱导细胞凋亡率达到50%,该浓度称为50%抑制浓度,即凋亡细胞与全部细胞数之比等于50%时所对应的浓度。IC50值可以用来衡量药物诱导凋亡的能力,即诱导能力越强,该数值越低。
根据表5可知随着作用时间的增加,菱角壳黄酮粗提物、纯化物、5-Fu 的IC50值逐渐下降,则进一步证明在已验证的48 h 处理时间内,菱角壳黄酮粗提物、菱角壳黄酮纯化物、5-Fu 对Hela 细胞的增殖抑制作用均有时间依赖性,呈极显著正相关(P<0.01)。同时,以作用时间达到48 h 为例,菱角壳黄酮粗提物、菱角壳黄酮纯化物、5-Fu 的IC50值分别为:271.46、268.16、152.09 μg/mL。菱角壳黄酮纯化物IC50值低于菱角壳黄酮粗提物,同时,菱角壳黄酮粗提物、纯化物的IC50值均高于5-Fu。进一步验证说明在实验范围内,菱角壳黄酮纯化物对Hela 细胞的增殖抑制作用高于菱角壳粗提物,菱角壳提取物对Hela 细胞的抑制作用均弱于阳性对照5-Fu。且,不同药物对Hela 细胞IC50值得影响差异显著(P<0.05)。

表5 不同药物对Hela 细胞增殖抑制作用的IC50 值Table 5 Inhibitory effect of purified water chestnut shell flavonoids on the growth of Hela cells
3 结论
以菱角壳黄酮粗提物中的总黄酮提取得率为评价指标,优化所得最佳工艺参数为:提取时间28 min、料液比1:33 g/mL、乙醇浓度53%。在该条件下,菱角壳黄酮的提取率为3.455%±0.16%。其中,提取温度对最终得率的影响不显著(P>0.05),提取时间、料液比、乙醇浓度对于最终结果的影响均极显著(P<0.01)。两两交互,仅提取时间与料液比的交互作用对最终菱角壳黄酮粗提物中的总黄酮提取得率影响极显著(P<0.01)。通过此工艺提取所得菱角壳黄酮粗提物,以及经过进一步分离纯化的菱角壳黄酮纯化物均能够有效抑制Hela 细胞的增殖,说明菱角壳黄酮提取物具有一定的抗肿瘤活性。结合抑制率的变化趋势可知,菱角壳黄酮提取物抑制Hela 细胞活性对浓度和作用时间有依赖性。在一定范围内,其抑制作用与提取物浓度和作用时间均呈正相关。菱角壳作为菱角生产企业的下脚料,每年产量颇多,直接丢弃会造成了较大的资源浪费。本研究可以对菱角壳以及其它类似的农副产品资源开发利用提供参考。
