红阳猕猴桃褐斑病病原菌鉴定与室内药剂筛选
2022-08-03苏文文任春光潘丽珊韩振诚王加国李良良李苇洁
苏文文,任春光,潘丽珊,吴 迪,韩振诚,王加国,李良良,李苇洁
(1 贵州省山地资源研究所,贵阳,550001;2 贵州大学林学院,贵阳,550025)
猕猴桃为猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)的藤本植物,其果实营养丰富,富含维生素和多种矿质元素及氨基酸,被誉为“水果之王”,是我国多地精准扶贫的特色优势树种[1-2]。作为精品产业之一,猕猴桃已经成为贵州省农业经济发展的支柱产业。近年来,随着猕猴桃种植产业不断发展,猕猴桃的病害问题也愈发严重。现已报道的猕猴桃病害主要有猕猴桃花腐病、猕猴桃溃疡病、猕猴桃褐斑病、猕猴桃软腐病和猕猴桃根结线虫病等[3-7]。这些病害分别发生在猕猴桃的花蕾、枝干、叶片、果实和根部,对猕猴桃树体造成不同程度的危害。
猕猴桃褐斑病是猕猴桃叶片上的一类重要病害,病叶率达60%~100%,不仅能够引起果园大面积落叶,甚至造成果树返花返青,产量损失高达30%~50%,给农业经济造成极大威胁[8]。该病在我国陕西、四川、贵州等猕猴桃种植区都有发生,但没有大面积暴发的记录。猕猴桃褐斑病病原菌多样,目前已报道的能够引起猕猴桃褐斑病的病原菌主要有链格孢Alternariaalternata、小球腔菌Mycosphaerellasp.、拟茎点霉菌Phomopsiscauloides、细极链格孢Alternariatenuissima等[9-12]。但不同区域、不同品种上病原菌种类的报道存在明显差异,随着病原菌的致病性分化以及环境等因素的影响,猕猴桃褐斑病病原菌的种类可能不断增加,目前也尚未报道有效的田间防控措施。鉴于此,本试验采用组织分离法分离红阳猕猴桃褐斑病叶片,通过形态学观察和病原菌rDNA内部转录间隔区ITS 序列对红阳猕猴桃褐斑病进行病原菌鉴定,同时对田间防治常用的6种试验药剂进行室内毒力测定,明确贵州省六盘水市水城区红阳猕猴桃褐斑病病原菌种类,筛选出能够有效抑制病原菌菌丝生长的药剂,以期为红阳猕猴桃褐斑病的防治提供理论依据。
1 材料与方法
1.1 材料
供试红阳猕猴桃病害样本和健康叶片采自贵州省六盘水市水城区猕猴桃产学研基地,在室内进行组织分离培养。
供试药剂:0.3%苦参碱水剂,广东真格生物科技有限公司生产;40%戊唑醇悬浮剂,深圳诺普信农化股份有限公司生产;30%吡唑醚菌酯乳油,深圳诺普信农化股份有限公司生产;80%乙蒜素乳油,海南正业中农高科股份有限公司生产;80%代森锰锌可湿性粉剂,深圳诺普信农化股份有限公司生产;70%甲基托布津可湿性粉剂,深圳诺普信农化股份有限公司生产;80%多菌灵可湿性粉剂,上海悦联生物科技有限公司生产。
1.2 方法
1.2.1 病原菌分离与纯化 采集红阳猕猴桃发病叶片,选择病健交接处组织,用流水冲洗干净,放入70%无水乙醇中消毒1 min,用无菌水反复冲洗3次,将其放置于灭菌滤纸上,待水分挥发干后放入PDA培养基。将培养基放入25 ℃光照培养箱进行培养,3 d后选取PDA培养基边缘新生长的菌丝进行纯化培养,得到单个病原菌。
1.2.2 病原菌形态学鉴定 菌落形态:用打饼器选取6 mm菌饼,放入新鲜PDA培养基上,放入25 ℃培养箱。7 d后观察菌落的形态特征,包括菌丝形态,菌落颜色,量取菌落直径,并记录。
显微形态:以无菌水为浮载剂,挑取新鲜菌丝于载玻片上,在显微镜下观察菌丝及分生孢子,依据真菌分类系统,初步确定病原菌种类[13]。
1.2.3 病原菌分子生物学鉴定 依据真菌基因组DNA提取试剂盒提取菌丝DNA,选用通用引物ITS1(5’-TCCGTAGGTGAACCTGC-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)对其rDNA-ITS 区域进行扩增,将扩增好的PCR产物进行1%琼脂糖凝胶电泳,检测扩增片段。然后将其送至生工生物工程(上海)股份有限公司进行测序。测序结果通过BLAST 进行同源序列比较,明确病原菌的种类。聚合酶链式反应(Polymerase chain reaction,PCR)的体系为25 μL,其中DNA 2μL,上游引物1 μL,下游引物1 μL,2×Taq PCR Master Mix 12.5 uL,ddH2O 8.5 μL。反应程序:94 ℃预变性2 min,94 ℃变性1 min,58 ℃退火30 s,35 个循环;72 ℃延伸1 min,72 ℃终延伸10 min,4 ℃保存。将测序所得序列上传到NCBI网站的GeneBank数据库中进行比较,下载同源性高的参考序列,使用MEGA 7.0.14软件的最大似然法(MI)进行系统发育分析及进化树的构建,确定病原菌的分类地位。
1.2.4 病原菌致病性检测 选取健康的红阳猕猴桃叶片,用无菌水反复冲洗干净,放置于灭菌滤纸上晾干。用脱脂棉包裹叶柄处后放于有无菌滤纸的托盘中,将叶柄处的脱脂棉用无菌水浸湿。在叶片的两侧用无菌接种针制造伤口,进行有伤接种。每个叶片右侧接菌丝块进行处理(菌落正面贴于伤口上),左侧接无菌的PDA作为对照。将接种好的叶片置于光照培养箱中,定期进行观察,7 d后进行病斑记录。待发病后采集病斑组织进行分离鉴定。
1.2.5 室内毒力测定 采用菌丝生长法进行药剂毒力测定,所有药剂按照最适喷施浓度进行浓度梯度稀释,制成含有不同浓度药剂的含药培养基,每种药剂设置5个梯度,每个梯度做3次重复。用直径为6 mm的打饼器打取菌饼放置于含药平板上,以接种无菌PDA作为对照。将接种好的培养基放入25 ℃培养箱中进行培养。培养7 d后,采用十字交叉法量取菌落直径,计算各药剂对病原菌菌丝的抑制作用。抑菌率(%)=(对照菌落平均直径-处理菌落平均直径)/对照菌落平均直径×100。采用Excel软件对试验结果进行统计分析,求出各药剂抑制中浓度(EC50)、毒力回归方程和相关系数(r)[14]。
2 结果与分析
2.1 猕猴桃褐斑病发病症状
猕猴桃褐斑病主要危害猕猴桃叶片,发病初期,在叶片上出现黄绿色斑点,随后病斑慢慢扩散至3 mm,发病部位中间为灰褐色,外缘为黄褐色。发病后期,病斑会扩展为圆形或不规则形病斑且病斑中间呈轮纹状,严重时病斑连接成片,导致叶片大面积脱落,影响树体营养吸收和生长(见图1)。

图1 猕猴桃褐斑病田间发病症状
2.2 病原菌分离及形态学观察
将分离、纯化后的猕猴桃褐斑病菌株置于PDA培养基上,25 ℃条件下培养7 d后,病原菌菌丝由白色变为灰褐色绒状,菌丝浓密,边缘整齐,菌丝中间凸起。显微镜观察分生孢子梗和菌丝联结,由菌丝演变而来,分生孢子平滑,倒棍棒形,顶部圆滑,具有2个假隔膜(见图2)。依据病原菌形态特征初步判断该病原菌为多主棒孢菌Corynesporacassiicola。
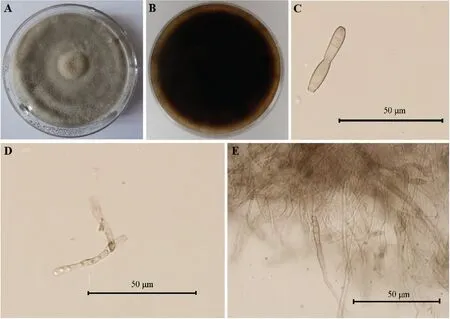
A:菌落正面、背面;B:病原菌PDA培养基上菌落背面;C:分生孢子;D、E:分生孢子梗和菌丝
2.3 病原菌的rDNA-ITS序列分析
将分离得到的病原菌菌株DNA进行PCR扩增,得到535 bp片段,将扩增后测序结果提交到GenBank中,获得登录号MZ191792。将所得序列进行BLAST 在线比对,并构建系统发育进化树。BLAST在线比对结果表明,病原菌的ITS序列与棒孢菌的多个菌株(MN393243,KF928288,MN871621,KF928286等)的同源性达到96%以上。基于病原菌ITS序列的聚类结果表明(见图3),红阳猕猴桃褐斑病病原菌的ITS序列与棒孢菌的多个菌株处于同一分支,表明病原菌与棒孢菌亲缘关系最近。结合形态学鉴定结果,鉴定出此次分离得到的红阳猕猴桃褐斑病病原菌主要为多主棒孢菌Corynesporacassiicola。

图3 基于ITS-rDNA基因序列的病原菌系统发育分析
2.4 病原菌的致病性检测
叶片离体接种结果显示,无伤接种7 d后,接种菌丝块和PDA培养基的叶片均未发病,有伤接种7 d后,红阳猕猴桃叶片左侧接种PDA培养基块部位没有出现病斑,叶片右侧接种病原菌菌丝块部位出现黑色病斑(见图4)。对接种后发病的叶片组织再次分离,病原菌形态特征与前期分离的形态特征一致。

图4 红阳猕猴桃叶片褐斑病病原菌致病性检测
2.5 室内毒力测定
通过室内毒力测定结果可以看出,6种药剂对红阳猕猴桃褐斑病病原菌均有一定的毒力,不同的药剂之间抑菌效果有一定的差异。其中50%多菌灵可湿性粉剂防治效果最好,最低浓度即可抑制病原菌菌丝生长;其次为40%戊唑醇悬浮剂抑菌效果最好,EC50为0.000 2 mg/L;80%乙蒜素乳油、30%吡唑醚菌酯乳油和80%代森锰锌可湿性粉剂的抑菌效果较好,EC50分别为0.074 3、0.087 1和3.571 1 mg/L;0.3%苦参碱水剂相对于其他几种药剂,抑菌效果一般,EC50为0.502 5 mg/L(见表1)。
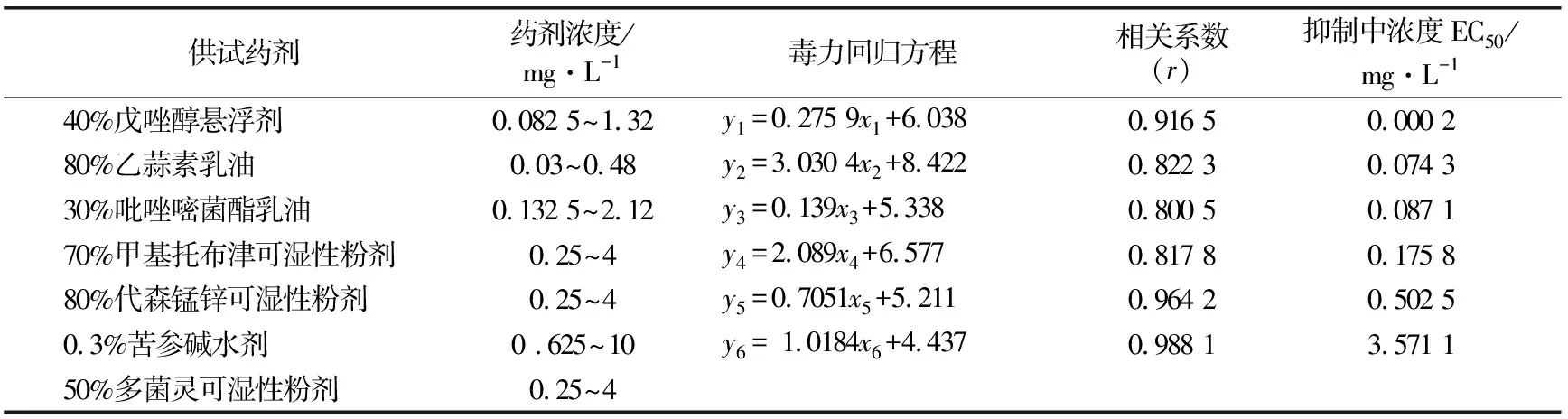
表1 6种药剂对红阳猕猴桃褐斑病病原菌的毒力测定
3 讨论
红阳猕猴桃褐斑病在贵州红阳猕猴桃园区迅速蔓延,严重威胁猕猴桃产量、品质及经济效益。本研究针对贵州省六盘水市水城区红阳猕猴桃褐斑病标样进行分离纯化、形态学鉴定、分子生物学检测以及致病性测定,结果发现,导致红阳猕猴桃褐斑病发生的病原菌为多主棒孢菌Corynesporacassiicola。这与之前对四川省猕猴桃褐斑病病原菌的报道结果相符[15]。
多主棒孢菌侵染力强,寄主范围广,不仅可以侵染猕猴桃,还对豆科、茄科以及葫芦科等多种植物造成危害[16]。至今已经有很多报道表明,多主棒孢菌在不同国家和地区的橡胶、番茄、黄瓜、大豆、棉花等植物上危害严重,逐步成为该种植物的主要病害[17-20]。
20世纪90年代,在我国辽宁省黄瓜褐斑病上首次分离到多主棒孢菌,该病原菌侵染黄瓜,造成了黄瓜大面积减产[21]。随着黄瓜褐斑病发病率直线上升,病原菌对其他植物的侵染也越加严重。2005年以来,我国的黄瓜、茄子、番茄、豇豆等蔬菜和经济作物因多主棒孢菌侵染,经济损失过亿,其主要发生地在云南、海南、山东、辽宁、吉林等地[22]。然而关于多主棒孢菌在红阳猕猴桃上的侵染以及致病力分化情况尚未有报道,因此,随着该病原菌的发展以及在寄主植物上发病率的逐渐提高,给红阳猕猴桃产业带来潜在风险。
此前针对红阳猕猴桃褐斑病,已有研究已经分离鉴定该病主要由细极链格孢Alternariatenuissima侵染引起,同时针对该病原菌进行了室内药剂筛选和毒力测定,但是田间发病依然较为严重,推测红阳猕猴桃褐斑病是由多主棒孢菌和细极链格孢菌混合侵染引起。到目前为止,仅有崔永亮研究报道多主棒孢菌Corynesporacassiicola危害红阳猕猴桃,但其研究未提出防控方案[8]。关于红阳猕猴桃褐斑病病原菌种类及优势病原菌的研究都将需要长期深入研究。
徐丽慧等[23]报道,对黄瓜靶斑病致病菌多主棒孢菌抑制效果较好的为430 g/L戊唑醇悬浮剂、45%咪鲜胺乳油;番华彩等[24]报道,造成香蕉叶斑病的棒孢霉菌对丙环唑、多抗霉素和苯甲·丙环唑等药剂敏感。本研究选择田间常用的药剂进行室内毒力测定,结果表明,对多主棒孢菌抑制效果较好的是50%多菌灵可湿性粉剂、40%戊唑醇悬浮剂,其次为80%乙蒜素乳油、30%吡唑嘧菌酯乳油和80%代森锰锌。这些药剂对于田间防治红阳猕猴桃褐斑病都具有一定的理论价值,但本研究仅测定了药剂对病原菌的室内毒性,关于田间的试验效果还需要结合环境、成本、对果实生长的影响以及农药残留等因素进行进一步研究。
4 结论
本研究通过对贵州省六盘水市水城区红阳猕猴桃褐斑病标样进行分离纯化、形态学鉴定、分子生物学检测以及致病性测定,表明引起红阳猕猴桃褐斑病病原菌为多主棒孢菌Corynesporacassiicola。室内药剂筛选结果表明,对多主棒孢菌抑制效果较好的是50%多菌灵可湿性粉剂、40%戊唑醇悬浮剂,其次为80%乙蒜素乳油、30%吡唑嘧菌酯乳油和80%代森锰锌。
