耐盐异养硝化-好氧反硝化菌的筛选及特性研究
2022-08-03孙玲玉颜家保鲍彦舟
孙玲玉,颜家保,胡 杰,鲍彦舟
(武汉科技大学 化学与化工学院 煤转化与新型炭材料湖北省重点实验室,湖北 武汉 430081)
氮含量超标将导致水体富营养化,并影响人体健康。传统生物脱氮是利用微生物的硝化反硝化原理,将废水中的NH首先在好氧条件下通过亚硝酸菌的作用氧化为NO,之后通过硝酸菌进一步氧化为NO,硝态氮在厌氧环境条件下通过反硝化菌还原为N。传统生物脱氮理论认为,生物脱氮要经历硝化(好氧)和反硝化(厌氧或缺氧)两个阶段,这两个阶段分别在不同的反应器中完成。基于此,开发了缺氧—好氧(A/O)、厌氧—缺氧—好氧(A-A/O)、缺氧—好氧—好氧(A/O-O)等工艺。
自ROBERTSON等首次从废水脱硫和反硝化系统中分离出具有好氧反硝化能力的异养硝化菌泛营养硫球菌(Thiosphaera pantotroph)以来,越来越多的研究发现,自然界中还存在许多异养硝化-好氧反硝化菌。这些新菌种为异养菌,同时具备好氧硝化及反硝化功能。利用异养硝化-好氧反硝化菌可以在好氧环境中以有机物为碳源,脱除废水中的氨态氮和硝态氮并同时去除废水中的有机污染物。在同一反应器中同时脱除碳氮,大大节省了基建投资和运行成本。然而,目前分离得到的异养硝化-好氧反硝化菌主要来自淡水和盐含量较低的环境,对于石油化工、生物医药、食品加工等行业排放的部分高含盐污水,生物脱氮效率低,难以达到排放要求。
本研究从医药废水生物处理活性污泥中分离得到1株耐盐异养硝化-好氧反硝化菌Y1,并对其进行了种属鉴定和脱氮特性研究,为高含盐污水的生物脱氮提供了理论依据和技术参考。
1 实验部分
1.1 材料和仪器
菌源取自湖北咸宁惠生医药废水生物处理系统好氧段活性污泥。
LB培养基(g/L):NaCl 10.0,蛋白胨10.0,酵母提取物5.0,pH 7.2。
异养硝化培养基(g/L):NaHPO·12HO 7.900,KHPO1.500,MgSO·7HO 0.100,(NH)SO0.943,CHNaO·6HO 18.000,FeSO·7HO 0.010,NaCl 50.000,微量元素2 mL,pH 7.4。该培养基理论NH-N质量浓度为200 mg/L。
好氧反硝化培养基(g/L):以1.443 g/L KNO代替0.943 g/L (NH)SO,其余同异养硝化培养基。该培养基理论NO-N质量浓度为200 mg/L。
微量元素溶液配方见文献。
蛋白胨和酵母提取物购自英国OXOID公司;其余试剂均为分析纯。
QYC-211型恒温摇床:上海福马公司;1-14型离心机:德国SIGMA公司;UV2000型紫外-可见分光光度计:美国UNICO公司;HVE-50 型高压蒸汽灭菌锅:日本 HIRAYAMA公司;ABI3730XL型测序仪:美国赛默飞公司。
1.2 实验方法
1.2.1 菌株分离
取活性污泥样品于LB培养基中先进行活化和富集,将富集后的菌液分别接种到异养硝化和好氧反硝化培养基中进行硝化、反硝化及耐盐性能驯化。
用稀释涂布平板法对驯化后的菌株进行分离纯化,并分别在异养硝化和好氧反硝化培养基中培养2 d,比较各菌株脱氮性能,选取硝化和反硝化综合性能优异的菌株作为目标菌株,加入甘油保存。
1.2.2 菌种鉴定
依据《常见细菌系统鉴定手册》,对于分离得到的目标菌株进行形态特征和理化特性鉴定。菌株基因组DNA的提取选用DNA试剂盒,采用16S rDNA特异引物进行PCR扩增,扩增产物委托武汉擎科生物技术有限公司进行16S rDNA测序。将测序结果上传美国国家生物信息中心(NCBI)官网进行比对分析,确定细菌种属。
1.2.3 菌株脱氮能力的影响因素
将菌株分别接种在异养硝化培养基和好氧反硝化培养基中,研究菌株在不同的盐度(以NaCl质量分数计,盐度最高值和最低值分别为菌株耐盐能力的上限和下限)、碳源、m(C)∶m(N)、初始pH、培养温度和摇床转速下的脱氮能力。定期取样测定培养基中的NH-N或NO-N质量浓度。
1.2.4 菌株在适宜条件下的脱氮性能
确定菌株适宜脱氮条件后,分别取菌液3 mL接种到异养硝化和好氧反硝化培养基,在适宜条件下培养48 h,定时取样,测定培养液中的菌株生长量(以OD表征)及各形态氮的质量浓度。
1.3 分析方法
菌株生长量的测定采用光密度法;NH-N质量浓度的测定采用纳氏试剂分光光度法; NO-N质量浓度的测定采用酚二磺酸紫外分光光度法;NO-N质量浓度的测定采用N-(1-萘基)-乙二胺分光光度法;TN的测定采用过硫酸钾氧化紫外分光光度法。
2 结果与讨论
2.1 菌株的筛选与鉴定
经过驯化分离,得到7株耐盐异养硝化-好氧反硝化菌株,将其编号为Y1~Y7,再分别对菌株Y1~Y7进行脱氮性能测试,各菌株的NH-N和NO-N去除率见图1。由图1可知,除Y2外,其他6株菌的NH-N和NO-N去除率均高于70%,其中菌株Y1的NH-N和NO-N去除率分别达到89.08%和87.27%,脱氮效率最高,因而选择菌株Y1为目标菌株。

图1 各菌株的NH4+-N和NO3--N去除率■ NH4+-N;■ NO3--N
图2为菌株Y1的菌落形态和革兰氏染色显微照片。由图2a可知,菌株Y1的菌落形态呈圆形且边沿整齐,颜色为不透明的米黄色,表面光滑。由图2b可知,菌株Y1呈紫色短杆状,为革兰氏阳性菌。生理生化试验结果表明:接触酶、硝酸盐还原及亚硝酸盐还原试验呈阳性;乙醇发酵、甲基红、淀粉水解、硫化氢及明胶液化试验呈阴性。

图2 菌株Y1的菌落形态(a)和革兰氏染色(b)的显微照片
对Y1进行16S rDNA测序,经NCBI比对分析,选取与菌株Y1同源性较高的部分菌株进行比较(见表1),发现其均为海杆菌属(Marinobacter sp.)。结合菌株Y1的形态学特征、生理生化试验结果,可以将其归类为海杆菌属(Marinobacter sp.)。菌株Y1的NCBI DNA序列数据库(GenBank)登录号为MZ831214。
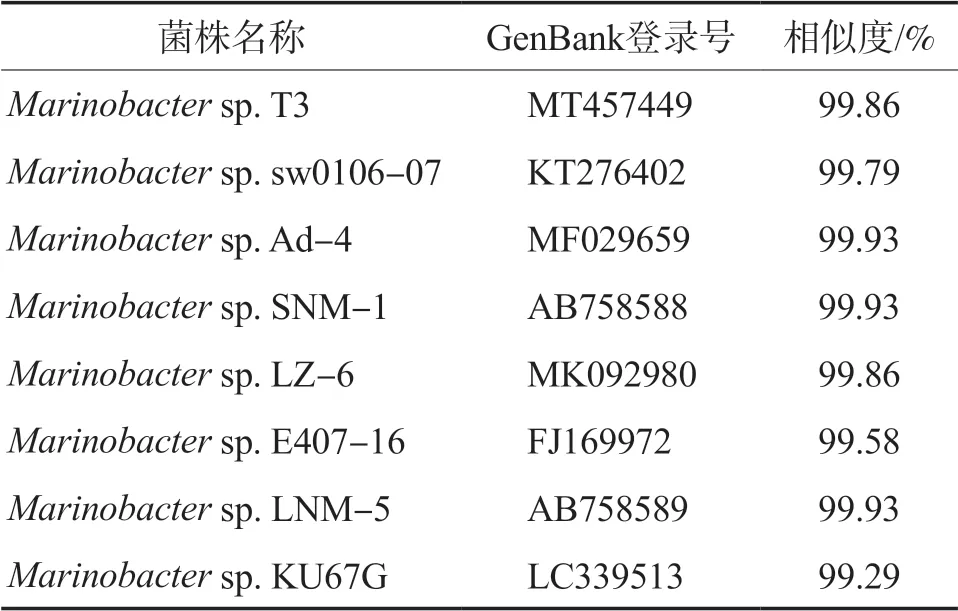
表1 菌株Y1的16S rDNA序列比对结果
2.2 菌株脱氮的影响因素
2.2.1 盐度
在培养温度为30 ℃、分别以丁二酸钠和葡萄糖为碳源、m(C)∶m(N)=16、初始pH为9、摇床转速为150 r/min的条件下,考察不同盐度对菌株Y1去除NH-N和NO-N的影响,结果见图3。由图3可知:在36 h时,菌株Y1在3%~7% 盐度下的NH-N、NO-N去除率均超过95%,而在9%和11%盐度下的NH-N和NO-N去除率仅为20%~50%;随着处理时间的延长,菌株Y1逐渐适应了高盐环境,9%和11%盐度下虽呈现不同程度的抑制,但最终的NH-N和NO-N去除率均超过99%;当盐度继续提高到13%时,菌株Y1无法再分解NH-N和NO-N;菌株Y1在5%盐度下脱氮速率最快,30 h时的NH-N和NO-N去除率分别为99.21%和99.99%。以上结果表明菌株Y1在3%~11%盐度范围内均可生长并进行脱氮,最高耐受盐度可达11%,适宜盐度为5%。
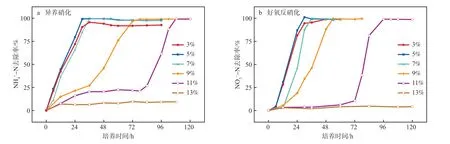
图3 盐度对NH4+-N(a)和NO3--N(b)去除率的影响
2.2.2 碳源
碳源能为菌株的生长提供能量并为脱氮过程提供电子,但不同碳源对菌株脱氮的影响存在差异[10]。在盐度为5%、m(C)∶m(N)=16、培养温度为30 ℃、初始pH为9、摇床转速为150 r/min的条件下,不同碳源对NH-N和NO-N去除率的影响见图4。由图4a可知:在异养硝化过程中,菌株Y1以丁二酸钠和柠檬酸三钠为碳源时,NH-N在6~36 h内快速分解,36 h 后的NH-N去除率均超过99%;当碳源为蔗糖和葡萄糖时,NH-N的去除率相对较低(<75%)。由图4b可知:好氧反硝化过程中,以葡萄糖、柠檬酸三钠为碳源时,30 h 时的NO-N去除率分别为99.14%和92.78%;而以丁二酸钠、蔗糖为碳源时,NO-N的去除率相对较低。以上结果表明异养硝化过程中丁二酸钠为碳源时的脱氮效果最好,好氧反硝化过程以葡萄糖为碳源时的脱氮效果最好。
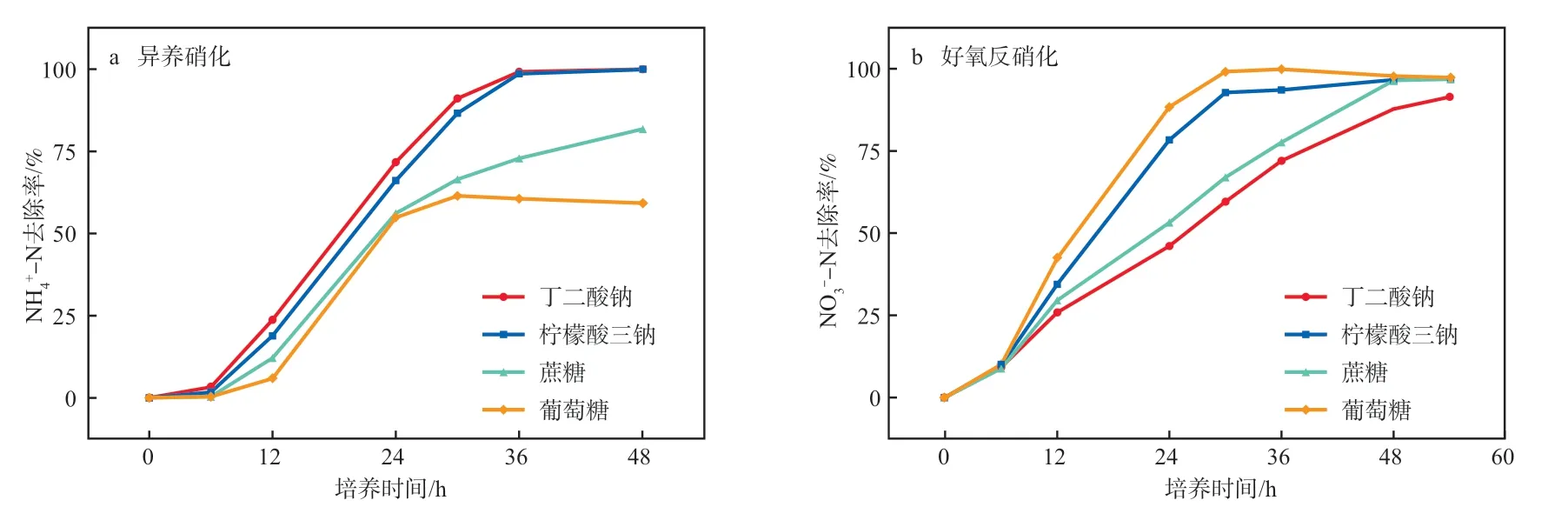
图4 碳源对NH4+-N(a)和NO3--N(b)去除率的影响
2.2.3 m(C)∶m(N)
在盐度为5%、分别以丁二酸钠和葡萄糖为碳源、培养温度为30 ℃、初始pH为9、摇床转速 为150 r/min的条件下,考察m(C)∶m(N)对NH-N和NO-N去除率的影响,结果见图5。由图5可见:当m(C)∶m(N)分别为4和8时,NH-N去除率分别为46.89%和82.17%,NO-N去除率分别为27.68%和64.32%,这是由于碳源含量较低时菌株Y1不能充分生长,脱氮效率低;当m(C)∶m(N)提高至12时,菌株Y1在36 h时的NH-N去除率高达99.79%,但NO-N的去除仍受到部分抑制,这是由于反硝化过程利用有机碳源作为电子供体,需要更高的m(C)∶m(N);当m(C)∶m(N)达到16时,NH-N、NO-N的去除率均超过99%。当m(C)∶m(N)进一步提高至20时,过高的m(C)∶m(N)使得菌株Y1生长代谢不平衡,NH-N、NO-N的去除率不再提高。结合菌株Y1的硝化、反硝化脱氮效果,选择适宜的m(C)∶m(N)为16。
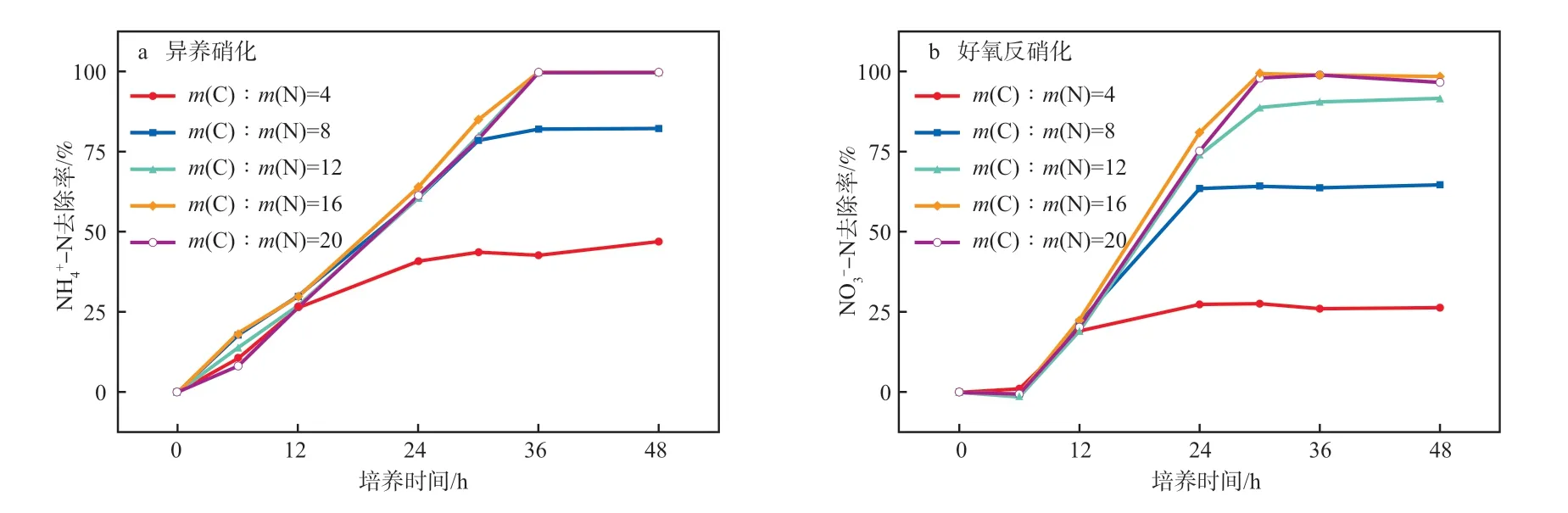
图5 m(C)∶m(N)对NH4+-N(a)和NO3--N(b)去除率的影响
2.2.4 初始pH
pH能通过影响细胞膜的通透性和酶的活性等来影响微生物的生长和代谢。在盐度为5%、分别以丁二酸钠和葡萄糖为碳源、 m(C)∶m(N)=16、培养温度为30 ℃、摇床转速为150 r/min的条件下,初始pH对NH-N和NO-N去除率的影响见图6。由图6可知,当初始pH为8~10时,菌株Y1在异养硝化36 h时的NH-N去除率超过99%,反硝化过程在24 h 时的NO-N去除率也达99%以上,表明弱碱性环境更有利于菌株Y1的生长和脱氮。当初始pH为7时,菌株Y1的NH-N、NO-N的去除率降低,去除速率均有所变慢。当pH=6时,Y1培养24 h的NH-N去除率仅为28.80%,去除速率明显减慢,反硝化过程受到严重抑制。表明菌株Y1的适宜初始pH为8~10。
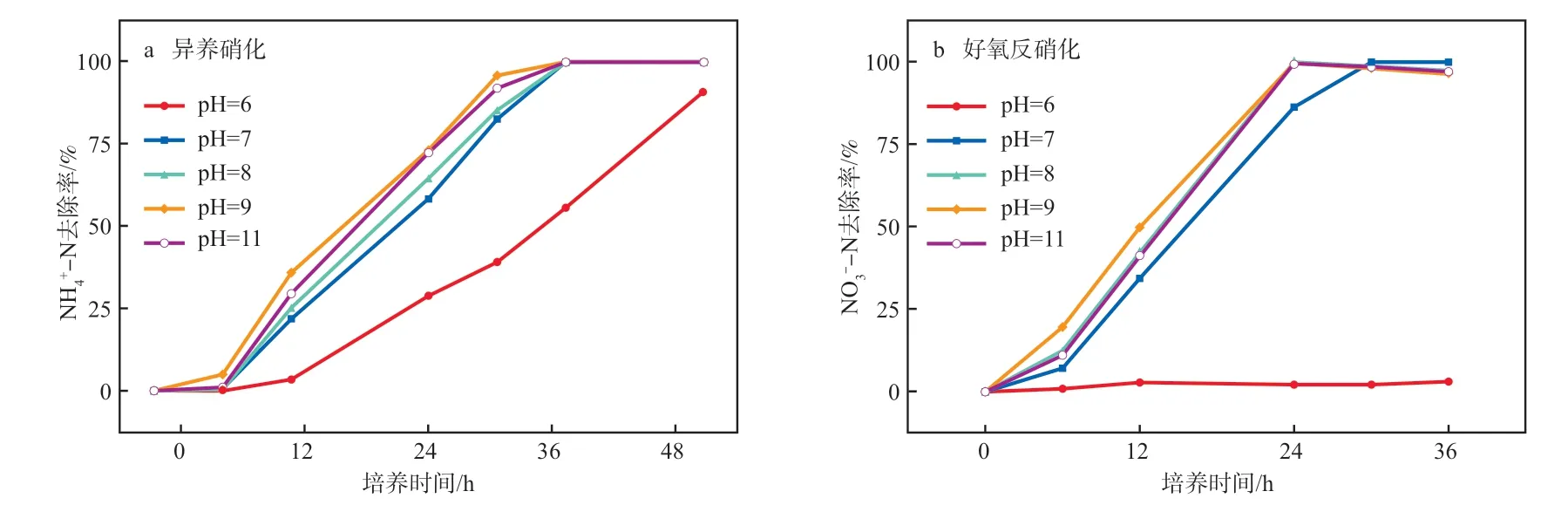
图6 初始pH对NH4+-N(a)和NO3--N(b)去除率的影响
2.2.5 培养温度
在盐度为5%、分别以丁二酸钠和葡萄糖为碳源、m(C)∶m(N)=16、初始pH为9、摇床转速 为150 r/min的条件下,考察培养温度对NH-N和NO-N去除率的影响,结果见图7。由图7可知:异养硝化过程中,当培养温度为20~40 ℃时,菌株Y1在培养48 h后的NH-N去除率超过99%;好氧反硝化时,随着温度的升高,NO-N去除率呈现先升高后降低趋势,且当温度为25 ℃和30 ℃时NO-N的去除率皆达到97%以上,原因是温度过高或过低时均会影响菌株的生长代谢。相较于异养硝化过程,反硝化过程对温度的变化更为敏感,这可能是由于反硝化过程中相关酶对温度要求更为严苛。菌株Y1在30 ℃时NH-N和NO-N的去除率最高。

图7 培养温度对NH4+-N(a)和NO3--N(b)去除率的影响
2.2.6 摇床转速
摇床转速是影响培养基中溶解氧浓度的主要因素,提高摇床转速可增大溶解氧浓度。在盐度为5%、分别以丁二酸钠和葡萄糖为碳源、m(C)∶m(N)=16、初始pH为9、培养温度为30 ℃的条件下,考察摇床转速对NH-N和NO-N去除率的影响,结果见图8。由图8可知:在50~250 r/min转速下,NH-N和NO-N去除率随着摇床转速的提高而加快。当摇床转速为50 r/min时,NH-N和NO-N的去除率均不超过30%,低转速下培养基中溶解氧浓度低,菌株Y1生长速率受到抑制、脱氮效率低;当摇床转速增至150~250 r/min,菌株Y1的NH-N、NO-N去除率均超过99%;摇床转速为250 r/min时,NH-N和NO-N的去除效果与200 r/min几近相同。因此适宜的摇床转速为150~200 r/min。
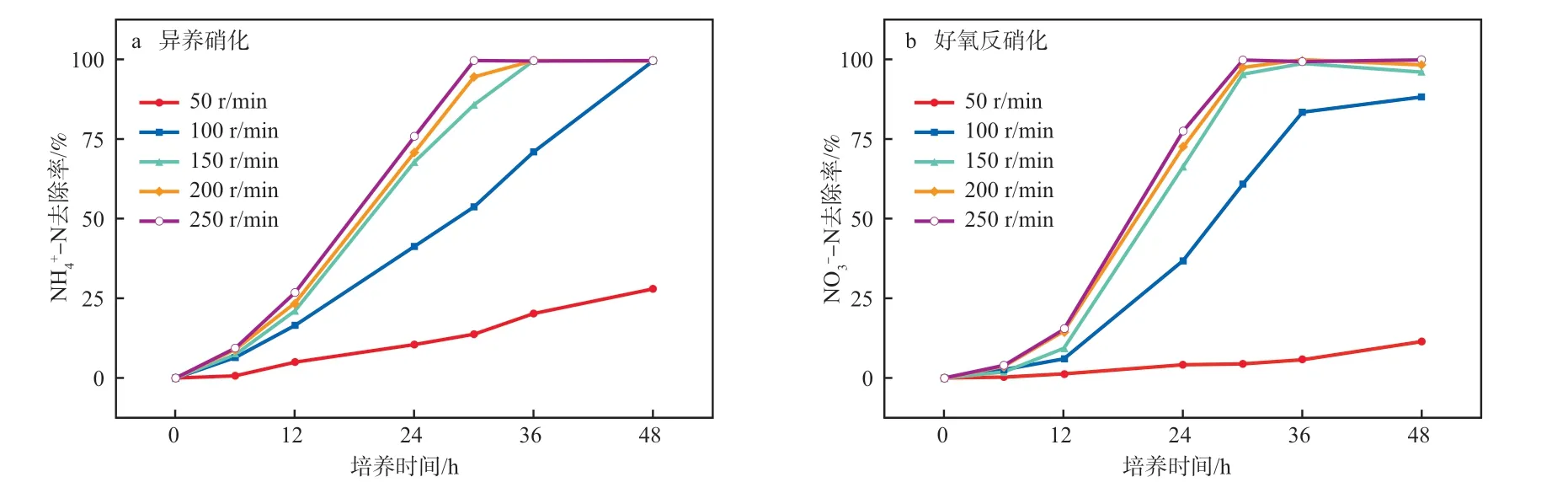
图8 摇床转速对NH4+-N(a)和NO3--N(b)去除率的影响
2.3 菌株的脱氮特性
2.3.1 异养硝化特性
将菌株Y1在上述优化条件下以异养硝化培养基培养48 h,培养液的OD及各形态N的质量浓度见图9。由图9可知:在0~6 h,菌株Y1生长缓慢,NH-N和TN只有少量被降解;6 h后菌株Y1的生长量开始呈对数增长,同时NH-N和TN的浓度快速降低,至24 h时ρ(NH-N)和ρ(TN)分别为1.21 mg/L和23.21 mg/L,去除率分别达到99.31%和88.14%;整个异养硝化过程几乎没有NO-N的积累;NO-N于24 h出现最大积累量(16.23 mg/L),随后被立即去除。这可能是由于硝酸盐还原酶活性较低,致使硝化过程中NO-N的积累大于反硝化时NO-N的消耗,而亚硝酸盐氧化酶活性较强,在硝化过程中NO-N快速转化为NO-N。TN的减少说明氨态氮最终被转化为氮气或氮氧化物,菌株Y1在进行异养硝化反应的同时也进行了反硝化反应,表现出同步硝化反硝化优势。

图9 优化条件下菌株Y1异养硝化培养液的OD600及各形态N的质量浓度
2.3.2 好氧反硝化特性
将菌株Y1在上述优化条件下以好氧反硝化培养基(初始NO-N质量浓度为189.38 mg/L)培养48 h,培养液的OD及各形态N的质量浓度见图10。由图10可见:菌株Y1培养6 h后进入对数生长期;6~12 h时NO-N和TN的质量浓度快速减少,分别从184.67 mg/L和201.25 mg/L降至42.36 mg/L和66.50 mg/L,平均降解速率分别达到23.72 mg/(L·h)和22.46 mg/(L·h);NO-N的快速降解导致NO-N转化不及时并于12 h出现少量积累(2.91 mg/L),但随后被立即去除;菌株Y1经24 h到达生长稳定期,此时NO-N和TN的质量浓度分别为10.67 mg/L和23.25 mg/L,去除率分别达到94.37%和89.36%,表明菌株Y1对NO-N和TN有良好的反硝化去除能力;继续培养至36 h,菌株Y1因培养基营养不足进入衰亡期,几乎不再进行脱氮。
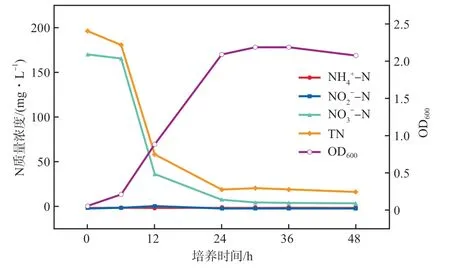
图10 优化条件下菌株Y1好氧反硝化培养液的OD600及各形态N的质量浓度
3 结论
a)从医药废水生物处理好氧段活性污泥中分离得到1株耐盐异养硝化-好氧反硝化菌株Y1,鉴定为海杆菌(Marinobacter sp.)。
b)菌株Y1适宜的脱氮条件为:盐度5%,异养硝化以丁二酸钠为碳源,好氧反硝化以葡萄糖为碳源,m(C)∶m(N)=16,初始pH=8~10,培养温度30 ℃,摇床转速150~200 r/min。
c)适宜条件下,异养硝化过程中NH-N和TN的去除趋势相同,24 h去除率分别为99.31%和88.14%;好氧反硝化过程中NO-N和TN的去除基本同步,24 h去除率分别为94.37%和89.36%。硝化和反硝化过程中分别出现了少量的NO-N和NO-N的积累,随后被立即去除,表明菌株Y1在高盐度环境下仍具有良好的同步硝化反硝化脱氮潜能。
