应用全外显子组测序发现1例肺型BHD综合征家系FLCN基因c.1579_1580insA位点变异
2022-08-02叶小凯王琳
叶小凯 王琳
肺囊肿的发病机制尚未完全明确,吸烟是其主要病因,然而临床上也发现很多非吸烟的患者,并且在这一些非吸烟的患者中有的具有家族簇集现象,通过对其家系调查,遗传图谱绘制,发现其存在孟德尔遗传现象。全外显子组测序是指利用序列捕获技术将全基因组外显子区域DNA捕捉并富集后,再进行高通量测序的基因组分析方法,外显子组序列仅占全基因组序列的1%左右,与人类85%致病基因突变相关,近年来其越来越多的被应用于人类遗传病研究中,应用全外显子组测序能够快速发现罕见遗传疾病的致病基因。本课题纳入临床工作发现1例非吸烟患者反复因肺囊肿出现自发性气胸的家系,为明确其肺囊肿伴反复气胸的病因,应用全外显子组测序探寻其家族性肺囊肿是否存在遗传致病因素。
1 资料与方法
1.1 一般资料
遴选出2018年8月—2021年8月我科临床上发现的具有家族聚集现象的肺囊肿家系,共纳入1例肺囊肿家系。先证者王**,女性,45岁,保险代理人,因“咳嗽、胸闷、气喘3 d”为主诉于2017年2月首次就诊我院。门诊行胸部CT:右侧气胸,双肺多发肺囊肿,门诊拟“自发性气胸、肺囊肿”收入院。既往身体健康,无慢性疾病史,无吸烟史。家族遗传史:其母亲有双肺多发肺囊肿,其妹妹有肺囊肿、反复多次自发性气胸病史,其2个儿子有肺囊肿。先证者2017年2月7日胸部CT:右侧气胸伴肺囊肿(图1),入院后行肾脏彩超:双肾无异常,无肿瘤占位情况。入院给予胸腔闭式引流术,患者治疗好转出院。出院后患者仍反复多次自发性气胸于当地治疗。结合先证者具有家族聚集性气胸、肺囊肿遗传特点,推断其家系存在遗传性疾病。本研究纳入先证者家系3代8人(分别为先证者、其父亲、其母亲、其妹妹、其弟弟、其丈夫、其2个儿子)作为研究对象,本研究经受试者的知情同意及厦门市海沧医院伦理委员伦理论证通过。
1.2 方法
遴选出临床上具有家族聚集现象的肺囊肿家系,对先证者家系进行遗传咨询,绘制遗传图谱。在签署知情同意书后,采集先证者标本及家系成员全血各2 mL(EDTA抗凝)送厦门基源医学检验实验室进行全外显子组测序,提取外周血白细胞全基因组DNA,进行DNA建库和捕获,并进行150 bp双末端测序,对检出变异进行生物信息分析,并运用Sanger测序对先证者家系成员进行突变位点的验证。
1.3 生物信息学分析
对检出的SNP和Indel变异,采用ANNOVAR软件进行注释,注释信息包括染色体起始和终止位置、参考等位基因、替代等位基因,以及包括基因功能、公共数据库人群频率(包括千人基因组,ExAC,GnomAD数据库等)、蛋白功能预测软件结果(包括SIFT,PROVEAN,MutationTaster,CADD等)、ClinVar数据库等信息。对变异进行筛选以及基因型-表型关联分析。最后,参考美国医学遗传学与基因组学学会(ACMG)遗传变异分类标准与指南对候选基因变异进行变异致病性评估与遗传解读。
2 结果
2.1 先证者家系分析
纳入先证者家系共3代8人,分别为先证者、先证者父亲、先证者母亲、先证者妹妹、先证者弟弟、先证者丈夫、先证者大儿子、小儿子,其中先证者反复3次发作自发性气胸伴肺囊肿见图1,经住院期间系统检查,先证者无肾囊肿、纤维毛囊瘤,皮肤角化、肾肿瘤、面部丘疹,不伴有慢性疾病情况。先证者母亲、妹妹、大、小儿子有肺囊肿,不伴有慢性疾病情况;先证者父亲、弟弟、丈夫没有肺大泡、肺气肿。其家系图谱分析符合常染色体显性遗传特征(图2)。
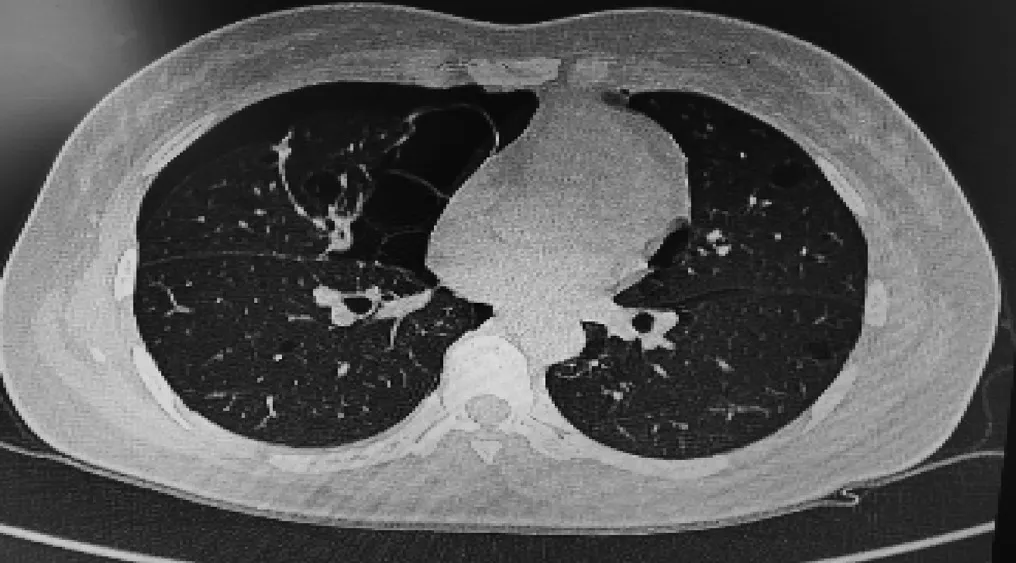
图1 先证者气胸伴肺囊肿

图2 先证者家系遗传图谱
2.2 全外显子组测序结果及生物信息分析
本全外显子组基因检测针对人类基因组的外显子组的全部区域,覆盖20 000多个基因,涵盖85%以上的人类遗传性疾病。检测范围包括基因编码区单核苷酸位点变异(single nucleotide varients)、小片段插入/缺失等突变类型。对先证者进行全外显子组测序,共获得了8 814 253 200测序读长,总的有效读长3 7401 954,目标的平均测序深度80.47,目标区域的覆盖率99.4%,先证者共检出77 994基因变异,包括同义突变、错义突变、剪接突变、移码插入、移码删除等(见表2)。经全外显子组测序分析,发现先证者FLCN基因第14号外显子上存在一处变异c.1579_1580insA:p.R527fs(NM_144997)(变异详细信息见表3),该变异为杂合移码突变,第1579至1580号碱基间插入碱基A,导致氨基酸由精氨酸变成谷氨酰胺,随后的第75个氨基酸变为终止密码子,形成截短蛋白,该移码突变发生在3’端,预计不会导致无义介导的mRNA衰变。检出变异在千人基因组、gnomAD公共人群数据库中未见收录,在ExAC、AF公共人群数据库中亚洲人群频率为0.000 1,突变导致蛋白丢失小于10%。根据根据美国医学遗传学与基因组学学会(american college of medical genetics and genomics,ACMG)指南,对PVS1进行降级至PVS1_Moderate。对变异进行筛选及基因型-表型关联分析,发现该基因变异,该基因关联表型为Birt-hogg-dube syndrome(Birt-hogg-dube 综合征)(OMIM:135150)。

表1 先证者家系临床特点

表2 先证者外显子测序结果

表3 先证者突变情况
2.3 Sanger测序
针对先证者检出的候选变异位点设计上下游引物,并进行聚合酶链式反应,采用Sanger法测序验证。引物设计:FLCN-F,5’-TGCGGAGCCCTAACTCAATC-3’;FLCN-R,5’-CCCATACCCATACCCGACAG-3’。分别对先证者、父母及其他家系成员进行Sanger测序验证,结果如图3所示。

图3 先证者及家系成员基因测序结果
2.4 变异位点致病性评级
结合全外显子组测序及Sanger测序结果,根据美国医学遗传学与基因组学学会(american college of medical genetics and genomics,ACMG)指南判定该变异为致病性的基因变异(致病性证据等级为PVS1_Moderate+PS4+PM2_Supporting+PP1_Strong)。
3 讨论
Birt-hogg-dube(BHD)综合征是一种以面部丘疹,肺囊肿,大疱病,自发性气胸,肾肿瘤、肾囊肿、结肠肿瘤为临床表现的罕见的常染色体显性遗传病,皮肤角化、纤维毛囊瘤为其特征改变,其由位于第17号染色体的FLCN基因突变引起[1]。典型的BHD综合征患者常伴有肺囊肿、面部丘疹、肾脏肿瘤等三联征表现,然而不同人群其临床表现仍有明显差异,中国人群大多仅有肺部表现,表现为肺型BHD综合征即仅有肺部气囊或伴有自发性气胸,较少伴有其他系统损害表现,对于这部分人群如果没有进行全外显子组或全基因组检测常常会导致疾病的误诊。

表4 ACMG致病性评级
现已发现FLCN基因突变位点超过200个,这些突变主要包含小片段的插入/缺失、剪接突变和无义突变,其中c.1285dup是白种人和亚洲人群中最常见的突变[2-3]。查阅维普、万方中文数据库,截止2021年12月31日暂未发现该基因变异位点(c.1579_1580insA)相关病例报道,本例为国内首例报道;查阅PubMed英文数据库,已有4个相关家系病例报道检出FLCN基因c.1579_1580insA变异,均来自中国家庭,已报道症状除了气胸,肺囊肿,还包括有皮肤病变,肾脏病变和肝脏病变,如淋巴结肿大,脂肪粒,皮疹,肾囊肿,肝囊肿[4-7]。不过与国外报道不同的是,文章研究家系中携带FLCN基因c.1579_1580insA变异的阳性病例均仅有肺部损害表现,其中包括65岁的先证者母亲。BHD综合征患者的预后相对良好,尽管肾癌是其最严重的并发症,但其在中国人群的发病率并不高,考虑到先证者检出变异有50%概率遗传给子代,我们后续将密切观察随访该家系成员其他症状表现,特别是针对肾脏肿瘤的随访观察。
FLCN基因突变如何导致BHD综合征相关病变其发病机制并不清楚,推断由于FLCN基因突变导致FLCN蛋白功能丧失从而影响上述生命活动功能进而出现相关疾病。FLCN蛋白参与了多种生命活动过程,包括信号转导、细胞黏附、溶酶体和线粒体的生物合成、纤毛形成、细胞能量代谢和营养稳态等。FLCN基因目前被认为是一种抑癌基因,携带FLCN变异基因的患者肾癌的患病率高[8-9]。现有研究表明FLCN基因可能通过参与雷帕霉素靶蛋白(mTOR)信号通路、TGFβ/BMP 信号通路、Rho A信号调控、PGC1α驱动的线粒体生物合成、TFE3/TFEB转录调控等多种细胞信号通路调控从而起到肿瘤抑制作用[10-15],而FLCN基因发生变异时通过上述信号通路产生的肿瘤抑制作用将大大减弱。FLCN基因突变所引起的肺部气囊病变,其病理改变是肺泡囊性扩张所形成的肺囊肿,当肺气囊发生破裂可形成自发性气胸,该致病机制目前尚不清楚。本研究家系先证者其肺部多发囊性病变伴反复自发性气胸表现为肺型BHD综合征,其FLCN基因第14号外显子上c.1579_1580insA:p.R527fs(NM_144997)移码插入,导致FLCN蛋白过早截短蛋白及功能丧失,考虑为其致病基础。FLCN蛋白在肺内巨噬细胞、纤维原细胞以及I型肺泡上皮细胞表达,相关研究表明当其基因发生突变时,通过巨噬细胞和纤维原细胞会分泌大量的炎性因子,诱发炎症,最终造成肺内弹性纤维的破坏而导致气胸[16],其病理表明因为炎症导致肺结构的改变引起气囊的形成及气胸的发生[16]。也有研究表明,FLCN基因突变导致FLCN单倍体不足,进而导致肺成纤维细胞功能障碍,影响肺组织修复能力[17]。处此之外也有研究表明,FLCN在中胚层间叶细胞中的缺失导致肺泡生长显著减少及破坏,导致气囊[18]。
外显子组序列仅占全基因组序列的1%左右,却包含了大约85%的已知致病基因变异。近年来随着全外显子组检测技术的发展,其越来越广泛的运用于人类遗传性疾病的研究。以往传统筛查遗传疾病主要通过连锁分析和关联分析,以家系为单位,多采用以假说为导向的候选基因法,选定一个或几个候选基因,在家系成员中对这些候选基因进行Sanger测序,根据基因表型与疾病表型确定候选基因与疾病质检关系。此方法不仅研究效率低,且需要样本多,对于罕见疾病或人数稀少的小家系不适用。全基因组测序可直接发现变异位点,但其费用昂贵,且检测到的变异位点多位于非功能区域。外显子组测序具有以下优势:可针对连锁分析不能检测的罕见疾病和小家系进行检测;可以将不同家系样本综合研究;仅对编码蛋白的功能区域进行测序,定位准确;研究周期短,大大加快研究进程,相比以上两种方法,外显子组测序是一种经济、简洁、快速的寻找致病基因的方法。
文章研究通过应用全外显子组测序技术,在纳入研究的具有遗传疾病特征的小样本家系的先证者中发现了FLCN基因c.1579_1580insA位点变异,在其他阳性家系成员中,采用Sanger测序验证同样检出该变异,故该变异在本次研究家系中呈现共分离特点,通过应用生物信息分析及致病性分析进而锁定该致病基因变异。尽管我们检出了c.1579_1580insA位点变异,但是该变异如何导致BHD综合征,其发病机制仍不清楚有待进一步研究。通过本研究,建议临床上若出现不明原因肺囊肿,并呈现家族聚集性,应进行基因检测以明确是否存在遗传因素,全外显子组测序作为一种经济、简洁、快速的检测技术,应作为辅助临床诊断的首选技术,文章研究为后期肺囊肿的临床诊疗指南的制定提供了借鉴内容。
